miR-34a靶向调控c-MET促进胰腺癌发展的分子机制及临床意义
2018-08-28倪晨明邵卓倪灿荣熊杰王欢胡昊金钢
倪晨明 邵卓 倪灿荣 熊杰 王欢 胡昊 金钢
微小RNA(microRNA,miRNA)是一类长度约为21~25个核糖核苷酸的非编码内源性小单链RNAs分子,通过与靶基因3′末端非编码区互补结合调控其在细胞内的表达水平,广泛参与多种细胞生理和病理过程,如细胞周期、凋亡、分化等[1-2]。miR-34a是经典的抑癌微小RNA[3-5]。为此,本研究检测胰腺癌BxPC3细胞、胰腺癌组织及匹配的癌旁正常组织miR-34a表达,明确miR-34a调控的靶基因,分析miR-34a及其靶基因的表达与胰腺癌临床病理参数的关系以及对BxPC3细胞增殖和转移能力的影响。
资料与方法
一、组织标本及胰腺癌细胞株培养
选取2013年3月至2016年6月间上海长海医院肝胆胰外科行手术切除的148例经病理证实的胰腺癌组织标本,其中男性75例,女性73例,年龄40~85岁,中位年龄61岁。高中分化102例,低分化46例;TNM分期Ⅰ~Ⅱ期138例,Ⅲ~Ⅳ期10例。取同期配对的癌旁经病理证实无癌细胞的正常胰腺组织20例。所有入组患者术前均未接受任何针对肿瘤的治疗。
人胰腺癌细胞株BxPC3购自中科院上海细胞所,常规培养、传代。取对数生长期细胞,分为对照组、miR-34a过表达组(miR-34a组)和c-MET基因沉默组(c-METsi组)。
二、方法
1.miR-34a结合位点的确定:利用Targetscan在线软件预测发现c-MET的3′非编码区(3′-UTR)存在miR-34a结合位点。采用Promega公司的pmirGLO Dual-Luciferase miRNA Target Expression系统构建c-MET-3′UTR双荧光素酶(luciferase)报告载体,按说明书分别克隆c-MET的野生型3′UTR及突变型3′UTR。采用脂质体法转染BxPC3细胞,获取firefly荧光素值与Renila荧光素信号值,以两者比值表示荧光素酶活性,以对照组的活性为100%计算。
2.miR-34a组及c-MET si组BxPC3细胞株建立:miR-34a mimic及c-MET siRNA均购自上海吉玛制药技术公司,采用脂质体方法将它们分别转染BxPC3细胞。Lipofectamine 3000购自Invitrogen Life Technologies公司,按说明书操作。
3.miR-34a及c-MET mRNA表达检测:应用miRNeasy Mini Kit(Qiagen公司,Cat.217004)抽提各组细胞总RNA;应用miRNeasy FFPE Kit(Giagen公司,Cat. 217504)抽提石蜡组织标本总RNA。miR-34a检测先用TaqManTMMicroRNA Reverse Transcription Kit(Applied Biosystems Life Technologies公司,Cat. 4366596)反转录,再用TaqManTMUniversal Master Mix II, with UNG(Cat. 4440038)及miR-34a Taqman探针(Assay ID:000425)行茎环特异性荧光定量PCR反应。c-MET mRNA检测先用PrimeScriptTMRT reagent Kit(TaKaRa公司,Cat. RR037A)反转录,再用 SYBR®Advantage®qPCR Premix(TaKaRa公司,Cat. 639676)行荧光定量PCR反应。c-MET上游引物序列5′ -GTAAGTGCCCGAAGTGTA-3′,下游引物序列5′-TTTCTTGCCATCATTGTC-3′;内参GAPDH上游引物序列5′- TGTGGGCATCAATGGATTTGG-3′,下游引物序列5′-ACACCATGTATTCCGGGTCAAT-3′。 以上所有操作均按试剂盒说明书进行。采用公式2-△△Ct计算mRNA表达量。
4.c-MET蛋白表达检测: 收集各组对数生长期细胞,用裂解液抽提细胞总蛋白,应用BCA法定量后常规行蛋白质印迹法检测c-MET蛋白表达,以GAPDH为内参。抗c-MET、GAPDH抗体均购自CST公司,最后ECL发光,X片曝光、显影、定影。用Image J软件分析,以目的条带与内参条带的灰度值比表示蛋白表达量。
取胰腺癌及匹配的癌旁组织切片,采用免疫组织化学法检测c-MET蛋白表达,以PBS代替一抗作为阴性对照。兔抗人c-MET多克隆抗体购自Abcam公司(Cad:ab74217,1∶50稀释), 兔抗鼠HRP多聚物二抗购自丹麦DAKO公司,DAB显色试剂盒购自武汉博士德生物技术有限公司。由2位病理科医师采用双盲法阅片。高倍镜下(×400)随机观察5个视野,胞质或胞膜出现黄色或棕黄色颗粒为c-MET阳性,根据阳性细胞所占比例(10%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分)及染色强度(无染色为0分,黄色为1分,深黄色为2分,褐黄色为3分)进行评分,两分值相乘,0~4分定为c-MET阴性,5~12分定为c-MET阳性。
5.细胞增殖实验:取各组对数生长期细胞,以每孔1×105细胞接种96孔板,分别培养1、2、3、4 d,每时间点设5个复孔。培养到时间后,每孔加入10 μl CCK-8溶液,继续培养4 h,上酶标仪测定各孔在450 nm处的吸光度值。实验重复3次,取均值。
6.细胞迁移实验:应用Transwell小室检测细胞迁移能力。取各组对数生长期细胞,用无血清培养液洗涤2次,上室内加入1×105个/ml的细胞悬液500 μl,下室加600μl含15% FBS的DMEM完全培养液,常规培养24 h,弃去上室内液体,用棉棒擦拭去上室底部隔膜表面覆盖的细胞,隔膜用50%甲醇液固定15 min,PBS洗3遍,用结晶紫染色30 min,风干,镜下随机取6个视野计穿膜细胞数,取均值。
三、统计学处理
结 果
一、miR-34a直接作用靶点的证实
对照组、miR-34a组c-MET野生型3′UTR细胞的荧光素酶活性分别为100%、(65.00±4.04)%,对照组、miR-34a组c-MET突变型的荧光素酶活性分别为100%、(106.70±7.27)%,miR-34a组c-MET野生型的3′UTR较对照组显著下调(t=8.66,P=0.001),而c-MET突变型3′UTR与对照组比较差异无统计学意义(t=0.92,P=0.4107),证实c-MET是miR-34a的靶基因。
二、各组细胞及胰腺癌和癌旁组织miR-34a、c-MET表达
20对匹配的胰腺癌和癌旁正常胰腺组织miR-34a表达水平分别为0.026±0.003、0.050±0.005,癌组织显著低于癌旁正常组织,平均下调1.92倍,差异有统计学意义(t=4.03,P=0.003)。
对照组、miR-34a组BxPC3细胞c-METmRNA表达水平分别为0.085±0.009、0.045±0.003;c-MET蛋白表达量为1.133±0.120、0.400±0.058(图1),miR-34a组较对照组显著下调,差异均有统计学意义(t=4.46,P=0.011;t=5.500,P=0.005)。
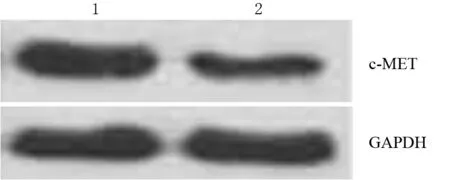
图1 对照组(1)、miR-34a组(2)BxPC3细胞 c-MET蛋白表达
三、胰腺癌组织miR-34a、c-MET蛋白表达与临床病理参数的关系
以所有胰腺癌标本miR-34a表达的中位数为界分为高表达组和低表达组,根据c-MET表达情况分为阳性组和阴性组。图2显示了胰腺癌与癌旁正常胰腺组织c-MET的蛋白表达。miR-34a高表达、c-MET阳性表达与胰腺癌TNM分期、肿瘤分化程度高度相关,而与其他临床病理参数无显著相关性(表1)。

图2 胰腺癌(2A)及癌旁正常胰腺组织(2B)c-MET蛋白表达(免疫组化 ×200)

表1 miR-34a、c-MET表达与胰腺癌临床病理参数的关系
四、miR-34a、c-MET表达对胰腺癌细胞增殖及转移的影响
对照组、miR-34a组和c-METsi组BxPC3细胞生长曲线见图3,培养第4天,miR-34a组和c-METsi组较对照组的细胞增殖活力显著下降(t=4.446,P=0.0012;t=7.869,P=0.0001);穿膜细胞数显著减少(231±12比351±16,t=5.981,P=0.0039;259±7比351±16,t=5.181,P=0.0066;图4),差异均有统计学意义。
讨 论
miR-34a在多种肿瘤的发生和发展中起到了重要作用,但其与胰腺癌关系报道较少。本研究发现相比癌旁正常组织,miR-34a在胰腺癌组织明显下调;此外,本研究也发现低水平miR-34a与肿瘤分期及细胞分化程度成正相关,提示miR-34a可能在胰腺癌细胞增殖、侵袭等生物学过程中起到关键调节作用。高增殖活性是肿瘤重要的恶性生物行为之一[6-7]。研究发现miR-34a可调控如胃癌[8]、卵巢癌[9]、子宫内膜癌[10]及胶质瘤[11]等肿瘤细胞增殖。本研究发现在胰腺癌BxPC3细胞中过表达miR-34a后,细胞增殖活性显著减弱。转移是肿瘤生物学行为的另一个重要特征。本研究同样发现胰腺癌BxPC3细胞中过表达miR-34a后,肿瘤细胞转移能力显著降低,提示miR-34a对胰腺癌具有重要的抑制作用。

图3 对照组、miR-34a组和c-METsi组BxPC3细胞的生长曲线
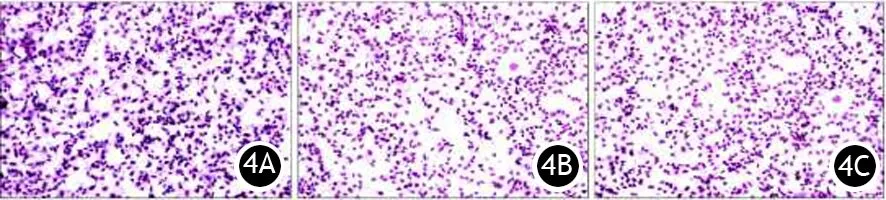
图4 对照组(4A)、miR-34a组(4B)和c-METsi组(4C)的穿膜细胞比较
利用在线预测软件发现c-MET的3′UTR存在miR-34a结合位点。c-MET是胰腺癌重要的预后因子,高水平的c-MET往往提示患者预后不良[12-13]。研究发现,c-MET与其配体肝细胞生长因子受体结合引起酪氨酸的自身磷酸化,激活多条信号通路,调控肿瘤细胞的增殖、转移和侵袭;此外c-MET还和血管内皮生长因子受体一起协同参与新生血管的形成[14]。本研究发现,c-MET在胰腺癌组织中阳性率达33.7%(50/148),并且与胰腺癌临床分期及细胞分化程度成正相关;抑制c-MET表达后,细胞增殖及转移能力明显下降,表明c-MET对胰腺癌有显著的促进作用。进一步研究发现,过表达miR-34a可下调c-MET的转录及蛋白表达水平;双荧光素酶报告载体系统也提示miR-34a可与c-MET的3′UTR直接作用而发挥抑制作用;组织检测也发现miR-34a与c-MET表达呈负相关,提示胰腺癌发展过程中,逐渐下调的miR-34a不足以抑制c-MET表达,导致其部分活化,而促进胰腺癌发生。
综上所述,miR-34a在胰腺癌中低表达,而其靶基因c-MET表达增高,两者表达呈负相关,并与临床分期及肿瘤分化程度高度相关。体外实验表明过表达miR-34a或抑制c-MET后可显著减弱胰腺癌细胞增殖及转移活性,表明miR-34a的抑癌活性可部分通过抑制c-MET得以实现,miR-34a及c-MET有望成为胰腺癌新的诊治靶点。
