神经调节蛋白1β与卡托普利对慢性心衰大鼠心肌纤维化及转化生长因子β1的影响*
2018-08-27王学惠朱秀英贵英英赵国安
王学惠, 朱秀英, 贵英英, 赵国安△
(1新乡医学院第一附属医院心血管内科, 新乡医学院心血管病诊疗中心,2新乡医学院第一附属医院急诊科, 河南 卫辉 453100)
心脏重构伴随慢性心力衰竭的发生发展,是心力衰竭(简称心衰;heart failure,HF)发生发展的核心机制,包括心肌细胞的肥大和间质的纤维化[1]。心肌纤维化是指心肌正常组织中胶原纤维过量聚积和胶原成分发生改变,是心室重构的重要表现形式之一[2]。研究表明神经调节蛋白1β(neuregulin-1β,NRG-1β)在心脏中有多种生物学的功效,包括促进心肌细胞存活、生长、分化和增殖,抗凋亡,维持肌原纤维的结构,抗衡肾上腺素能的作用,促进血管再生,用于治疗多种诱因导致的心力衰竭[3-5]。近年来也有研究表明,NRG-1β改善心功能机制之一是抑制心肌纤维化[6]。血管紧张素转化酶抑制剂是治疗心衰的基石,通过抑制肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)激活,抗凋亡,抑制心肌纤维化,从而逆转左室重构[7],卡托普利(captopril,CAP)是其代表性的药物。NRG-1β联合卡托普利治疗心衰是否能加强抗心衰的效应,进一步改善预后及其机制目前尚不明确。本研究以容量超负荷心衰大鼠为模型,通过外源性给予NRG-1β 及卡托普利在体干预,观察比较两者对大鼠心功能及心肌纤维化的影响,探讨两者联合治疗的作用及机制。
材 料 和 方 法
1 材料
NRG-1β购于ProSpec-Tany TechnoGene;卡托普利由Bristol-Myers Squibb 惠赠;[125I]血管紧张素II放射免疫检测药盒购于北京北方生物技术研究所;兔抗鼠转化生长因子β1(transforming growth factor-β1,TGF-β1)多克隆抗体、兔抗鼠α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)多克隆抗体和辣根过氧化物酶标记的山羊抗鼠IgG 购于Santa Cruz。
2 实验动物模型建立及分组
清洁级青年雄性Sprague-Dawley(SD)大鼠,体重160~180 g,购于西安交通大学实验动物中心,动物合格证号为SCXK2007-001,均予正常饮食、自由饮水。50只大鼠随机分成5组:假手术组(sham 组)、心衰组(HF组)、NRG组、卡托普利组(CAP 组)和联合用药组(NRG+CAP 组),每组10 只。采用腹主动脉-下腔静脉穿刺造瘘(aortocasval fistula,ACF)手术制作大鼠慢性心力衰竭动物模型,参照Garcia等[8]的方法并做改进。Sham组只穿刺不造瘘;NRG组ACF术后8 周,大鼠尾静脉注射NRG-1β (10 μg·kg-1·d-1),连续7 d,之后继续饲养至12 周;CAP 组ACF 术后第2 天开始给予卡托普利灌胃(13.5 mg·kg-1·d-1),8周后经大鼠尾静脉注射同等量的生理盐水,连续7 d,之后继续饲养至12周;NRG+CAP组ACF术后第2天开始给予卡托普利灌胃(13.5 mg·kg-1·d-1),8 周后经大鼠尾静脉注射NRG-1β(10 μg·kg-1·d-1),连续7 d,之后继续饲养至12 周。
3 方法
3.1超声心动图测定心脏大小和心功能 水合氯醛(300 mg/kg) 腹腔内注射麻醉。大鼠仰卧位,将其四肢固定于木板上,剃净胸部毛,使用Philips Sonos 5500多功能超声诊断仪,经胸超声探头频率为2.5~3.5 MHz,测量左室舒张末期内径(left ventrieular end-diastolic diameter,LVEDD)、左室收缩末期内径(left ventricular end-stolic diameter,LVESD)、左室射血分数(left ventricular ejection fraction, LVEF)和左室短轴缩短率(left ventricular fractional shortening, LVFS)等指标。
3.2Masson染色检测胶原的含量 左室心肌组织常规行石蜡包埋,组织切片,片厚5 μm,行Masson三色染色法观察心肌纤维化的程度。显微镜下观察Masson染色切片,胶原纤维呈蓝色,肌纤维呈红色。左室心肌间质纤维沉积的评价:每组动物取5张切片,每张切片取5个高倍视野,用Image Pro-Plus 6.0图像分析软件分析,计算出胶原容积分数(collagen volume fraction,CVF),即胶原纤维面积占整个心肌组织面积的百分比,取测量的平均值比较。
3.3血浆中血管紧张素II(angiotensin II,Ang II)的测定 麻醉同前。从大鼠的腹主动脉抽出血液约2 mL,注入到特殊的酶抑制剂管中,充分混匀后即刻放入4 ℃冰箱中静置1~2 h,取出后2 500 r/min离心7 min分离血浆,吸取上清液保存于EP管。利用放射免疫计数器测量各组样品放射强度并制作标准曲线,然后分别计算出Ang II的含量。具体实验步骤参照产品试剂盒说明书进行。
3.4TGF-β1和α-SMA的定量检测 取30 mg左右的左室心肌组织液氮研磨、RIPA裂解后用BCA法测蛋白浓度,根据所测得样本蛋白浓度上样,每孔蛋白上样质量50 μg,SDS-PAGE分离后,采用Western blot法将胶上蛋白质转至 PVDF 膜,5%脱脂奶粉室温封闭 2 h 后,分别加入抗TGF-β1、α-SMA 和 GAPDH的抗体,4 ℃摇床孵育过夜,TBST溶液洗膜后加入 II 抗室温孵育2 h,TBST洗膜后,加入ECL显色,凝胶成像仪扫描拍照,用 UVIdoc 软件进行条带灰度分析,以TGF-β1、α-SMA 与 GAPDH 条带的积分吸光度(IA) 比值来评定2 种蛋白质的表达水平。
3.5心肌超微结构的观察 麻醉后立即开胸取出心脏,迅速取左心室前壁心肌,切成1 mm×1 mm×1 mm的大小块状,立即浸入2.5%的戊二醛复方固定液中,标本送检于西安交通大学电镜实验中心,使用日立H-7650型透射电子显微镜,观察不同组别心肌组织的超微结构。
4 统计学处理
采用SPSS 13.0软件统计分析,计量数据用均数±标准差(mean±SD)表示,多组间比较用单因素方差分析,两两比较用 SNK-q检验。以P<0.05 为差异有统计学意义。
结 果
1 各组大鼠超声心动图检查结果
与sham组相比,HF组LVESD和LVEDD明显增大,提示左室心腔扩大;LVEF和LVFS减小,提示左室收缩功能下降(P<0.05)。与HF组比较,NRG组、CAP组和NRG+CAP组的LVESD和LVEDD均明显减小(P<0.05),LVEF和LVFS明显增加(P<0.05),提示各治疗组均能使左室心腔缩小,左室收缩功能明显改善,逆转左室重构,且NRG+CAP组改善最明显,差异有统计学意义(P<0.05),见图1。
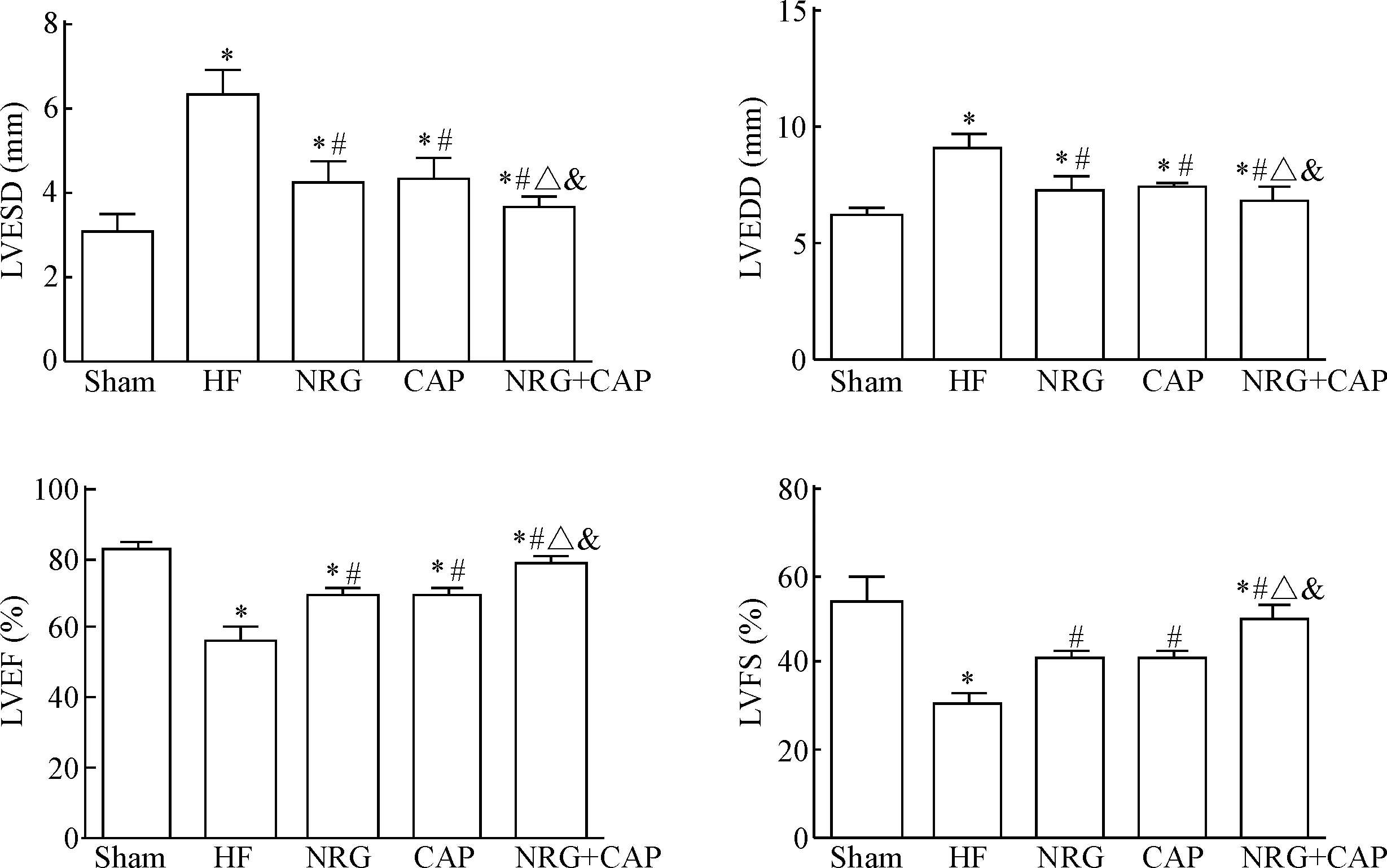
Figure 1. The echocardiographic indexes in various groups. Mean±SD.n=6.*P<0.05vssham group;#P<0.05vsHF group;△P<0.05vsNRG group;&P<0.05vsCAP group.
2 左室心肌组织Masson染色
Sham组心肌组织无胶原增生,HF组心肌组织间出现大量的胶原纤维增生,CVF显著增高于假手术组(P<0.05),各治疗组的胶原纤维明显减少,与HF组相比,CVF显著降低(P<0.05),且NRG+CAP组效果最明显(P<0.05),见图2、表1。
3 各组大鼠血浆Ang II水平的比较
与Sham 组相比,HF 组大鼠的血浆Ang II水平明显升高(P<0.05);各治疗组的血浆Ang II水平明显降低,且NRG+CAP组效果最明显(P<0.05),见表1。
4 各组大鼠左室心肌组织超微结构的观察
Sham组的心肌细胞结构清晰,肌原纤维排列整齐,肌节完整,Z线结构清晰,线粒体嵴结构清晰;HF组的心肌细胞肿胀,肌原纤维结构松散,部分肌原纤维断裂、溶解,排列紊乱,部分Z线消失,线粒体嵴减少,结构不清晰,心肌细胞间可见大量胶原纤维;各治疗组的心肌细胞肿胀减轻,肌原纤维结构疏松,排列基本整齐,Z线结构较清晰,线粒体略有增生,嵴较清晰,心肌细胞间可见胶原纤维轻度增生;NRG+CAP组效果最明显,胶原纤维很少见,见图3。
5 各组大鼠左室心肌组织TGF-β1和α-SMA表达水平的比较
HF组TGF-β1 表达水平较sham组明显升高(P<0.05),NRG组、CAP组和NRG+CAP组TGF-β1表达水平较模型组明显降低,其中NRG+CAP组表达水平最低(P<0.05)。α-SMA在各组大鼠表达水平与TGF-β1趋势相似,见图4。

Figure 2. Masson staining of the left ventricular tissues in various groups (×200).

表1 各组大鼠左室心肌组织胶原容积分数和Ang II浓度的比较
*P<0.05vssham group;#P<0.05vsHF group;△P<0.05vsNRG group;&P<0.05vsCAP group.
讨 论
本实验通过NRG-1β 与卡托普利单用及联合应用对慢性心力衰竭大鼠干预的结果显示,与sham组比较,HF组大鼠LVESD和LVEDD明显增加,提示左室心腔扩大,发生左室重构;LVEF和LVFS减小,提示左室收缩功能下降;而与HF组相比,NRG、CAP组及NRG+CAP组大鼠LVESD和LVEDD明显减小,提示左室心腔缩小,左室重构明显逆转;LVEF和LVFS明显增加,提示左室收缩功能明显改善,其中NRG组与CAP组的差异无统计学显著性,并以NRG+CAP组改善最为明显,说明NRG-1β的疗效与卡托普利相似,而联合用药比单独用药能更好地改善心功能。
对各组大鼠左室心肌行Masson染色及超微结构观察,结果表明,与sham组相比,HF组大鼠左室心肌组织出现明显心肌纤维化,CVF明显升高;电镜下,HF组心肌超微结构明显受损,可见大量胶原纤维增生。而与HF组相比,NRG、CAP组及NRG+CAP组大鼠左室心肌纤维化程度明显减轻,超微结构受损减轻,而NRG+CAP组改变最明显,说明NRG-1β与卡托普利联合应用能进一步抑制心肌纤维化,改善左室重构。
TGF-β1是TGF-β多功能大家族的重要组成成员,是胶原纤维和其它细胞外因子合成和沉积的强有力促进因子,与多种器官的纤维化密切相关[9]。研究证实,慢性心衰大鼠模型心肌组织中的TGF-β1表达明显增强[10];而α-SMA 作为心肌间质细胞,其数量多,与心肌细胞最贴近,可抑制心肌细胞外基质降解酶,促进心肌纤维化,在心肌纤维化发展中起重要作用[11-13]。体外实验也显示,TGF-β1能促进心脏成纤维细胞增殖和转变成肌纤维细胞,促进成纤维细胞中α-SMA 的表达,并产生大量的细胞外基质,如胶原纤维和纤维黏连蛋白等[14]。心肌纤维化发生与TGF-β1 表达增高、Ang II的作用密切相关,Ang II可通过刺激TGF-β1及其Smads信号转导通路,进而增加I、III型胶原和纤连蛋白的合成,并促进心肌纤维化的发生[13,15]。本研究也表明,HF组大鼠血清Ang II浓度明显升高,TGF-β1和α-SMA表达明显增加,与文献报道相符。
NRG-1及其ErbB受体形成的NRG-1/ErbB2信号系统参与心脏结构形成、功能维持,心力衰竭时NRG-1/ErbB2信号系统受损,与心衰发生发展密切相关。研究认为,心衰引起心肌纤维化的主要机制是RAAS的激活,而该系统中的关键活性成分为Ang II,促进一系列生长因子TGF-β1 等分泌增加[16]。
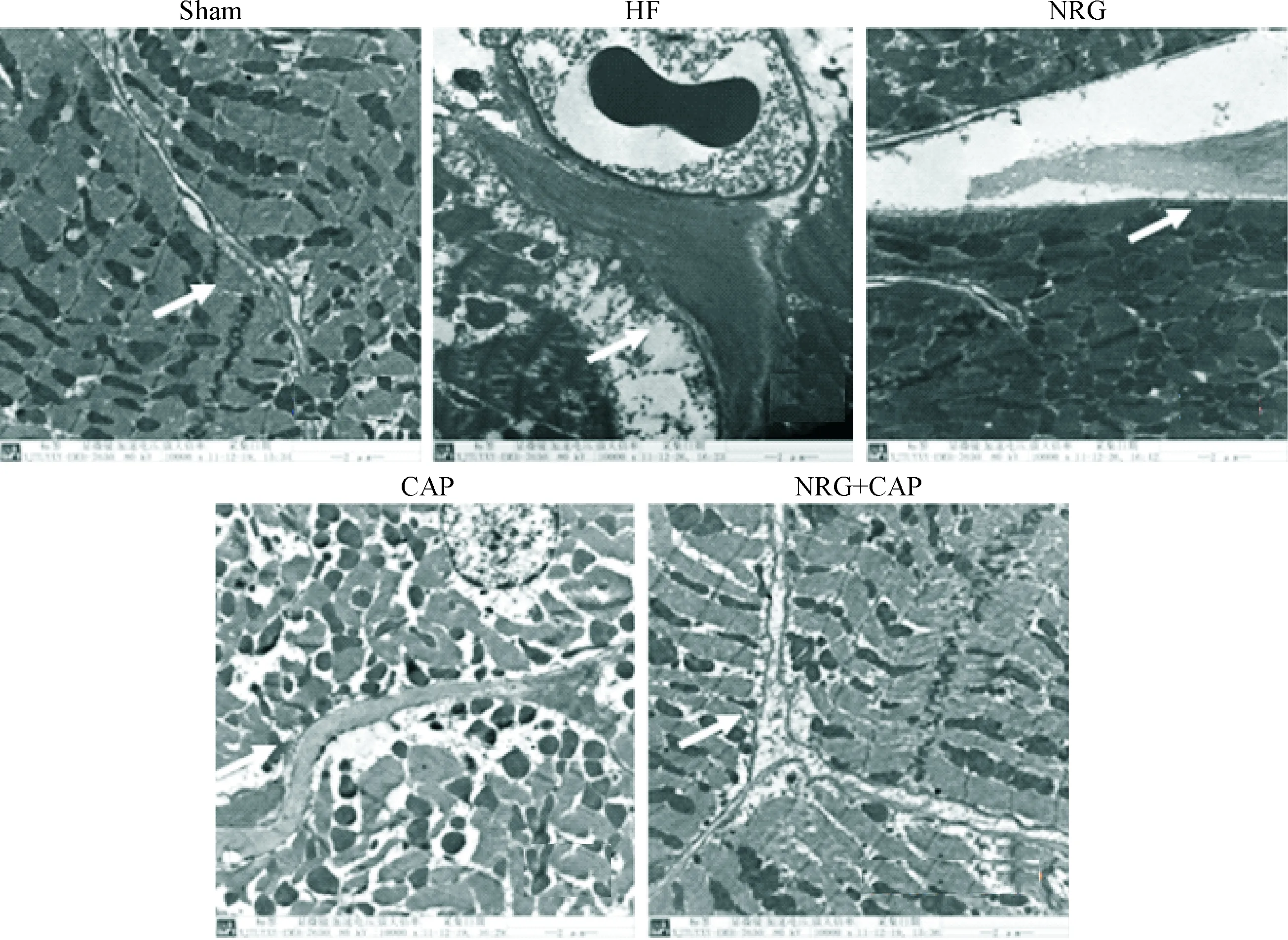
Figure 3. Ultrastructure of the left ventricle in various groups (×10 000).

Figure 4. Protein expression of TGF-β1 and α-SMA in left ventricle in various groups. Mean±SD.n=3.*P<0.05vssham group;#P<0.05vsHF group;△P<0.05vsNRG group;&P<0.05vsCAP group.
外源性NRG-1在体干预整体心衰动物能显著改善心脏的收缩功能,已得到许多研究结果的证实,其中NRG-1能减轻心肌纤维化是其发生作用的主要机制之一。Li等[17]报道NRG-1明显减轻糖尿病性心肌病的心肌纤维化,降低CVF,与NRG-1抑制RAAS激活、降低Ang II水平有关,NRG-1还可与TGF-β1竞争ErbB受体,延缓纤维化的发生。Galindo等[6]研究表明,NRG-1β能抑制TGF-β1诱导的Smad3磷酸化,减少大型心衰动物猪的心肌成纤维细胞生成,降低α-SMA表达水平。本研究结果也表明NRG-1β显著降低NRG组大鼠血浆Ang II水平,降低TGF-β1、α-SMA表达水平,减轻心肌纤维化,与文献报道相符。
RAAS抑制剂除了影响胶原纤维总量,还通过调节不同类型胶原的比例及网络支架重构来改善心肌纤维化[7, 11]。卡托普利是临床最常用的的血管紧张素转化酶抑制剂,能抑制RAAS激活,降低血浆Ang II水平,早已常规应用于慢性心衰疾病的预防治疗。大量的研究表明,抑制心肌纤维化,改善心室重构是其治疗心衰的主要机制之一[7]。本研究也发现,卡托普利能降低大鼠血浆Ang II水平,降低TGF-β1、α-SMA表达水平,减轻心肌纤维化。而其与NRG-1β 联合应用,作用叠加,降低血浆Ang II水平,抑制心肌纤维化作用明显加强,心功能得到了进一步的改善。本研究结果提示NRG-1β与卡托普利联合应用进一步降低血浆Ang II水平,抑制TGF-β1和α-SMA 的表达,可能是联合用药优于单一用药抗纤维化作用的分子机制之一。
综上所述,该实验证实了NRG-1β 与卡托普利抗心肌纤维化疗效相似,以联合用药效果最佳,联合用药较单一用药更能有效改善心功能,抑制心肌纤维化,延缓心力衰竭,为临床治疗慢性心衰的联合用药提供了实验依据,其详细分子机制需大量研究来阐明。
