Zeste基因增强子同源物2通过调控Wnt/β-catenin信号通路影响脑胶质瘤细胞凋亡*
2018-08-27邢晓红边志颖彭延波
李 巍, 邢晓红, 边志颖, 彭延波
(1唐山职业技术学院临床医学系, 河北 唐山 063000;2保定市第一中心医院内分泌三科,河北 保定 071000;3华北理工大学附属医院神经内科, 河北 唐山 063000)
脑胶质瘤起源于神经外胚层,是最为常见的神经系统恶性肿瘤,在全部的颅内肿瘤中约占45%。其中,星形胶质细胞瘤在全部脑胶质细胞瘤中最为常见,放疗、化疗及综合治疗等是常见的治疗手段,这些方法已经取得了很多进步,但是由于胶质瘤的恶性程度较高,还需要寻找有效的方法延长胶质瘤患者的生存期,随着人们对肿瘤发病机制的不断研究,基因靶向治疗已经成为了重要的治疗方法[1-3]。Zeste基因增强子同源物2(enhancer ofzestehomolog 2,EZH2)是近年来发现的一种与果蝇zeste基因的增强子有关的人类同源基因,其在肿瘤中是多种高度沉默的基因的转录抑制因子,在膀胱癌、乳腺癌和胶质瘤等肿瘤中高度表达,并且与肿瘤细胞的增殖等有关,而对于其作用机制尚不十分清楚[4-6]。Wnt/β-catenin信号通路在肿瘤中过度激活,并且与细胞内癌基因和抑癌基因调控肿瘤的发展有关[7]。本实验以胶质瘤细胞为体外研究对象,探讨EZH2在胶质瘤细胞凋亡中的作用机制,为靶向EZH2治疗胶质瘤提供理论参考。
材 料 和 方 法
1 主要材料
胶质瘤U87、H4和U251细胞和正常人脑星形细胞(normal human astrocytes,NHA)购自ATCC,细胞以10%胎牛血清的DMEM培养,以0.25%胰蛋白酶消化传代。RT-qPCR试剂盒购自大连宝生物;β-actin和EZH2引物由上海生工合成;二喹啉甲酸(bicinchoninic acid,BCA)定量试剂盒和caspase-3活性检测试剂盒购自碧云天;RNA提取试剂盒购自北京索莱宝;抗EZH2、β-连环蛋白(β-catenin)和c-Myc抗体购自CTS。
2 方法
2.1RT-qPCR检测胶质瘤细胞中EZH2 mRNA的表达 胶质瘤U87、H4和U251细胞和NHA用TRIzoi法细胞RNA提取试剂盒提取细胞中的总RNA,反转录合成cDNA 后,进行RT-qPCR。反应条件为:95 ℃ 2 min; 95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s,共40个循环。以2-ΔΔCt法计算EZH2表达水平。β-actin为内参照。EZH2的上游引物序列为5′-TGATGACGATGATGATGATGGAGAC-3′, 下游引物序列为5′-TGTGCCCTTATCTGGAAACATTGAG-3′;β-actin的上游引物序列为5′-GGACCTGACTGACTACCTC-3′,下游引物序列为5′-TACTCCTGCTTGCTGAT-3′。
2.2Western blot检测胶质瘤细胞中EZH2的蛋白表达 胶质瘤U87、H4和U251细胞和NHA按照细胞蛋白提取试剂盒提取细胞中的总蛋白,以BCA蛋白定量试剂盒检测各组蛋白样品的浓度。取蛋白样品,每个泳道添加40 μg蛋白进行电泳,实验所用凝胶为5%浓缩胶和10%分离胶。初始电泳电压为80 V,电泳时间为30 min,再把电压调整到120 V,继续电泳约2 h后,取出凝胶,把裁剪好的NC膜在转移缓冲液中充分浸泡后,在300 mA电流中转膜。取出膜,以5%的脱脂奶粉在室温孵育120 min。封闭结束以后,把膜放在1∶800稀释后的EZH2抗体中,置于4 ℃过夜。取出膜,再与1 ∶4 000稀释的II抗孵育,于室温中孵育1 h。ECL发光以后,曝光,对各组蛋白的灰度值进行定量,以每组样品中GAPDH的灰度值作为对照,对蛋白表达进行定量。
2.3细胞分组 胶质瘤细胞H4在转染前1 d,以5×108/L的细胞密度接种到6孔板中,细胞融合度约为60%时,进行细胞转染。取250 μL的Opti-MEM培养液和5 μL的Lipofectamine 2000混合后,静置5 min;再取250 μL的Opti-MEM培养液分别和5 μL的EZH2 siRNA和 siRNA control混合,静置5 min。把上述2种混合液混合后,静置20 min。添加到上述细胞中,6 h后,把上清吸除,加入细胞培养液继续培养。在培养24 h后,进行RT-qPCR和Western blot检测,测定细胞中EZH2的表达,具体操作方法同上。胶质瘤细胞H4中转染EZH2 siRNA和 siRNA control后记为EZH2 siRNA组和siRNA-NC组,同时把只在细胞中添加转染试剂的细胞作为对照(control)。
2.4MTT法测定细胞活力 Control组、siRNA-NC组和EZH2 siRNA组细胞分别培养24 h、48 h、72 h和96 h,在每孔中添加5 g/L的MTT各20 μL,置于37 ℃条件下孵育4 h。把每个孔内的液体吸除以后,以每孔中添加150 μL DMSO,避光反应10 min。测定每孔490 nm的吸光度(A)值。
2.5流式细胞术测定细胞凋亡 Control组、siRNA-NC组和EZH2 siRNA组细胞在培养48 h后用胰蛋白酶消化,在细胞沉淀中添加PBS,把细胞洗涤3次。在细胞内加入400 μL的binding buffer,悬浮以后,在细胞悬浮液内依次加入5 μL的Annexin V-FITC,置于4 ℃的避光环境中孵育15 min。再添加10 μL的PI,立即用流式细胞术检测。
2.6分光光度计法检测caspase-3活性 Control组、siRNA-NC组和EZH2 siRNA组细胞在培养48 h以后,用分光光度计法检测各组胶质瘤细胞中caspase-3活性,具体操作方法参照caspase-3活性测定试剂盒。结果以转染以后的细胞A值与control细胞A值的比值作为caspase-3活性水平。
2.7Western blot测定β-catenin和c-Myc的蛋白水平 Control组、siRNA-NC组和EZH2 siRNA组细胞在培养48 h后,用Western blot方法测定各组胶质瘤细胞中的β-catenin和c-Myc蛋白水平,操作方法同上。
2.8激活 Wnt/β-catenin信号通路对胶质瘤细胞的影响EZH2 siRNA细胞培养液中添加Wnt/β-catenin信号通路激活剂LiCl,LiCl的浓度为15 mmol/L,记为EZH2 siRNA+LiCl组,流式细胞术测定细胞凋亡,Western blot测定β-catenin和c-Myc蛋白水平,分光光度计法测定细胞中caspase-3活性,操作方法同上。
3 统计学分析
所有实验数据采用SPSS 21.0软件进行分析,计量资料用均数±标准差(mean±SD)表示,两组数据间比较经t检验,多组差异比较采用单因素方差分析,组间比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 EZH2在胶质瘤细胞中高表达
U87、H4和U251细胞中EZH2的mRNA和蛋白水平明显高于NHA(P<0.05)。H4细胞中EZH2的mRNA和蛋白水平明显高于U251和U87细胞(P<0.05),见图1。这说明EZH2在脑胶质瘤中表达升高,并且在H4细胞中的表达水平最高,因此我们选用H4细胞做后续实验。
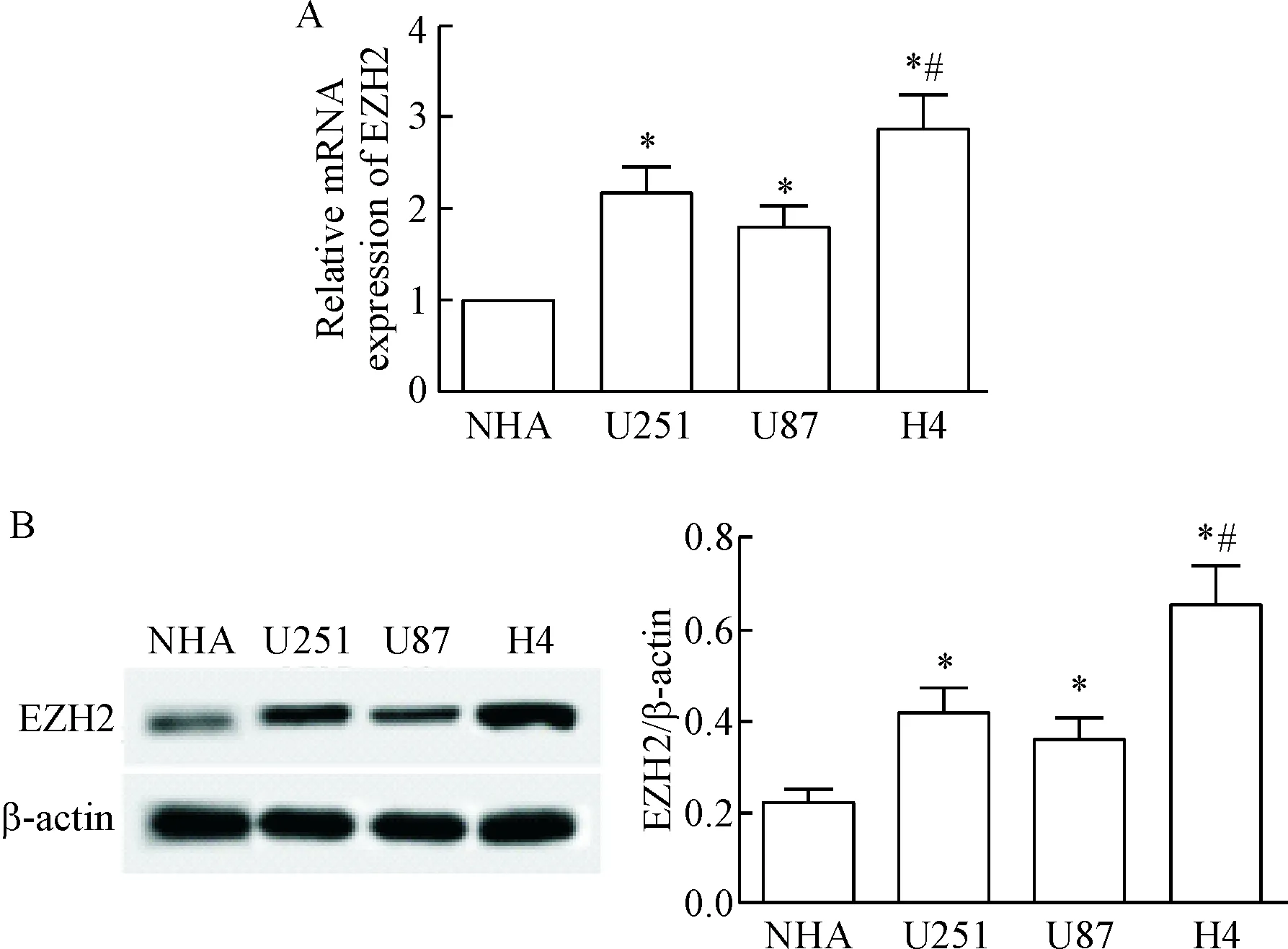
Figure 1. The expression of EZH2 in glioma U87, H4 and U251 cells and NHA. A: the mRNA expression of EZH2; B: the protein expression of EZH2 determined by Western blot.Mean±SD.n=3.*P<0.05vsNHA;#P<0.05vsU87 and U251.
2 转染EZH siRNA后胶质瘤细胞中EZH2的表达
siRNA-NC组细胞中EZH2的mRNA和蛋白水平与control组相比差异没有统计学显著性;EZH2 siRNA组细胞中EZH2的mRNA和蛋白水平与control组相比明显降低(P<0.05),见图2。
3 EZH2表达下调抑制胶质瘤细胞的活力
MTT细胞活力检测结果显示,control组、siRNA-NC组和EZH2 siRNA组细胞24 h的A值无明显变化;siRNA-NC组细胞48 h、72 h和96 h的A值与control组相比差异没有统计学显著性;EZH2 siRNA组48 h、72 h和96 h的A值与control组相比明显降低(P<0.05),见图3。
4 EZH2下调诱导胶质瘤细胞凋亡
siRNA-NC组细胞的凋亡率和caspase-3活性与control组相比差异没有统计学显著性;EZH2 siRNA组细胞凋亡率和caspase-3活性与control组相比明显升高(P<0.05),见图4。这说明EZH2下调可以诱导胶质瘤细胞凋亡。

Figure 2. The expression of EZH2 in the glioma cells after transfection. A: the mRNA expression of EZH2 determined by real-time PCR; B the protein expression of EZH2 determined by Western blot. Mean±SD.n=3.*P<0.05vscontrol group.
图2转染后的胶质瘤细胞中EZH2表达水平的变化
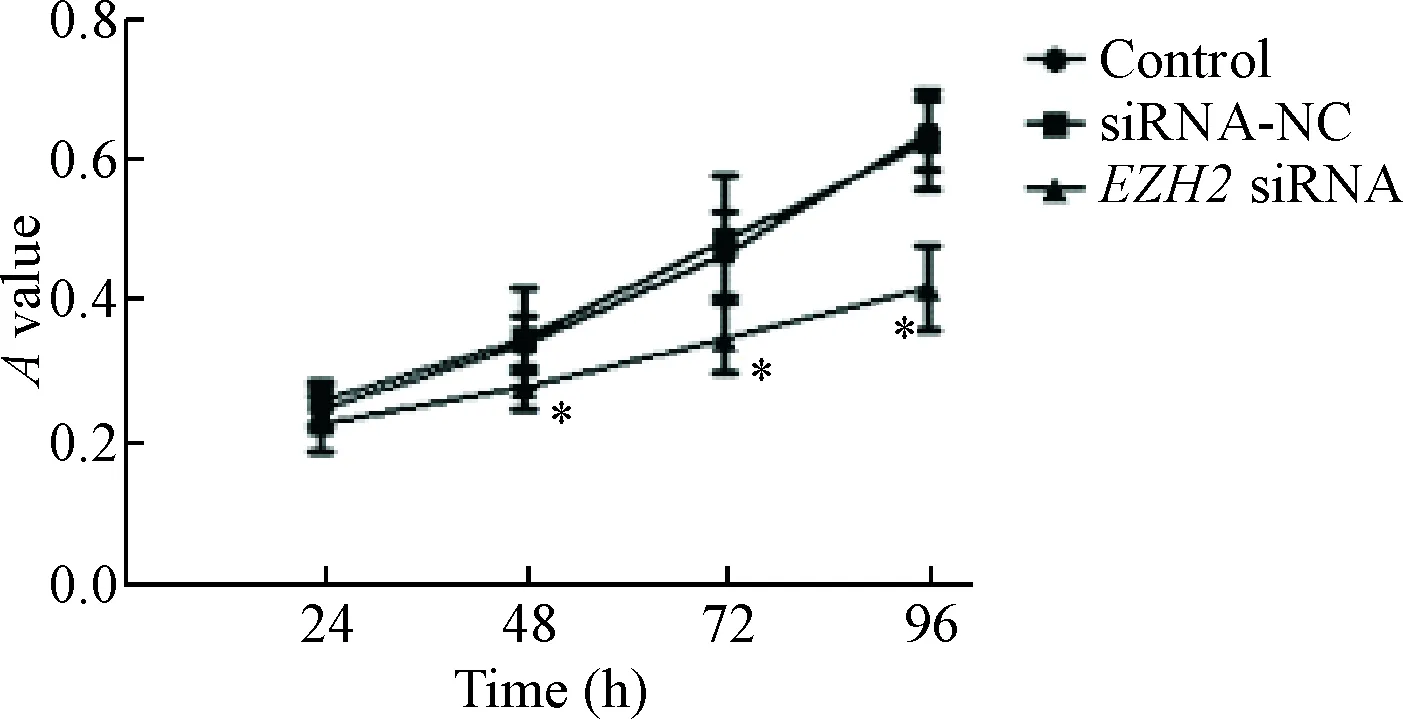
Figure 3. The changes of cell growth curves after knockdown ofEZH2 expression. Mean±SD.n=3.*P<0.05vscontrol group.
5 EZH2下调抑制Wnt/β-catenin信号通路相关蛋白的表达
siRNA-NC组细胞中β-catenin和c-Myc蛋白水平与control组相比差异没有统计学显著性;EZH2 siRNA组细胞的β-catenin和c-Myc蛋白水平与control组相比明显降低(P<0.05),见图5。这说明c-Myc下调抑制Wnt/β-catenin信号通路的激活。
6 激活Wnt/β-catenin信号通路对胶质瘤细胞凋亡的影响
EZH2 siRNA+LiCl组细胞的凋亡率和caspase-3活性与EZH2 siRNA组相比明显降低(P<0.05)。EZH2 siRNA+LiCl组细胞的β-catenin和c-Myc蛋白水平与EZH2 siRNA组相比明显升高(P<0.05),见图6。这说明激活Wnt/β-catenin信号通路可以拮抗EZH2下调诱导的胶质瘤细胞凋亡。
讨 论
EZH2属于Polycomb group (PcG)蛋白成员之一,而PcG蛋白家族参与调控组蛋白的修饰,而组蛋白的修饰与肿瘤的发生有关[8]。EZH2对于组蛋白去乙酰化酶和DNA甲基转移酶等均有调控作用,可以通过抑制靶基因的激活诱导细胞的生长;EZH2可以通过作用于细胞增殖相关的基因转录影响胃癌细胞的增殖,并且其在肿瘤干细胞基因激活和抑癌基因的转录中均有重要作用;EZH2在很多恶性肿瘤中表达上调,在小鼠中抑制EZH2活性可以阻碍肿瘤的发展;EZH2还能够调控前列腺癌、淋巴瘤和大肠癌等多种肿瘤细胞的生长[9-15]。本实验表明,EZH2在胶质瘤U87、H4和U251细胞中的表达水平高于NHA;敲减EZH2后的胶质瘤细胞从48 h开始,增殖活性受到抑制。
本实验结果还发现,敲减EZH2表达后的胶质瘤细胞中caspase-3的活性升高,细胞凋亡率也明显升高,即敲减EZH2可诱导胶质瘤细胞凋亡。肿瘤细胞的凋亡与细胞内的多种基因和信号的传递有关,是一个复杂的多环节过程。Caspase蛋白家族含有多个蛋白成员,其可以被外界因子和信号激活,caspase凋亡反应的起始因子到效应因子迅速被激活,最终发挥凋亡执行的作用,caspase蛋白以没有活性的酶原形式存在于细胞内,只有经过活化后才可以发挥其生物学作用[16]。EZH2可以通过激活caspase级联反应诱导细胞凋亡的发生,而caspase-3是凋亡的执行因子,是重要的凋亡促进因子[17-18]。
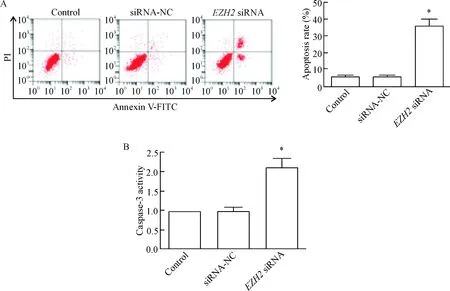
Figure 4. Knockdown ofEZH2 expression induced apoptosis of glioma cells. A: flow cytometry was used to determine the apoptosis rate after down-regulation ofEZH2; B: the changes of caspase-3 activity. Mean±SD.n=3.*P<0.05vscontrol group.
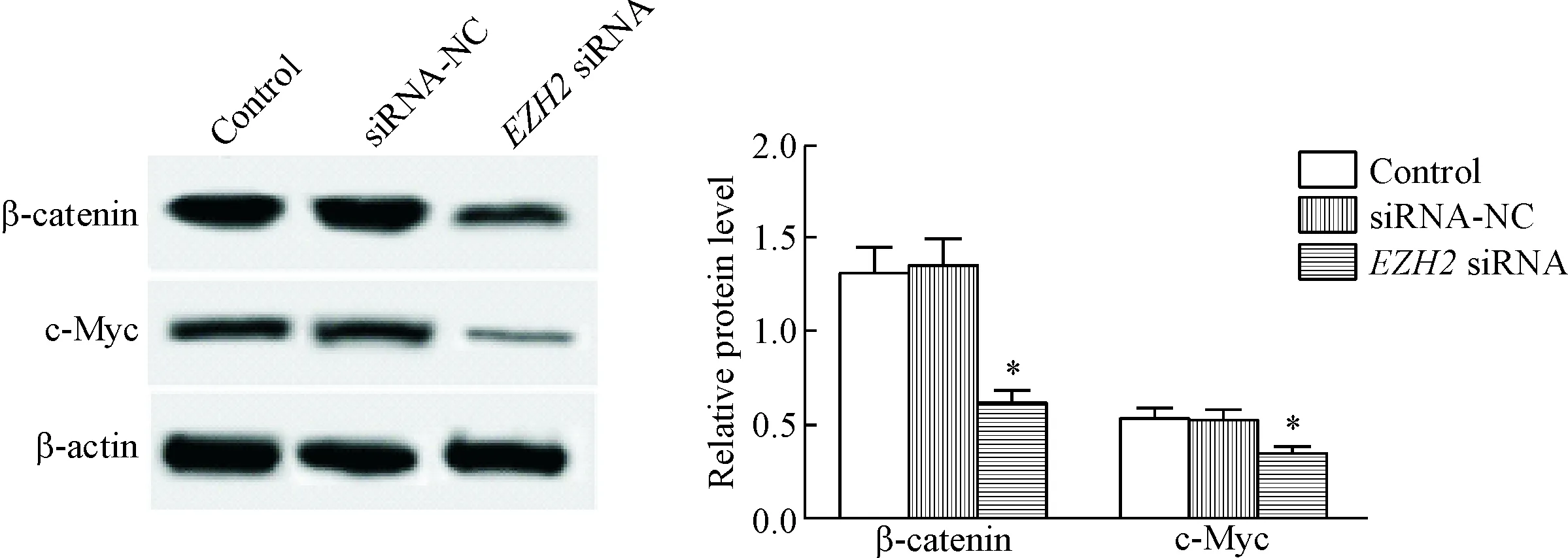
Figure 5. Knockdown ofEZH2 expression inhibited the levels of Wnt/β-catenin signaling pathway-related proteins. Mean±SD.n=3.*P<0.05vscontrol group.
Wnt/β-catenin信号通路在人类的疾病发生中具有广泛的调控作用,其具有高度保守性,在组织胚胎的发育中有关键作用,在正常的组织中激活水平极低[19]。近年来研究显示,Wnt/β-catenin信号通路在肿瘤中呈激活状态,与肿瘤恶性程度有关[20]。β-catenin在正常的细胞中以复合体的形式在细胞膜上存在,在受到相关信号的刺激以后,β-catenin在细胞质中积累,转入到细胞核内,启动下游靶基因c-myc的转录和表达[21]。有研究报道称,Wnt/β-catenin信号通路与EZH2具有一定的内在联系,EZH2可以通过促进β-catenin表达增加乳腺癌细胞扩增能力;RNA干扰肾癌细胞中EZH2表达可以通过下调Wnt/β-catenin信号通路的激活水平降低细胞的侵袭能力;同样在结肠癌细胞和宫颈癌细胞中证实,EZH2具有正调控Wnt/β-catenin信号通路的作用[22-26]。本实验的结果表明,EZH2下调后的Wnt/β-catenin信号通路激活水平降低,并且Wnt/β-catenin信号通路激活剂可以减弱下调EZH2对胶质瘤细胞凋亡的作用,说明EZH2表达下调可以通过Wnt/β-catenin信号通路影响胶质瘤细胞的凋亡。

Figure 6. Effect of activation of Wnt/β-catenin signaling pathway on glioma cell apoptosis after knockdown ofEZH2 expression. A: Western blot was used to determined the protein levels of β-catenin and c-Myc in the cells; B: flow cytometry was used to determine the apoptosis; C: the changes of caspase-3 activity in the cells. Mean±SD.n=3.*P<0.05vs EZH2 siRNA group.
以上表明,EZH2表达下调通过抑制Wnt/β-catenin信号通路诱导胶质瘤细胞凋亡。EZH2可能是治疗胶质瘤的一个潜在靶点,对于其在其它胶质瘤细胞中的作用还需要进一步验证。本研究为探讨EZH2在肿瘤中的作用机制奠定了基础,对于研究肿瘤的发病机制具有重要意义。
