ADMA对交感神经损毁自发性高血压大鼠血压和肾功能的作用*
2018-08-27杨秀春鲁静朝裴玮娜郭会军吴岩熹
肖 冰, 杨秀春, 鲁静朝, 裴玮娜, 郭会军, 王 帆, 吴岩熹, 刘 凡
(河北医科大学第二医院心内科, 河北 石家庄 050000)
高血压是临床常见的心血管疾病之一,严重影响心脏、大脑和肾脏等重要脏器的功能。高血压肾脏损害早期起病隐匿,一旦出现临床症状,损害就会进行性加重,直至出现终末期肾病。大量的研究证明,早期发现肾脏损害并进行合理干预,可以延缓肾脏损害进展,减少心血管事件和慢性肾脏病患者总体死亡率[1-2]。
交感神经系统活性增加可能为高血压肾病的发病机制之一[3]。Ott等[4]报道,去肾交感神经术可以有效降低患者血压,而且能够改善慢性肾脏病患者肾功能。不对称二甲基精氨酸(asymmetric dimethylarginine,ADMA)是内源性一氧化氮合酶(nitric oxide synthase,NOS)抑制物之一,能抑制一氧化氮(nitric oxide,NO)生成,被认为是慢性肾脏病患者中心血管疾病的独立危险因素。大量研究报道,在慢性肾脏病患者体内,ADMA水平与肾小球滤过率呈负相关[5-6]。众多研究表明,在实验性高血压动物和临床高血压患者中ADMA水平明显升高[7-9]。Mallamaci等[10]报道,终末期肾病患者的血ADMA水平与去甲肾上腺素(norepinephrine,NE)水平存在较强相关性。有研究显示,在清醒大鼠中,ADMA诱导交感神经激活[9]。然而,交感神经系统、ADMA与肾功能之间的关系仍然未知。因此,我们以自发性高血压大鼠(spontaneously hypertensive rats,SHR)为研究对象,观察交感神经损毁SHR的血压、肾脏ADMA以及肾功能的变化,探讨高血压的发病机制。
材 料 和 方 法
1 主要试剂及仪器
单硫酸胍乙啶(guanethidine monosulfate)、ADMA和NE购于Sigma; TRIzol试剂购于Invitrogen。LC2010-AHT型高效液相色谱仪(日本岛津公司);无创血压测量系统(Panlab NIBP System)。
2 方法
2.1实验动物和化学交感神经损毁术 将雄性新生SHR[北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2016-0011]随机分为对照(control)组和交感神经损毁(sympathectomized)组,每组5只。交感神经损毁组大鼠自出生后第7天开始皮下注射单硫酸胍乙啶(50 mg/kg),连续21 d;对照组皮下注射生理盐水[11]。动物给予自由饮食,分笼饲养,明暗周期为12 h/12 h,环境温度为24 ℃。
2.2尿NE排泄量的测定 12周龄时,采用代谢笼法收集每只大鼠常温下尿液,加入浓度为1 mol/L的盐酸1 mL以避免去甲肾上腺素降解,6 h 后取出尿液,测量尿量,4 ℃、3 000 r/min离心5 min,吸取上清液1.5 mL,置于4 ℃冰箱中备用。采用高效液相色谱仪检测尿液中去甲肾上腺素含量。
2.3大鼠尾动脉无创性血压监测 分别在常温和冷应激下,使用Panlab NIBP System监测大鼠尾动脉收缩压(systolic blood pressure,SBP)和舒张压(diastolic blood pressure,DBP),每只大鼠测量 5 次,每次间隔3 min,取其平均值作为该大鼠的血压水平。
2.4大鼠肾脏组织中ADMA及NE含量的测定 12周龄时,分别取对照组和交感神经损毁组SHR肾脏,称重后加入高氯酸(HClO4),放入玻璃匀浆管内,冰浴下匀浆,用微型旋涡混合仪混合2 min。将匀浆液收集于离心管中.4 ℃、15 000 r/min离心20 min,取上清液于4 ℃、15 000 r/min离心20 min,取上清液,置于-80 ℃低温冻存保持。采用高效液相色谱仪检测SHR肾脏组织中NE和ADMA含量。
2.5肾脏NO含量的测定 12周龄时,切取肾脏剥离被膜后置于冰冷的生理盐水中,剪成小碎块,用生理盐水冰浴下制成组织匀浆后采用比色法测定NO含量。
2.6Western blot检测肾组织内皮型NOS (endothe-lial NOS, eNOS)的表达 12周龄时取肾脏组织50 mg,按照蛋白提取试剂盒操作说明书提取蛋白,在4 ℃下离心,取上清液,用Bradford法测定蛋白浓度。取相同质量的蛋白质,经SDS-PAGE,转膜,室温封闭2 h,然后分别加入兔抗eNOS抗体以及兔抗β-actin多克隆抗体,4 ℃下过夜。再用HRP-IgG杂交,洗膜后显色。凝胶成像分析系统扫描分析。以β-actin作为内参照,结果用靶蛋白与β-actin的比值表示。
2.724 h 尿微量白蛋白(microalbumin,mALB)和尿钠量测定 12周龄时,采用代谢笼法收集每只SHR常温下24 h 尿液,记录尿量,3 000 r/min低温离心15 min后取上清,置于-20 ℃低温保存待测定尿微量白蛋白和尿钠量。
2.8肾小球滤过率(glomerular filtration rate,GFR)的测定 12周龄时,尾静脉取血,代谢笼法收集尿液和记录尿量,比色法检测血液和尿液肌酐。根据血液、尿液肌酐及每分钟尿量,计算出GFR。GFR=尿液肌酐×每分钟尿量/血液肌酐。
3 统计学处理
应用SPSS 20.0统计软件进行数据处理,数据以均数±标准差(mean±SD)表示,对符合正态分布和方差齐的资料,两样本均数采用t检验,若方差不齐则采用Satterthwaite近似t检验行两两比较,以P<0.05为差异有统计学意义。
结 果
1 化学交感神经切断术损毁交感神经的效果
常温下,与对照组相比,交感神经损毁组的SHR尿NE排泄量显著降低(P<0.01),见图1。这一结果提示交感神经功能明显受损。

Figure 1. Comparision of urinary NE content between control group and sympathectomized group at room temperature. Mean±SD.n=5.** P<0.01vscontrol group.
2 两组SHR的SBP和DBP比较
对照组SHR的收缩压为(186.0±3.3)mmHg,舒张压为(149.6±5.9)mmHg;交感神经损毁组SHR的收缩压为(167.7±3.8)mmHg,舒张压为(125.1±6.7)mmHg,较对照组明显降低(P<0.01),见图 2。
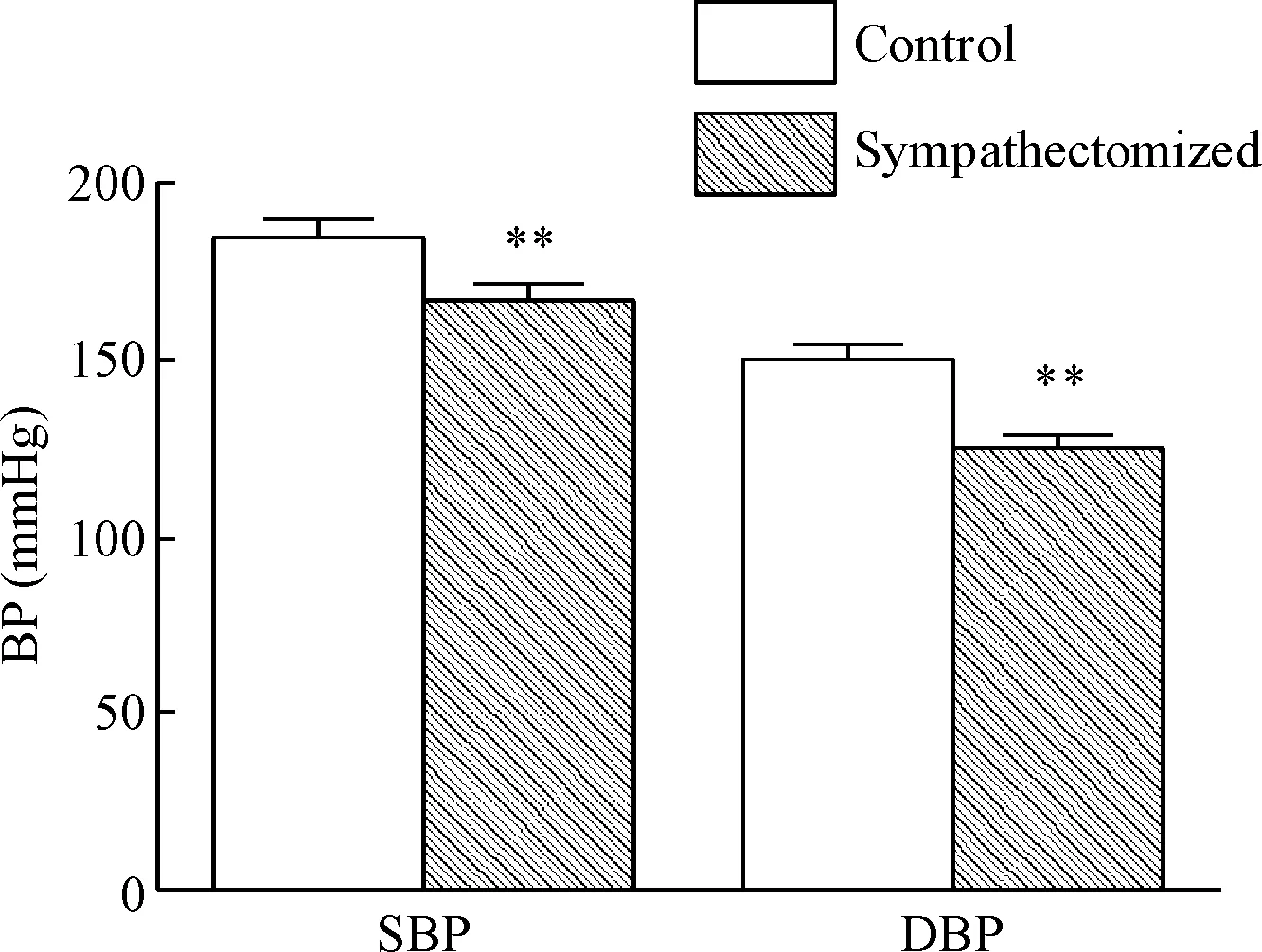
Figure 2. Comparison of systolic and diastolic blood pressure between control group and sympathectomized group at room temperature. Mean±SD.n=5.** P<0.01vscontrol group.
3 SHR肾脏组组中ADMA及NE含量的测定
与对照组比较,交感神经损毁组SHR肾脏ADMA和NE的含量明显降低,差异有统计学意义(P<0.01),见图3。

Figure 3. Comparison of renal ADMA and NE contents between control group and sympathectomized group at room temperature. Mean±SD.n=5.** P<0.01vscontrol group.
4 SHR肾脏NO含量的测定
与对照组比较,交感神经损毁组SHR肾脏NO含量显著升高(2.31±0.33vs1.67±0.19,P<0.05)。
5 SHR大鼠肾脏的eNOS表达
与对照组比较,交感神经损毁组SHR肾脏eNOS的蛋白表达明显增高(P<0.05),见图4。
6 24 h 尿mALB和尿钠量的测定
由表1可知,与对照组比较,交感神经损毁组SHR 24 h尿mALB和尿钠量的差异无统计学显著性(P>0.05)。
7 GFR的测定
由表1可见,与对照组比较,交感神经损毁组SHR 24 h尿量、尿肌酐、血肌酐及GFR的差异无统计学显著性(P>0.05)。
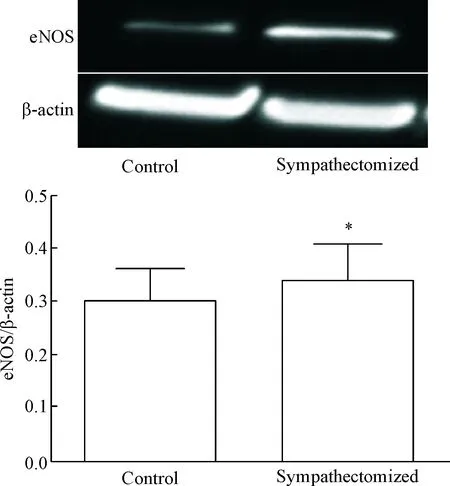
Figure 4. Western blot was used to determined the protein expression of renal eNOS in control group and sympathectomized group. Mean±SD.n=5.*P<0.05vscontrol group.
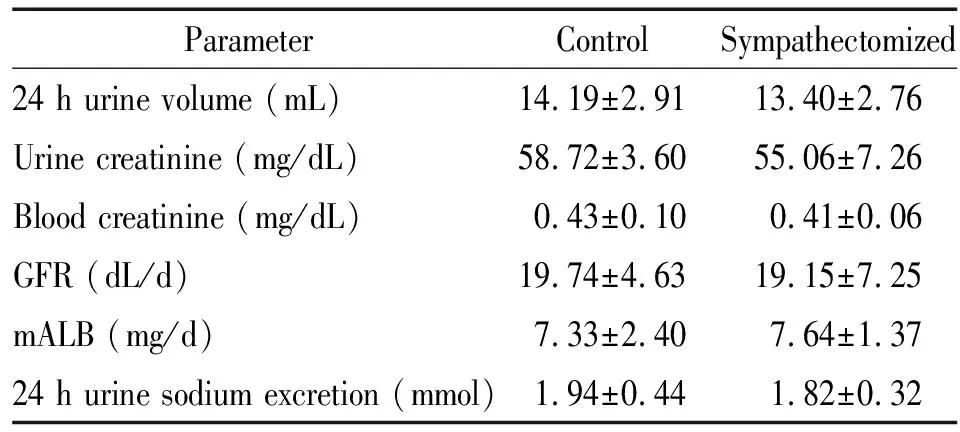
表1 交感神经损毁对SHR肾功能指标的影响
GFR: Glomerular filtration rate; mALB: microalbumin.
讨 论
高血压肾脏损害的发病涉及多个机制,包括高血压促动脉粥样硬化病变、肾素-血管紧张素系统激活、氧化应激、免疫及细胞因子机制等,其中交感神经系统激活及血管内皮功能障碍是其中重要的2种[12-13]。交感神经系统能够调节内皮功能,影响NO的合成,而NO在调控血压方面及肾脏功能调节方面起着重要作用;同时,NO的合成又受内源性NOS抑制剂ADMA的限制,它能通过竞争性结合NOS影响NO的生成,从而引起内皮功能障碍;另外,大量研究证明肾功能异常患者体内往往伴随着ADMA水平的升高[14-16]。但是,ADMA、交感神经系统及肾脏功能之间的关系仍然未知。
实验结果表明,与对照组相比,交感神经损毁组SHR肾脏NO含量和eNOS表达显著升高,NE和ADMA含量均明显降低,收缩压和舒张压明显降低,表明交感神经系统抑制可引起ADMA释放减少,eNOS活性增加,NO合成升高,从而影响血压。然而,去交感神经后SHR肾脏AMDA水平下调的原因仍然未知。有研究报道,甲基精氨酸二甲胺水解酶(dimethyarginine dimethylaminohydrolase,DDAH)主要在肾脏表达,因此肾脏功能的损伤影响DDAH的表达或/和活性可使体内ADMA的降解下调[17]。因此,本研究进一步通过检测24 h尿mALB、尿钠量和GFR评价高血压大鼠肾功能,结果显示,交感神经损毁组的SHR和对照组的SHR比较,24 h尿mALB、尿钠量和GFR均未见明显差异。这表明交感神经损毁自发性高血压大鼠中ADMA降低不是通过肾小球滤过率降低所致。
ADMA主要是在蛋白精氨酸甲基转移酶1(protein arginine methyltransferase 1,PRMT1)的催化下,以S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)为甲基供体,使蛋白质多肽链中的L-精氨酸残基甲基化水解释放而来[18]。ADMA只有少部分通过肾脏排出,大部分的ADMA在DDAH和丙氨酸-乙醛酸氨基转移酶2(alanine-glyoxylate aminotransferase 2,AGXT2)的作用下代谢[19]。Teerlink等[8]报道,阳离子氨基酸转运体(cationic amino acid transporters,CAT)可能影响ADMA的代谢。因此,ADMA升高的可能原因有:(1)肾小球滤过率降低;(2)DDAH表达或/和活性降低;(3)AGXT2表达或/和活性降低;(4)CAT表达或/和活性降低;(5)PRMT1表达或/和活性增强。因此,是否去交感神经后SHR肾脏的DDAH、AGXT2、CAT及PRMT1的表达或/和活性受到影响从而致ADMA水平下调还需通过实验进一步验证。
综上所述,交感神经系统抑制可引起ADMA和NE释放减少,NO合成和eNOS表达升高,从而调节血压;但交感神经系统调控ADMA释放并不是通过影响肾脏功能方式来实现,其具体机制尚不清楚,仍需进一步研究。
