Myocardin重组蛋白表达及其在人骨髓间充质干细胞重编程为血管平滑肌细胞中的作用*
2018-08-27麦丽萍杨翔宇吴岳恒余细勇何国东李晓红
麦丽萍, 杨翔宇, 吴岳恒, 余细勇, 何国东, 李晓红△
(1广东省人民医院, 广东省医学科学院医学研究部, 广东省华南结构性心脏病重点实验室, 广东 广州 510080;2广州医科大学药学院, 广东 广州 511436)
血管再生是一个非常复杂的生理和病理过程,而血管重建依赖于原来存在的血管,血管壁上各种细胞发生增殖、迁移而形成新的血管分支,对损伤的血管起到修复作用,在冠心病、高血压等心血管疾病中普遍存在并影响疾病的预后。人工血管作为一种修复和替代病变血管的假体,需要生物材料与种子细胞相结合,在大血管疾病的治疗中发挥着重要作用[1]。目前血管平滑肌作为人工血管中重要的种子细胞,其来源主要有血管壁细胞、骨髓间充质干细胞和胚胎干细胞,但均不是理想的细胞来源,细胞重编程技术是我们获取血管平滑肌细胞(vascular smooth muscle cells,vSMCs)的另一条重要途径。
心肌素(myocardin)是2001年从小鼠心脏cDNA 文库中分离和克隆出来的一个基因,其通过与血清反应因子(serum response factor,SRF)结合,形成复合物后激活CArG-box依赖性的肌细胞特异性基因启动子。Myocardin能影响细胞的增殖、迁移、分化和凋亡,在调节心肌细胞和血管平滑肌细胞的分化中,尤其在心脏基因表达、心肌发育早期和心脏血管形成中起着重要的作用[2-3]。研究表明, myocardin在7.75 d的胚胎心脏和成年心脏组织中均有表达[4];而在后来发育阶段中,myocardin 的mRNA 水平在正发育的小鼠心脏中表达并持续升高,在肠道和脉管的平滑肌细胞中也可以表达[5]。Myocardin是促进血管平滑肌分化的重要转录因子,在Rho-actin信号和SRF依赖性的转录中起着桥梁作用,可调控血管平滑肌细胞的表型转化[6-7]。因此我们尝试将myocardin用于细胞的重编程以获取诱导的平滑肌细胞(inducible smooth muscle cells,iSMCs)。
材 料 和 方 法
1 细胞株
人骨髓间充质干细胞(human bone marrow mesenchymal stem cells,hBMSCs)购自赛业生物科技有限公司(货号:HUXMA-01001),该细胞株已鉴定CD44、CD105、CD29和CD73的表达>98%,CD34表达<0.6%,CD45和CD11b的表达<0.1%,可分化为成脂或成骨细胞。
2 主要试剂和仪器
胎牛血清(fetal bovine serum,FBS)购自Gibco;骨髓间充质干细胞完全培养基和pET30a载体购自赛业生物科技有限公司;LB培养基购自Sigma;绿色荧光蛋白(green fluorescent protein,GFP)购自义翘神州生物技术有限公司;PBS 购自Life Technologies;抗平滑肌肌球蛋白重链(smooth muscle myosin heavy chain,smMHC)抗体购自Abcam;抗His抗体购自CST;DNA 上样缓冲液、DNA marker、PrimeScript RT Master Mix (Perfect Real Time)和SYBR Premix Ex TaqTMII(Tli RNaseH Plus)购自TaKaRa。荧光显微镜购自Leica;电泳系统购自大连捷迈科贸有限公司;凝胶成像系统购自GE。
3 主要方法
3.1重组pET30a-myocardin表达质粒的构建 利用PCR引物(正向引物为5’-CCAATTGCGGCCGCCTTGGCCCCAGCACCCCC-3’, 反向引物为5’-CGGTTT-CTCGAGCTACCACTGCTGCAAGTGAAGGTCCAT-3’),以人心脏cDNA文库为模板, 用PCR扩增myocardin基因。反应条件为: 94 ℃预热2 min; 94 ℃变性30 s, 60 ℃退火45 s, 68 ℃延伸3.5 min, 30个循环; 72 ℃ 10 min。
纯化的PCR产物克隆入pMD-18T载体,并行DNA测序鉴定。提取myocardin序列正确的重组pMD-18T-myocardin质粒,用NcoI和XhoI双酶切pMD-18T-myocardin质粒和pET30a载体,纯化酶切产物,将myocardin基因片段克隆入pET30a载体。用NcoI和XhoI双酶切筛选鉴定重组pET30a-myocardin质粒,并送Invitrogen公司测序鉴定。
3.2重组蛋白的诱导表达 重组表达质粒pET30a-myocardin转化BL21后,铺板,挑克隆到含卡那霉素的1 mL LB培养基中37 ℃振荡培养过夜。次日将菌液全部倒入400 mL 含有卡那霉素的LB培养基中,37 ℃、230 r/min振荡培养,至吸光度(A)值为1.5时,不同于常规1∶1诱导,本实验采用高浓度诱导法:按2 ∶1转换培养液为M9 minimal medium,再额外添加2倍的葡萄糖,继续振荡培养1 h,至A值达到3.5~4.0,然后加入0.5 mmol/L的IPTG,在37 ℃下进行诱导。整个诱导过程始终检测培养液的pH值,应维持在6.0以上。经3 h后裂解细菌的,过柱纯化,再进行SDS-PAGE检测蛋白的表达情况。SDS-PAGE 具体方法如下:把5 mL 12%分离胶液缓缓地注入2层玻璃板中间处,当加至距离玻璃板顶部大约3 cm处时,用异丙醇加满进行封胶;室温下静置30 min,胶凝固后倒入5%浓缩胶液,在室温下静置15 min;在电泳槽内装上已凝固的胶和玻璃板,在各加样孔中加入已处理的蛋白样品,另将marker加入其中1孔内;100 V电泳1.5 h。
3.3重组蛋白的分离纯化 用结合缓冲液平衡好镍亲和层析柱后,将超声裂解得到的菌体上清缓慢过柱,用10倍体积的结合缓冲液洗涤,然后再用含10 mmol/L咪唑的洗涤缓冲液充分洗涤非特异性结合的杂蛋白。每一步都需收集样品进行SDS-PAGE检测洗涤情况,上述过程均在4 ℃的冷库中进行。最后用10%甘油和2% SDS配制成的洗脱液进行洗脱,收集特异性结合的目的蛋白。本研究中采用以下3种洗脱方式:(1)常温下,采用传统的500 mmol/L的imidazole洗脱液进行过柱洗脱;(2)常温下,用洗脱液溶解结合有目的蛋白的柱凝胶,温和搅拌30 min,10 000 r/min,4 ℃离心后取上清保存;(3)在37 ℃用洗脱液溶解结合有目的蛋白的柱凝胶,温和搅拌30 min,10 000 r/min,4 ℃离心后取上清保存。
3.4目的蛋白dot blot 检测 将各次分离纯化后的蛋白样本各50 μL滴加到硝酸纤维素膜上,阴性对照使用无关蛋白样品。用鼠抗人myocardin单克隆抗体4 ℃孵育过夜,辣根过氧化物酶标记的羊抗鼠II抗在室温孵育2 h,加显色液后暗室显影冲片,得到特异性的蛋白点。Dot blot 阳性结果显黑色斑点,阴性结果不显影。
3.5纳米材料与蛋白结合 在200 μL 100 mg/L 的 myocardin蛋白溶液中加入0.4 μL的纳米转导材料(8 g/L),即纳米粒子与蛋白质的摩尔比为4∶1,于4 ℃ 搅拌过夜[8]。
3.6重组蛋白细胞转导实验 采用hBMSCs为研究对象,在骨髓间充质干细胞完全培养基中加入上述克隆表达得到的nano-myocardin蛋白,12 h后,固定细胞,采用抗His抗体免疫荧光法检测细胞内蛋白的转染情况。
3.7细胞重编程实验 在培养皿中接种人来源的骨髓间充质干细胞,待细胞长满至 70% 左右,将终浓度为0.4 mg/L的nano-myocardin加入基础培养液中与hBMSCs 过夜孵育,12 h后换为不加蛋白的基础培养液,48 h后再次给予蛋白诱导。重复以上蛋白诱导步骤4次。基础培养液包含2 mmol/L谷氨酰胺和0.4 mmol/L α-硫代甘油。观察细胞形态变化,第8天用qPCR和免疫荧光检测hBMSCs向vSMCs转分化的情况。
3.8RNA提取及qPCR 细胞转导蛋白后去除培养基,用冷PBS洗细胞3次,吸干PBS,采用TRIzol法提取细胞总RNA。用NanoDrop 1000 spectrophotometer (Thermo Fisher Scientific)测RNA浓度后按照PrimeScript RT Master Mix (Perfect Real Time)试剂盒说明书要求进行逆转录生成cDNA。将cDNA按照SYBR Premix Ex TaqTMII试剂盒说明书要求,利用ABI 7500 Real-Time PCR System进行 qPCR检测。Smoothelin(SMTN)的上游引物序列为5’-AAAGAGCTAAG CCGAGCCTG-3’, 下游引物序列为5’-CGTCGGTTCCTTTCTGGTGA-3’; caldesmon (CALD)的上游引物序列为5’-GTGACCAACCAGAAGGCTCA-3’, 下游引物序列为5’-CTTCGAGTCGCATCTCCTCC-3’; GAPDH的上游引物序列为5’-GCATCCTGGGCTACACTG-3’, 下游引物序列为5’-TGGTCGTTGAGGGCAAT-3’。
3.9细胞免疫荧光检测 细胞弃去培养基,用 PBS洗 3 次,每次5 min;4%多聚甲醛固定10 min;PBS洗3次,每次5 min;0.1% Triton X-100室温通透15 min;2% BSA/0.2% Tween 20/PBS室温封闭2 h;加入鼠来源抗smMHC和抗histone单克隆抗体。4 ℃孵育过夜;用2 % BSA洗3次,每次5 min;加入羊抗鼠II抗,室温避光孵育2 h,1 % BSA洗3次,每次5 min;用含有封片剂的DAPI复染细胞核后,将细胞放至荧光显微镜下观察并拍照;同时计算1 000个细胞中含有绿色荧光的细胞数目。
4 统计学分析
采用SPSS 10.0统计软件进行数据分析,所有数据均采用均数±标准差(mean±SD)表示,组间均数比较采用t检验或单因素方差分析,以P<0.05表示差异具有统计学意义。
结 果
1 Myocardin片段的获取
重组pET30a-myocardin表达载体经限制性内切酶NcoI和XhoI双酶切后琼脂糖凝胶电泳结果显示,编码myocardin蛋白质的DNA序列长度为2 288 bp,从图1中可以看出pET30a-myocardin经酶切后有目标片段出现,该片段长度在2 000~3 000 bp之间。
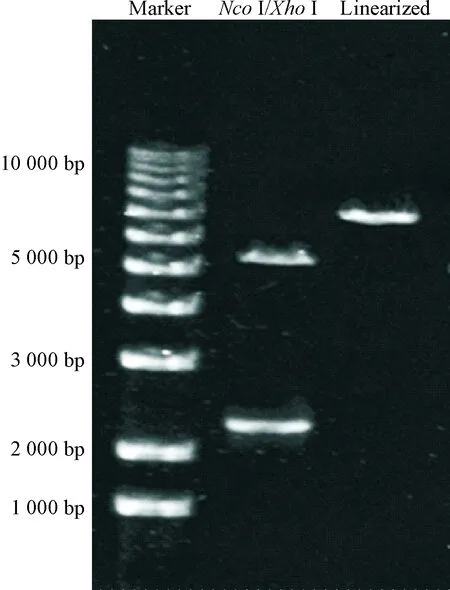
Figure 1. The agarose gel electophoresis result of recombinant plasmid pET30a-myocardin digested byNcoI andXhoI.
2 Myocardin重组蛋白诱导表达情况
重组表达质粒pET30a-myocardin经转化后进行SDS-PAGE,结果显示高浓度法获取的蛋白质表达量比常规诱导法高。重组myocardin蛋白质量为97 kD,从图2中可以看出常规诱导法和高浓度诱导法在90 kD~110 kD之间均有目标片段出现。
3 Myocardin重组蛋白的分离纯化效率
本研究的蛋白分离纯化方法采用了3种不同的洗脱方式。结果显示,采用新开发的2种洗脱方式(在常温下用洗脱液溶解结合有目的蛋白的柱凝胶,温和搅拌30 min,离心后取上清保存,见图3B;在37 ℃用洗脱液溶解结合有目的蛋白的柱凝胶,温和搅拌30 min,离心后取上清保存,见图3C),myocardin的蛋白洗脱量与传统方法(图3A所示的常温下采用500 mmol/L的imidazole洗脱液进行过柱洗脱)相比,效率有较大提高(P<0.05)。
4 Myocardin重组蛋白的鉴定
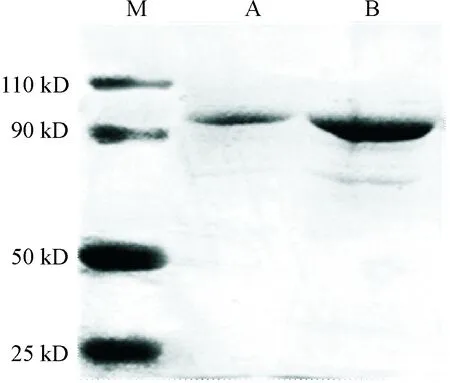
Figure 2. The expression of myocardin protein induced by high concentration method. M: marker; A: regular induction; B: high-concentration induction.
采用dot blot 方法检测各次分离纯化后的蛋白,结果可见目的蛋白在硝酸纤维素膜上出现明显黑色斑点,而阴性对照则不显影,见图4。
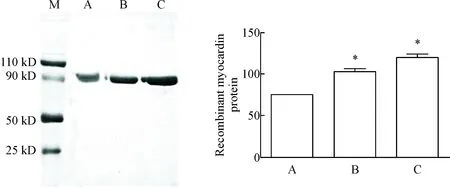
Figure 3. The elution effect of recombinant myocardin protein by different elution methods. M: marker; A: regular elution; B: stirred elution; C: warmed and stirred elution. Mean±SD.n=3.*P<0.05vsA.
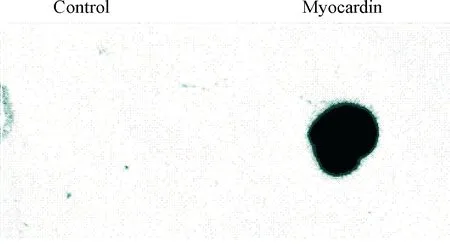
Figure 4. The isolated and purified myocardin detected by dot blot.
5 纳米-myocardin复合体转染骨髓间充质干细胞
根据本实验室前期的研究[8],纳米转导材料能够以复合体的形式携载蛋白,穿膜后在胞内释放并表达;且纳米粒子与蛋白质的最适摩尔比为4 ∶1,此时绿色荧光强度最大。把纳米-myocardin复合体转染骨髓间充质干细胞后可见转染率高达95%,见图5。
6 Myocardin重组蛋白能促进骨髓间充质干细胞向平滑肌样细胞转化
细胞培养基中加入myocardin重组蛋白后,hBMSCs开始向平滑肌细胞转化。细胞培养至第8天时,采用qPCR的方法检测了平滑肌的特异性标志物平滑肌细胞分化特异性抗原SMTN和钙结合蛋白CALD的mRNA表达情况,结果发现myocardin重组蛋白能够明显促进SMTN和CALD的mRNA表达,见图6A;同时对平滑肌的特异性标志物smMHC进行检测,显微镜下计数每1 000个细胞中有绿色荧光(smMHC)的细胞数目,阳性细胞占(17.37±0.07)%,见图6B。Myocardin重组蛋白诱导至第8天时,可见hBMSCs向平滑肌细胞转化,见图7。
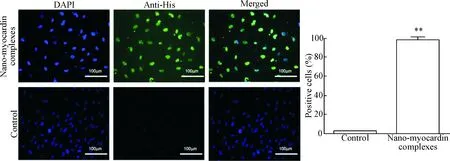
Figure 5. Observation of bone marrow mesenchymal stem cells transfected with nano-myocardin complexes. The scale bar=100 μm. Mean±SD.n=3.**P<0.05vscontrol group.

Figure 6. The expression of specific markers of vSMCs in the cells after adding myocardin recombinant protein. A: the mRNA expression of smoothelin and caldesmon in the cells; B: the number of smMHC-positive cells in every 1 000 cells was counted under microscope. Mean±SD.n=3.*P<0.05,**P<0.01vsMSCs.
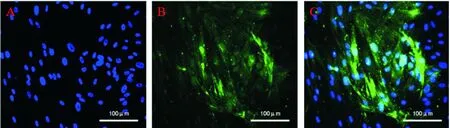
Figure 7. The expression of the smooth muscle cell marker after adding myocardin recombinant protein. The scale bar=100 μm. A: DAPI showed blue; B: smMHC showed green; C: Merged.
讨 论
随着生物技术迅速发展,利用DNA重组技术,将我们所需的编码蛋白DNA序列克隆到表达载体上,能实现目的蛋白的大量表达。目前,表达蛋白已经变得相对比较容易,但由于蛋白的多样性,纯化就显得非常繁杂,尤其对于不熟悉纯化的研究者而言,往往是一个技术的瓶颈。本研究利用镍柱亲和层析来分离纯化所得裂解上清中的myocardin蛋白,分离效果较好。由于镍对含有6个组氨酸蛋白具有特异吸附能力,在天然或变性条件下,对于表达系统中含组氨酸亲和标签蛋白,具有较好的纯化效果。
但在研究过程中,经常会遇到蛋白保留在层析柱中难洗脱的情况,即使采用更强的洗脱条件,如直接用500 mmol/L咪唑加到6 mol/L盐酸胍进行洗脱,在亲和柱上仍会有大部分目的蛋白吸附。因此,对于采用常规方法难于洗脱的蛋白,能开发出一种能够充分洗脱的方法显得非常有意义。本研究采用洗脱液溶解结合有目的蛋白的柱凝胶,温和搅拌30 min,离心后取上清保存方法,与传统方法相比较,洗脱效果更好。
目前细胞重编程是采用病毒、miRNA或化学小分子的方式进行的。病毒或者质粒的方式过表达重编程因子效率低下,并且由于安全性问题,病毒介导方式或者基因整合机制会给临床应用带来安全隐患。小分子化合物是通过影响细胞的信号传导进而达到重编程效果的,由于不同细胞和同类细胞内信号调控网络的复杂性,小分子诱导难以获得稳定而高效的重编程效果。而相对安全的蛋白质诱导方式是非病毒、非基因整合技术,安全而有效,具备较大的临床应用可能性。大多数外源性蛋白质分子不能自由进出细胞膜,而难以发挥生物效应,需要一个载体来协助目标蛋白转运到细胞内。研究显示TAT穿膜肽和碳纳米管等载体类型效率并不高[9-10],为解决这个难题,我们先前的研究采用新型纳米材料转运GATA4、HAND2、MEF2C和TBX5等心脏特异性转录因子到人成纤维细胞内,成功将其重编程为心脏祖细胞[11]。但目前尚未有采用此方法获得血管平滑肌的报道。
本研究中所获得的纯化蛋白经鉴定后,使用本实验室前期的研究所得的纳米转导材料,与myocardin形成复合体后转染骨髓间质干细胞,其转染率较高。与目前转染应用最多的病毒型载体相比,具有转染效率高,安全性好,可避免病毒的免疫排斥反应和所介导的随机整合等可能潜在危害等优点。而hBMSCs经myocardin重组蛋白干预后,hBMSCs开始向平滑肌细胞转化。以上结果提示,本研究所构建的myocardin重组蛋白能应用细胞重编程中,为平滑肌细胞的再生提供了一个新途径。但存在的问题是重编程成为iSMCs的效率还不够高,仍需进一步研究改进方案。后续仍需继续探索iSMCs作为种子细胞在人工血管等组织工程中的运用。
