钙/钙调蛋白依赖性蛋白激酶II通过介导凋亡加重H9c2心肌细胞缺氧/复氧损伤*
2018-08-27孔令恒陈玉龙朱娟霞苏兴利
孔令恒, 陈玉龙, 孙 娜, 魏 明, 朱娟霞, 李 美, 苏兴利△
(西安医学院1基础医学部, 基础医学研究所,2基础与转化医学研究所, 陕西 西安 710021)
缺血性心脏病是世界范围内引起死亡的一个重要原因,随着药物溶栓、介入治疗和动脉搭桥术等临床治疗手段的应用,缺血心肌可得到及时有效的再灌注,显著降低了病死率[1-2]。但再灌注会引发一系列不良事件,如心律失常、心肌舒缩功能障碍和心肌细胞死亡,形成缺血/再灌注损伤(ischemia/reperfusion injury,I/RI)[3-5]。I/RI的机制仍未完全阐明,普遍认为,钙超载、氧化应激、线粒体损伤、能量代谢障碍、炎症反应以及细胞凋亡、坏死和自噬等是导致I/RI发生、发展的重要因素[6-10]。
钙/钙调蛋白依赖性蛋白激酶II(Ca2+/calmodulin-dependent protein kinase II, CaMKII)是一类多功能的丝氨酸/苏氨酸蛋白激酶,有α、β、γ和δ 4种亚型[11]。CaMKII在心脏广泛分布,生理状态下可加快心肌的舒张过程,在维持细胞内钙稳态中发挥重要作用,并参与心肌细胞凋亡、心肌肥厚、心力衰竭、心律失常和扩张性心肌病的发生、发展过程[12-14]。H9c2细胞是源于大鼠胚胎心肌组织的亚克隆细胞株,广泛用于模拟心肌细胞[15]。本研究采用H9c2心肌细胞缺氧/复氧(hypoxia/reoxygenation, H/R)模型,观察CaMKII在缺氧/复氧损伤中的作用并探讨其可能机制。
材 料 和 方 法
1 试剂
CaMKII特异性抑制剂KN-93购自Calbiochem;乳酸脱氢酶(lactate dehydrogenase, LDH)检测试剂盒购自南京建成生物有限公司;H9c2细胞系购自深圳百恩维公司;CCK-8细胞毒性检测试剂盒购自七海生物公司;抗CaMKII、磷酸化CaMKII(phosphorylated CaMKII,p-CaMKII)、受磷蛋白(phospholamban,PLN)、磷酸化PLN(phosphorylated PLN,p-PLN)、cleaved caspase-3和GAPDH抗体均购自Cell Signaling Technology;辣根过氧化物酶标记的IgG购自北京中杉金桥生物技术有限公司。
2 主要仪器
超净工作台购自苏州净化设备仪器厂;低速离心机购自Saitexiangyi;细胞培养箱购自Thermo;Western blot相关仪器均购自Bio-Rad;酶标仪购自SpectraMax。
3 方法
3.1H9c2细胞培养和H/R模型的建立 正常对照(control)组组H9c2心肌细胞用含10%胎牛血清的DMEM培养基在恒温37 ℃、95% O2、5% CO2培养箱内培养;H/R组H9c2心肌细胞先将培养基更换为不含10%胎牛血清的DMEM,然后将培养瓶置于含1% O2和5% CO2的培养箱中缺氧12 h,缺氧完成后更换培养基为10%胎牛血清的DMEM,并在95% O2、5% CO2培养箱内复氧4 h。
3.2实验分组 将H9c2心肌细胞随机分为4组:control组、KN-93药物对照(KN-93)组、H/R组和KN-93+H/R组,KN-93浓度为1 μmol/L,KN-93预处理时间为2 h。
3.3CCK-8检测各组细胞活力 各组细胞处理结束后,先将培养基倒掉,用PBS清洗3遍,加入无血清的DMEM 100 μL和CCK-8检测液10 μL,放入恒温37 ℃细胞培养箱避光孵育2 h,用酶标仪检测各组吸光度(波长450 nm)。
3.4细胞培养液中LDH活性的检测 各组细胞处理结束后,收集各组培养瓶中的细胞培养液,严格按照南京建成生物有限公司试剂盒说明书检测各组细胞培养液中LDH的活性。
3.5细胞凋亡的TUNEL检测 各组细胞处理结束后先用PBS慢摇清洗3遍,每次5 min,再用4%多聚甲醛于4 ℃条件下固定30 min,PBS清洗3遍,每次5 min。0.3% Triton X-100 常温下打孔10 min后PBS清洗3遍,每次5 min。严格按照TUNEL试剂盒说明,避光将1号和2号液按1∶9混合,并滴加在激光共聚焦皿内,37 ℃水浴避光孵育1 h,再用PBS清洗3遍,每次5 min。DAPI复染细胞核37 ℃水浴避光孵育10 min,PBS清洗3遍,每次5 min,激光共聚焦显微镜扫描拍照。采用绿色荧光的细胞核占总细胞核的百分比(%)表示细胞凋亡率(apoptotic index)。
3.6Western blot 法检测各组CaMKII和PLN磷酸化及凋亡相关蛋白表达的变化 处理结束后,各组细胞用预冷的PBS清洗3遍后置于冰上,分别用细胞刮刮下各组细胞并收集入EP管中,加入含苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)的细胞裂解液,冰上裂解30 min,预冷的4 ℃离心机12 000×g离心20 min,收集上清液,采用BCA比色法进行蛋白定量。各组蛋白经SDS-PAGE分离,湿转法将蛋白转移到PVDF膜,5%脱脂奶粉室温封闭2 h,将相应目的条带切下,分别放入抗p-CaMKII、CaMKII、p-PLN、PLN、cleaved caspase-3和GAPDH(1∶1 000) I 抗中4 ℃孵育过夜;TBST室温洗膜3次,每次10 min,用HRP标记的羊抗鼠和羊抗兔(1∶5 000)II 抗室温孵育2 h,TBST室温洗膜3次,每次10 min,用Bio-Rad成像仪拍照,ImageJ软件进行灰度值分析,GAPDH作为内参照。
3.7流式细胞术检测各组细胞凋亡的变化 实验结束后,将各组细胞用预冷的PBS清洗2遍后,按照试剂盒说明,分别添加5 μL FITC标记的Annexin V和5 μL PI染料,室温避光孵育10 min,采用Facscallbar型流式细胞仪检测细胞凋亡。用FlowJo 7.6软件分析数据,并计算细胞凋亡率。
4 统计学处理
采用GraphPad Prism 5.0统计软件进行数据分析,各组数据均采用均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析(one-way ANOVA),采用Tukey检验进行多重比较,以P<0.05为差异有统计学意义。
结 果
1 抑制CaMKII对H/R后H9c2心肌细胞形态和活力的影响
与control组相比,KN-93组细胞形态呈长梭形,细胞活力没有明显变化;与control组相比,H/R处理后,倒置显微镜下观察发现细胞皱缩变短,大量死亡,细胞密度减小,细胞活力显著降低(P<0.01);1 μmol/L KN-93干预H/R后,多数细胞呈梭形,细胞死亡明显减少,密度增大,细胞活力得到显著提高(P<0.01),见图1。
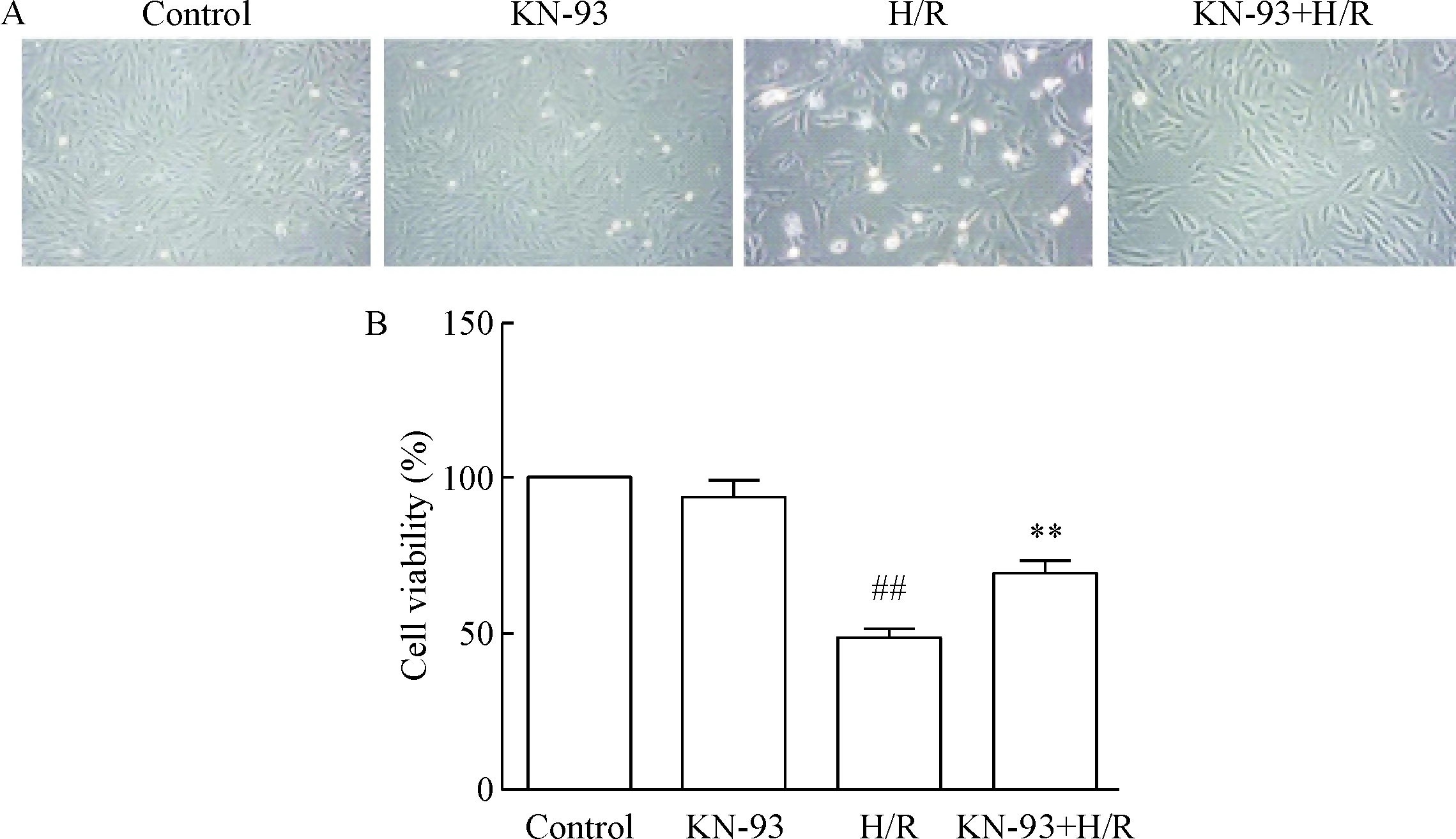
Figure 1. The morphological changes (A) and viability (B) of H9c2 cells in each group (×200). Mean±SD.n=6.##P<0.01vscontrol group;**P<0.01vsH/R group.
2 抑制CaMKII对H/R后H9c2心肌细胞培养液中LDH活性的影响
与control组相比,KN-93组细胞培养液中LDH活性没有明显变化;与control组相比,H/R处理后,细胞培养液中LDH活性显著增加(P<0.01);与H/R组相比,给予1 μmol/L KN-93处理后,细胞培养液中LDH活性显著降低(P<0.01),见图2。
3 抑制CaMKII对H/R后H9c2心肌细胞CaMKII和PLN磷酸化及cleaved caspase-3蛋白水平的影响
与control组相比,KN-93组细胞CaMKII和PLN磷酸化及cleaved caspase-3的表达没有明显变化;与control组相比,H/R处理后,p-CaMKII、p-PLN和cleaved caspase-3的蛋白水平均显著增加(P<0.01);与H/R组相比,给予1 μmol/L KN-93处理后,p-CaMKII、p-PLN和cleaved caspase-3的蛋白水平均显著降低(P<0.05),见图3。
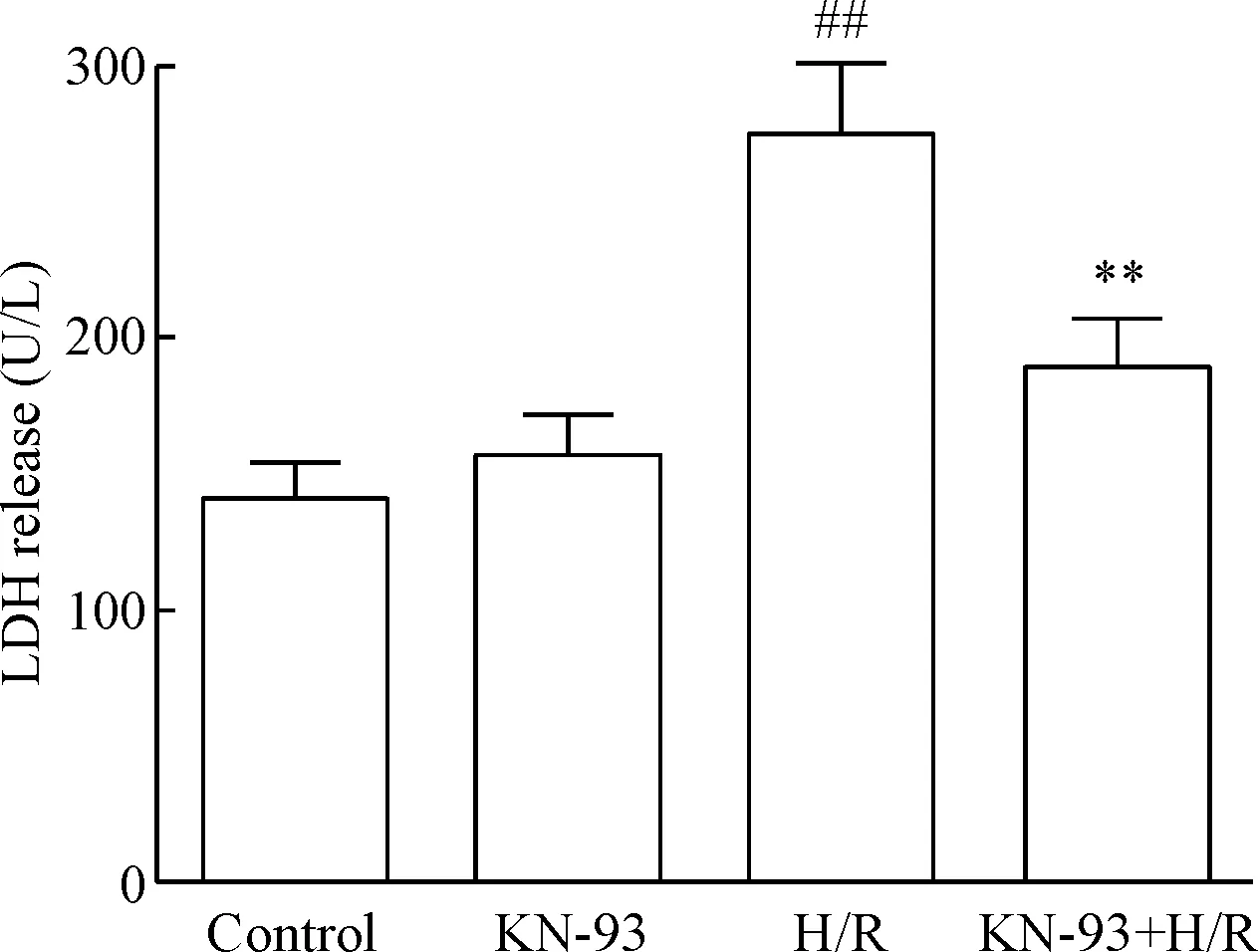
Figure 2. The changes of the LDH activity in each group. Mean±SD.n=6.##P<0.01vscontrol group;**P<0.01vsH/R group.

Figure 3. The protein levels of p-CaMKII, p-PLN and cleaved caspase-3. Mean±SD.n=4.##P<0.01vscontrol group;**P<0.01vsH/R group.
4 抑制CaMKII对H/R后H9c2心肌细胞凋亡的影响
与control组相比,KN-93组细胞TUNEL染色结果阳性细胞没有明显差异;与control组相比,H/R处理后,TUNEL染色结果阳性细胞显著增加(P<0.01);与H/R组相比,给予1 μmol/L KN-93处理后,TUNEL染色结果阳性细胞显著减少(P<0.01),见图4。同时,流式细胞术结果提示,control组和KN-93组细胞凋亡很少且没有明显差异;而H/R处理后细胞凋亡明显增多(P<0.01);与H/R组相比,给予1 μmol/L KN-93处理后,细胞凋亡显著减少(P<0.01),见图5。
讨 论
各种血运重建手段可通过及时、有效地恢复缺血心肌的血液供应而治疗缺血性心脏病。然而,缺血心肌恢复再灌注会进一步导致心肌损伤。截止目前,临床上仍无法找到有效治疗缺血再灌注损伤的方法,这严重制约了治疗效果。探讨缺血再灌注损伤的机制对于改善冠心病患者的预后意义重大。已有大量文献报道,细胞凋亡在心肌缺血再灌注损伤中扮演重要角色。因此,如何有效减少细胞凋亡是减轻心肌缺血再灌注损伤的重要策略。
CaMKII作为心血管生理活动和病理变化过程中信号转导的重要组成部分,可通过调控肌质网功能触发钙超载参与多种心血管疾病的发生[16-17]。PLN是肌质/内质网钙离子ATP酶2a(sarcoplasmic/endoplasmic reticulum Ca2+-ATPase 2a,SERCA2a)活性的主要调节因子[18]。PLN和SERCA2a结合时,可抑制其活性,减少胞质Ca2+转运至肌质网内;而PLN被CaMKII或PKA磷酸化后,可解除对SERCA2a的抑制,维持心肌细胞胞质内低水平Ca2+。
本实验结果发现,在H/R模型中,CaMKII和其底物PLN的磷酸化表达都明显增加,同时,细胞皱缩,大量死亡,培养基中LDH的释放增多,这些提示CaMKII可以介导H9c2心肌细胞H/R损伤。根据已有文献报道,在缺血/再灌注损伤中,PLN被CaMKII磷酸化后解除对SERCA2a的抑制,增加肌质网Ca2+的贮存量,从而增强钙漏的产生,引发钙超载损伤。同时,我们还观察到,H/R组cleaved caspase-3的表达增多,TUNEL荧光染色阳性细胞数也明显增多,流式细胞术结果也提示细胞凋亡显著增加,而KN-93干预H/R组可显著降低cleaved caspase-3的表达、TUNEL荧光染色阳性细胞数和流式细胞凋亡比例,这些结果说明CaMKII可通过增加细胞凋亡导致H9c2心肌细胞H/R损伤。
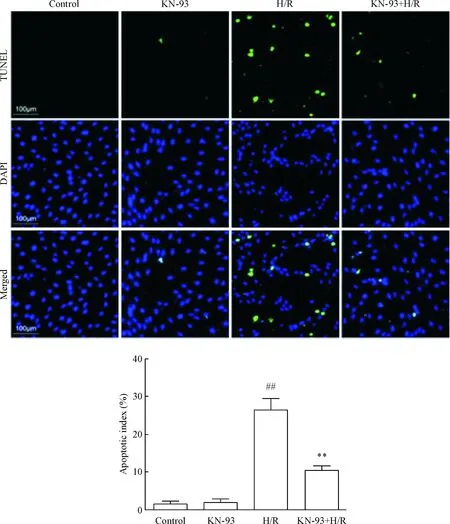
Figure 4. TUNEL-positive cells in each group. Mean±SD.n=4.##P<0.01vscontrol group;**P<0.01vsH/R group.
图4各组细胞TUNEL染色的比较

Figure 5. The changes of apoptosis of H9c2 cells exposed to H/R analyzed by flow cytometry. Mean±SD.n=4.##P<0.01vscontrol group;**P<0.01vsH/R group.
综上所述,本实验发现,缺氧/复氧会诱发CaMKII的激活,而活化的CaMKII可通过增加细胞凋亡导致H9c2心肌细胞缺氧/复氧损伤,这为CaMKII介导心脏缺血/再灌注损伤提供了更多的实验依据。但是,在缺氧/复氧损伤中CaMKII增加细胞凋亡是否跟钙漏引发的钙超载有关还不得而知,将有待进一步证明。
