西洋参与花旗泽仁在大鼠血浆中人参皂苷Rb1的药代动力学比较研究
2018-08-24刘凯新韩东卫朱蕾葛鹏玲
刘凯新,韩东卫,朱蕾,葛鹏玲
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
目前糖尿病(Diabetes mellitus,DM)已经成为严重危害我国人民健康的重要慢性非传染性疾病之一[1]。糖尿病是由于胰岛素分泌绝对或相对不足(胰岛素分泌缺陷),及机体靶组织或靶器官对胰岛素敏感性的降低,导致的以血糖水平升高,或伴有以血脂异常等特征的代谢性疾病[2]。主要为4种类型,1型、2型、妊娠糖尿病与其他类型糖尿病,其中大于90%患者是2型糖尿病。花旗泽仁由西洋参、薏苡仁和泽泻等中药组成,是临床治疗2型糖尿病胰岛素抵抗的经验方。临床疗效证实,花旗泽仁治疗脾虚湿盛,湿热内蕴型糖尿病胰岛素抵抗及相关疾病效果显著[3]。为完善花旗泽仁成药性评价,本研究选择西洋参活性部位中含量较高,且药理活性已被证实的化学成分20(R)人参皂苷Rb1,作为药代动力学检测的指标性成分。
人参皂苷Rb1为西洋参的主要有效成分之一,Yang等[4]研究发现人参皂苷Rb1能够改善血糖水平。Vladimir Vuksan等[5]研究发现西洋参能够降低餐后血糖,并改善糖尿病代谢水平。Xie等[6]从西洋参果中分离提取多糖部分,发现西洋参中多糖成分具有降血糖作用。实验表明西洋参具有降血脂的药理作用[7]。以上均为西洋参对2型糖尿病的预防治疗提供重要的参考意义。本文研究配伍前后西洋参中活性成分人参皂苷Rb1在大鼠血浆中的比较药代动力学特征,完善花旗泽仁成药性评价。
1 材料与方法
1.1 实验仪器
液相色谱/四级杆-飞行时间串联液质联用仪,美国Agilent公司;VORTEX-GENIE 2涡旋混合仪,美国Scientific公司;Centrifuge 5417R低温高速冷冻离心机,德国Eppendorf AG公司;SB-100 DT超声波清洗机,宁波新芝生物科技股份有限公司;Sartorius BSA224S-CW电子天平,赛多利斯科学仪器有限公司;氮吹仪,上海允延仪器有限公司。
1.2 药品与试剂
西洋参、泽泻、薏苡仁购买于黑龙江省世一堂中药饮片厂;人参皂苷Rb1标准品,成都MUST生物技术有限公司;地西泮标准品,中国药品生物鉴定所;甲醇(色谱纯),重庆迪马工业有限责任公司;乙腈(色谱纯),重庆迪马工业有限责任公司;娃哈哈纯净水,杭州娃哈哈集团有限公司;正己烷,天津市福晨化学试剂厂;氢氧化钠,天津市福晨化学试剂厂;肝素钠,北京索莱宝科技有限公司;氮气,哈尔滨春霖气体有限公司。实验所用其他试剂均为色谱级别。
1.3 实验动物
黑龙江中医药大学实验动物中心提供,清洁级Sprague-Dawley(SD)大鼠12只,雄性,3月龄,体质量(200±20)g,动物合格证号:SCXK(黑)2013-004。
1.4 制备花旗泽仁水煎液
取花旗泽仁、西洋参浸泡12 h,分别煎煮,合并3次水煎液,过滤后花旗泽仁组水浴浓缩至每毫升含0.54 g生药药液,西洋参水浴浓缩至每毫升含0.135生药药液。4℃保存。
1.5 色谱与质谱条件
1.5.1 色谱条件
液相色谱:色谱柱为C18柱(1.8 μm,100 mm×3.0 mm,Agilent Technologies,美国),流动相:A相为水(含0.1%甲酸),B相为乙腈。流速0.3 mL/min;柱温为40 ℃;进样温度4 ℃;进样体积为10 μL。在流动相中加入0.1%甲酸以改善色谱峰形。梯度洗脱方式,样品的分析周期为12 min。洗脱程序见表1。
1.5.2 质谱条件
采用液相色谱/四级杆-飞行时间串联液质联用仪,液相色谱接口为电喷雾离子化离子源,负离子检测模式。离子源电压3 500 V、雾化器流速10 L/min、雾化器温度350 ℃、干燥气温度350 ℃、干燥气流速10 L/min、扫描频率2 amu/s、扫描范围100~1 300 amu、雾化器压力50 V、毛细管电压3 500 V。人参皂苷Rb1的质谱参数为1 107.596 0。
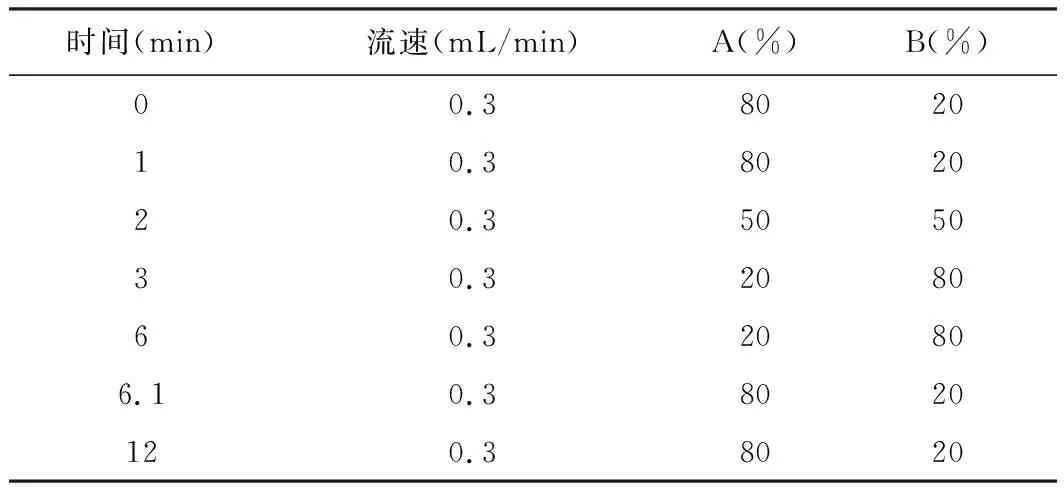
表1 流动相洗脱程序
1.6 血浆样品处理方法
移取100 μL血浆样品,准确加入500 μL含内标(地西泮为0.1 μg/mL)的甲醇溶液进行蛋白沉淀法(Protein Precipitation,PP)处理,2 min涡旋,10 min高速离心4℃12 000 rpm,取上清液于30℃氮气流下吹干,100 μL甲醇加入残渣,涡旋使复溶,12 000 rpm高速离心10 min,取上清液进行HPLC-MS/MS分析,进样体积为10 μL。
1.7 标准曲线血浆样品与质控(quality control, QC)样品的配制
储备液配制:精密称取5 mg地西泮(Diazepam),溶剂为甲醇,制浓度为200 μg/mL的内标储备液。人参皂苷Rb14 mg,溶剂为甲醇,制浓度为400 μg/mL的储备液。-20℃保存储备液。
工作液配制:精密移取储备液,以甲醇为溶剂制备人参皂苷Rb1一系列混合工作液为:1、2、4、10、20、40、100、200 μg/mL。
将配置好的一系列混合工作溶液,以空白血浆作为溶剂进行1:20比例稀释,得到标准曲线血浆样品,人参皂苷Rb1浓度范围为0.05~10 μg/mL。
QC样品同法稀释配制,配制人参皂苷Rb1浓度为0.1、1、8 μg/mL。
1.8 人参皂苷Rb1在大鼠血浆中的比较药代动力学实验
取SD大鼠12只,雌性,随机分为2组,分别给予花旗泽仁、西洋参水煎液,剂量为1 mL/100 g体质量。花旗泽仁组于给药前及给药后0.25、0.5、0.75,1、2、3、4、6、8、12、24、48 h由眼眶静脉丛取血约0.5 mL。西洋参组给药前及给药后0、0.25、0.5、0.75,1、2、3、4、6、8、12、24、48 h由眼眶静脉丛取血约0.5 mL。均肝素抗凝,离心4 000 rpm,时间为5 min,取血浆,按照1.6项下操作处理血浆样品。
1.9 药代动力学数据处理
利用DAS2.0数据处理软件的非房室模型法(统计矩法)计算药代动力学参数,包括:峰值浓度(Cmax)、浓度达峰时间(Tmax)、消除半衰期(t1/2)、药-时曲线下面积(AUC)、平均驻留时间(MRT)、血浆清除率(CL)等。
统计学差异采用软件SPSS19.0进行分析。
2 结果
2.1 方法学验证
2.1.1 选择性
人参皂苷Rb1和内标采用负离子模式对待测成分进行监测。待测组分的MS/MS产物离子图谱见图1。地西泮为人参皂苷Rb1的内标。分别对内标物、人参皂苷Rb1血浆样品、空白血浆样品添加的待测组分和内标物进行液质扫描,如图2可观察到空白血浆中的其他内源性成分对测定物不造成干扰,图2显示,人参皂苷Rb1保留时间为6.18 min,内标物地西泮的保留为1. 67 min。
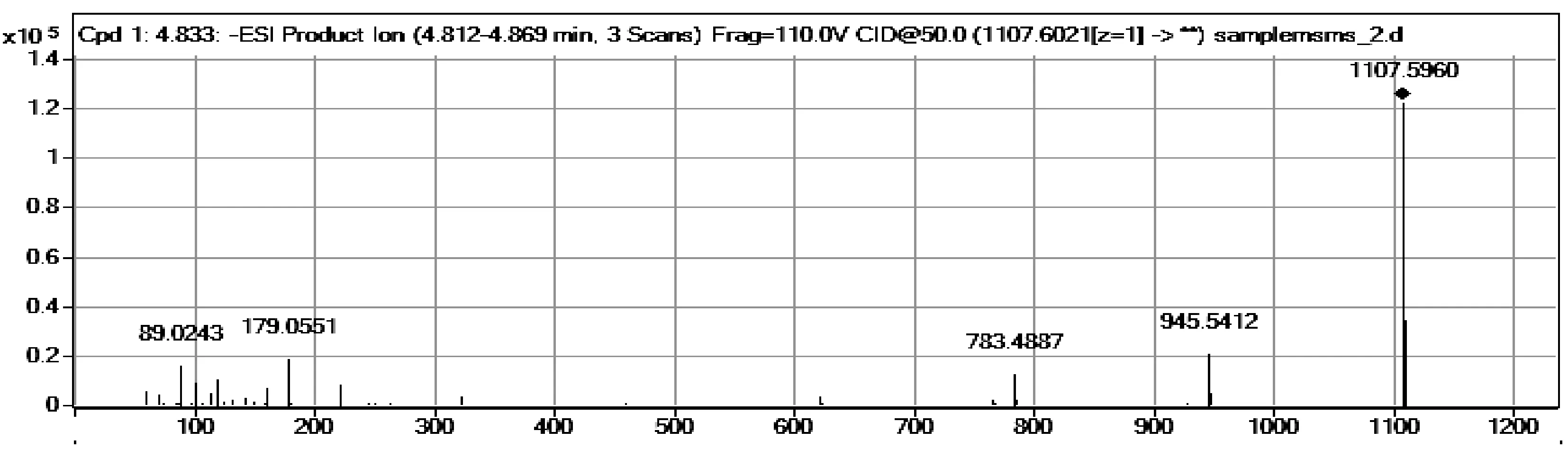
图1 人参皂苷Rb1产物离子
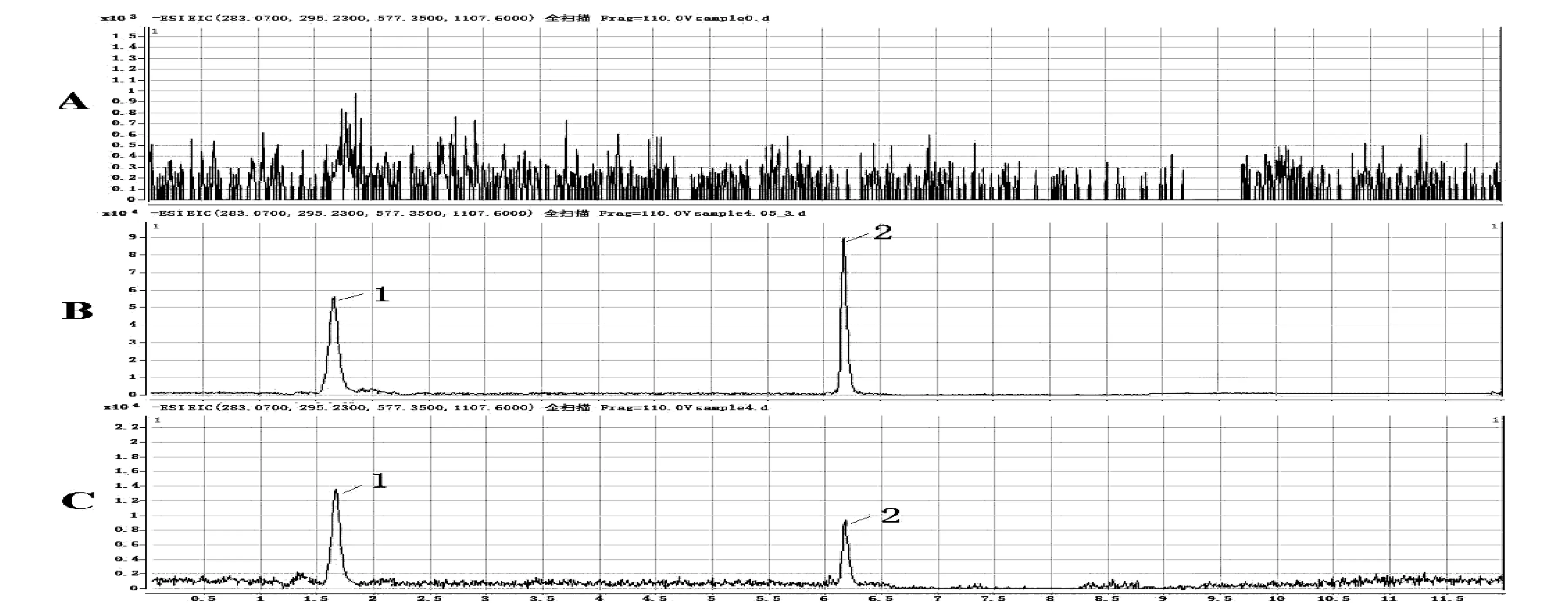
图2 地西泮(1)人参皂苷Rb1(2)的血浆样品色谱图:空白血浆(A);空白血浆添加的待测组分和内标(B);给药2 h后的实测血浆样品(C)
2.1.2 标准曲线和定量下限(Lower limit of quantification,LLOQ)
以标准血浆样品浓度为横坐标X,以人参皂苷Rb1峰面积与内标物地西泮峰面积作比为纵坐标Y,分别采用1/X加权最小二乘法进行线性回归,制作标准曲线,计算线性回归方程为Y=3.346 8X-0.052 8,R2=0.998 5。最低定量下限(S/N=1∶10)为0.05 μg/mL。
2.1.3 精密度和准确度
将配制好的QC样品分别按照血浆样品处理方法进样分析,于日内进行6次测定,得到待测组分及内标峰面积值,分别带入回归方程计算浓度值,求算日内精密度与准确度。于日间进行6次测定,求算日间精密度和准确度。
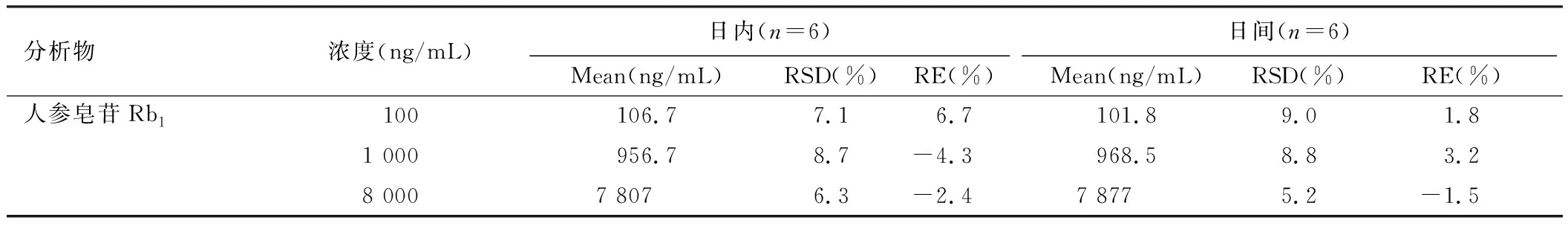
表2 待测组分在大鼠血浆中的精密度和准确度
精密度表示为相对标准偏差(RSD)应≤20%,准确度表示为相对偏差(RE)应在±20%范围内。如表4所示,人参皂苷Rb1日内与日间精密度(RSD)分别为6.3%~8.7%与5.2%~9.0%,日内与日间准确度(RE)分别为2.4%~6.7%与-1.5%~3.2%。根据数据表明待测组分在大鼠血浆中的精密度和准确度均符合分析要求。
2.1.4 基质效应和提取回收率
将配制好的QC样品按照血浆样品处理方法进样分析,测得待测成分与内标峰面积A3。将2组不同个体的空白血浆样品(n=6)分别按照血浆样品处理方法操作后,分别加入与QC样品同等浓度的人参皂苷Rb1与内标混合标准溶液,进样分析测得峰面积A2。将上述混合标准溶液进样分析,得到峰面积A1。
绝对基质效应为A2/ A1;提取回收率为A3/A2。
表3列出了人参皂苷Rb1与内标的基质效应和提取回收率结果。由此表可知在三个浓度下,活性成分均存在一定的基质效应,均在85%~115%范围内,且精密度RSD均小于20%,符合生物样品分析要求。提取回收率结果显示在血浆样品前处理条件下,蛋白沉淀法对人参皂苷Rb1的提取回收率均大于80%。可见人参皂苷Rb1采用血浆处理方法提取回收率良好。
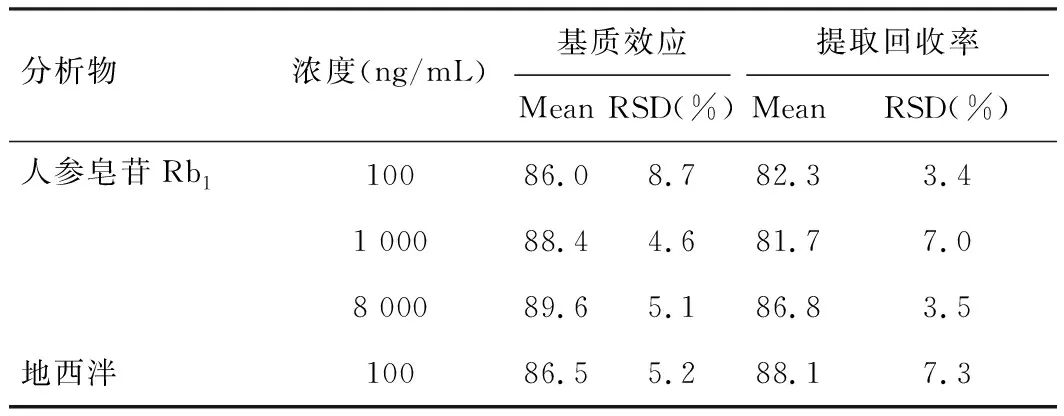
表3 待测组分在大鼠血浆中的基质效应和提取回收率(n=6)
2.1.5 样品稳定性
配制好的QC样品分别做如下处理:①反复动融3次后按照血浆样品处理方法后进样分析;②室温下25℃放置4 h后按照血浆样品处理方法操作进样分析;③置于-80℃冷冻2周后取出解冻后按照血浆样品处理方法操作进样分析;④按照血浆样品处理方法操作后置于自动进样器(4℃)12 h后进样分析。将上述测得峰面积值带入回归方程求算血药浓度。
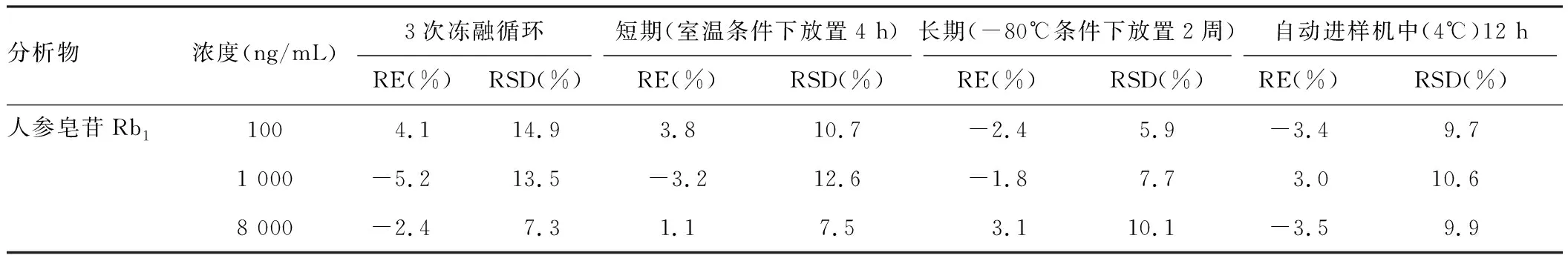
表4 待测组分在大鼠血浆中的稳定性
见表4,三个QC浓度的标准血浆样品的3次冻融循环后的稳定性结果相对标准偏差RSD为7.3%~14.9%,相对偏差RE为-5.2%~4.1%;室温下25℃放置4h的短期稳定性考察结果相对标准偏差RSD为7.5%~12.6%,相对偏差RE为-3.2%~3.8%;-80℃冷冻条件下保存2周的稳定性结果相对标准偏差RSD为5.9%~10.1%,相对偏差RE为-2.4%~3.1%;以及样品处理后置于自动机进样器(4℃)中12h的稳定性结果相对标准偏差RSD为9.7%~10.6%,相对偏差RE为-3.5%~3.0%,RSD结果均小于20%,RE均在±20%范围内,表明待测组分在大鼠血浆中的稳定性符合生物样品的分析要求。
2.2 花旗泽仁组、西洋参组中主要有效成分比较药代动力学
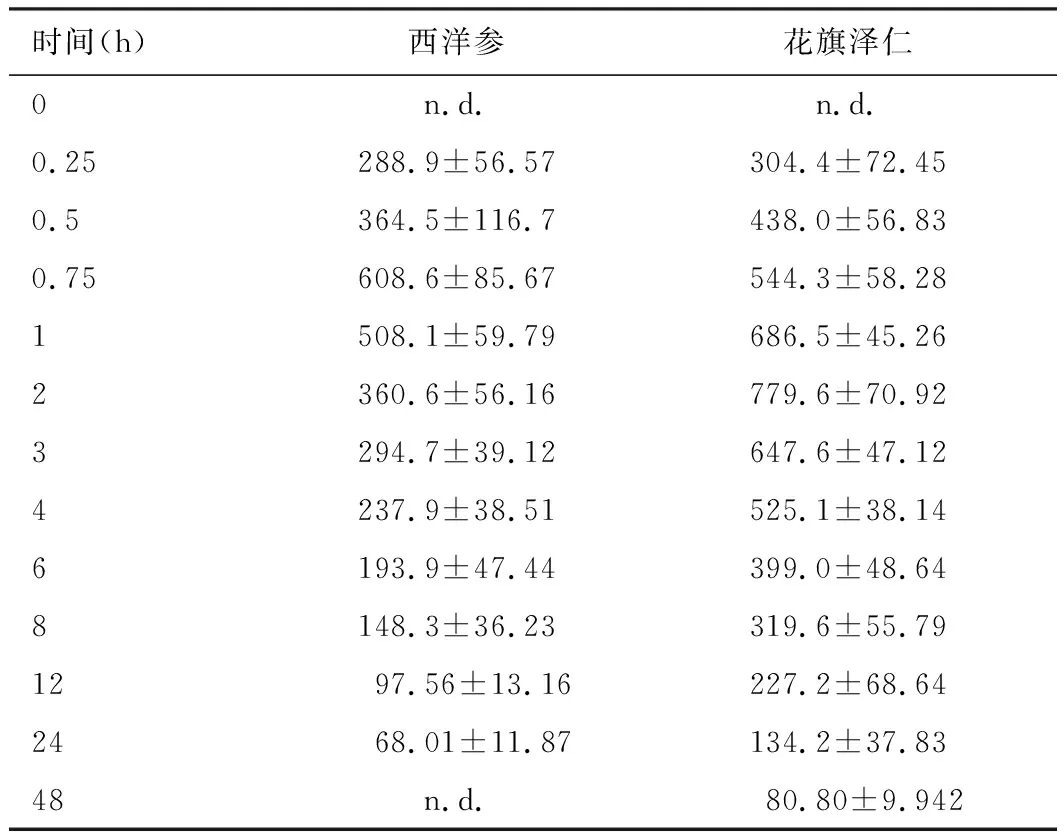
表5 大鼠口服不同水煎液后人参皂苷Rb1的血药浓度-时间数据(ng/mL)
注:n.d.未检测到,低于LLOQ.

表6 大鼠口服不同水煎液后人参皂苷Rb1的主要药代动力学参数
注:与西洋参组比较,*P<0.05,**P<0.01
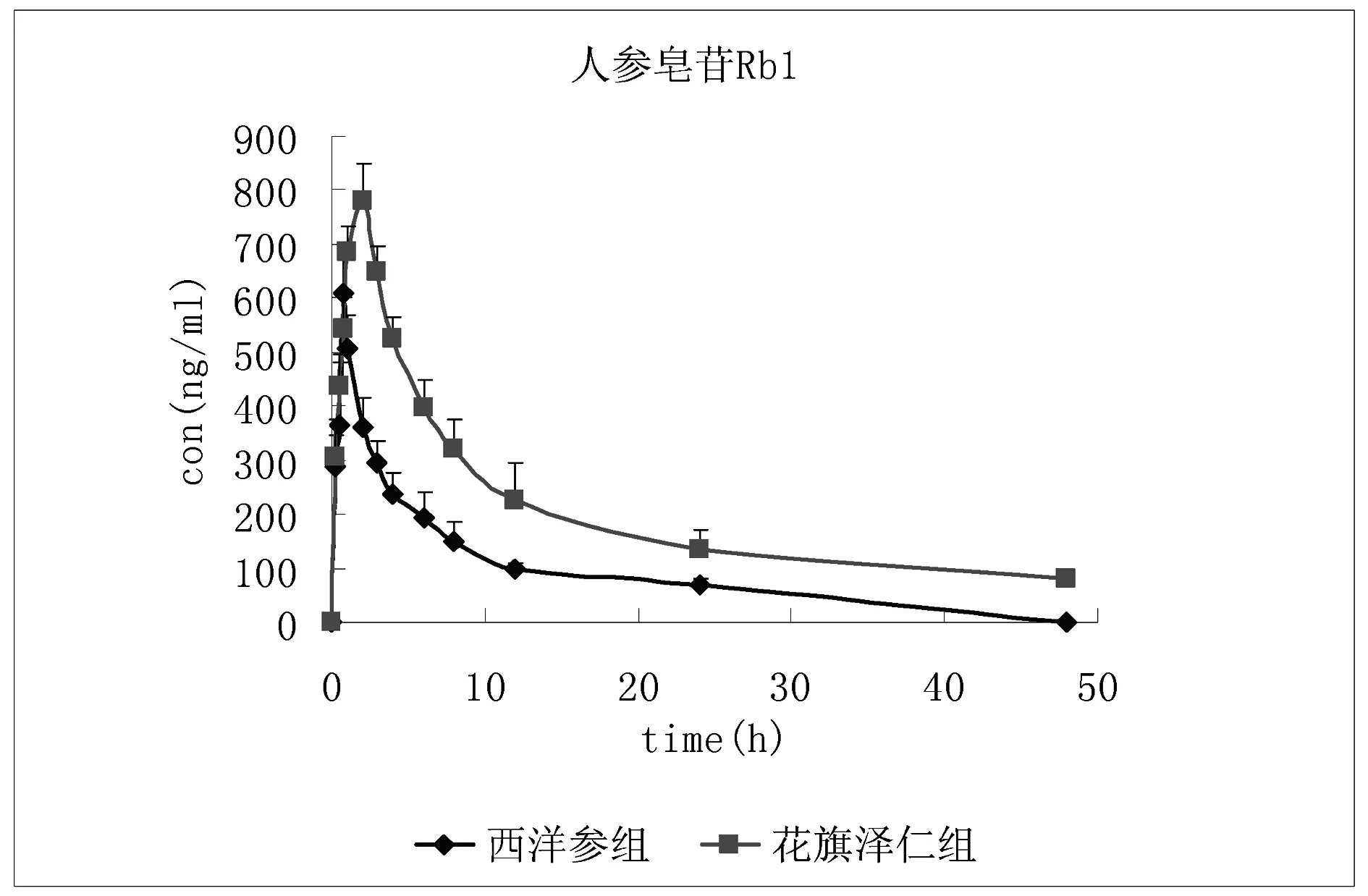
图3 大鼠口服不同提取物后人参皂苷Rb1的平均血药浓度-时间曲线
3 讨论
本实验利用已建立的LC-MS/MS检测大鼠血浆中指标成分的方法,测定正常大鼠分别灌胃花旗泽仁、西洋参后不同时间点指标成分在大鼠血浆样品中的浓度,利用DAS2.0药代动力学软件,进行血药浓度分析。实验结果表明配伍后在大鼠体内吸收良好,体内存留量适宜。从MRT和t1/2值可以看出,配伍后活性成分人参皂苷Rb1在体内消除较慢。在一定时间可以维持稳定的药物治疗浓度。西洋参组中人参皂苷Rb1药代动力学参数结果表明与花旗泽仁组中人参皂苷Rb1在大鼠体内代谢过程基本类似,根据数据可显示其吸收较好,在体内的存留量适宜,体内消除较慢,在一定的时间内也可维持稳定的药物治疗浓度。
与西洋参组相比,花旗泽仁组人参皂苷Rb1的主要药动学参数有显著性的变化,其中Cmax增大,药时曲线下面积AUC0-t增加,半衰期t1/2与平均驻留时间MRT0-t明显延长,清除率CL显著降低,此外血药浓度达峰时间延长,说明组方配伍可延长人参皂苷Rb1在体内的吸收时间,提高人参皂苷Rb1的血药浓度,增加其在体内的吸收程度,并减慢其代谢速度,增加其在体内的驻留时间,复方配伍后起到了延长人参皂苷Rb1
在体内作用时间的作用(见表6)。更有利于人参皂苷Rb1发挥降血糖、改善胰岛素抵抗等药理作用。
人参皂苷Rb1在大鼠体内的吸收增加,经查阅文献报道[8],人参皂苷Rb1的吸收过程属于被动扩散,人参皂昔Rbl是药物转运蛋白P-gp底物,受到P-gp外泵作用,致使人参皂苷Rb1在大鼠体内的生物利用度较低。配伍后Cmax与AUC0-t明显升高,提高了人参皂苷Rb1在大鼠的体内血药浓度,可能是由于花旗泽仁配伍后某种成分抑制了P-gp转运蛋白,或与P-gp存在竞争结合作用,导致人参皂苷Rb1受P-gp蛋白的外排作用减弱,进而改变了人参皂苷Rb1在正常大鼠体内的吸收行为。
对于花旗泽仁治疗2型糖尿病而言,活性成分在胰岛素抵抗发生相关组织中的分布水平可能显得更为重要。我们将继续进行探索。
