加味当归贝母苦参丸对胃癌荷瘤鼠肿瘤组织VEGFA、MMP13和TGF-β表达的影响
2018-08-24樊晓明翟宇安霞吴红彦李海龙
樊晓明,翟宇,安霞,吴红彦,李海龙*
(1.甘肃省定西市中医院药剂科,甘肃 定西 743000;2.甘肃中医药大学临床医学院临检基础教研室,甘肃 兰州 730000;3.甘肃省中医方药挖掘与创新转化重点实验室 甘肃省中药新产品创制工程实验室 甘肃省中药药理与毒理学重点实验室,甘肃 兰州 730000;4.甘肃中医药大学附属医院,甘肃 兰州 730000)
胃癌是全球高发的恶性肿瘤之一,也是癌症死因中排第二位的恶性肿瘤[1]。我国肿瘤统计资料显示[2]:全国恶性肿瘤发病数据中,城市地区恶性肿瘤新发病胃癌排第3位,农村肿瘤登记发病胃癌排第2位,全国恶性肿瘤死亡胃癌排第3位,防控形势严峻。肿瘤的侵袭、转移是肿瘤复发、治愈率低的重要原因。中医药防治肿瘤的优势十分明显,在抑制肿瘤增殖、侵袭、转移等方面具有一定的临床应用和研究价值,然而相关机制并未阐明。本课题组前期研究显示:当归贝母苦参丸干预胃癌和肝癌的体内外实验均显示有明确的药效。另外,加味当归贝母苦参丸对MFC胃癌荷瘤小鼠具有显著抑瘤作用,而且可以下调荷瘤小鼠肿瘤组织中的TLR2、TLR4、TLR6、TRAF6和My D88 mRNA和蛋白的表达[3]。当归贝母苦参丸含药血清可以抑制胃癌SGC-7901细胞的侵袭转移[4],而其机制并未阐明。另外,当归贝母苦参丸加味方可以下调H22肝癌荷瘤小鼠肿瘤组织中MMP13和bFGF mRNA和蛋白的表达[5],进而抑制肿瘤侵袭和血管生成。为明确当归贝母苦参丸加味方对胃癌荷瘤小鼠肿瘤组织是否也有相同的作用,本研究拟通过实时荧光定量PCR法及免疫组化法检测荷瘤小鼠胃癌组织中肿瘤侵袭转移相关标志物VEGFA、MMP13、TGF-β mRNA和蛋白的表达变化,为中医药临床防治胃癌提供有效的科学依据。
1 材料与方法
1.1 实验动物
SPF级BALB/c-nu小鼠60只,体质量(20±2)g,雌、雄各半,购于北京维通利华实验动物技术有限公司;合格证号:SCXK(京)2012-0001。饲养条件:室温20~25℃,湿度45%~55%。实验动物分笼饲养,进食标准饲料,饮水自由,饲料由甘肃中医药大学科研中心动物实验室提供,MFC前胃癌细胞购自于中科院上海细胞库。
1.2 仪器与试剂
生物安全柜(力康公司);CO2培养箱(力康公司);荧光倒置显微镜(日本OLYMPUS);ABI7500荧光PCR仪(ABI,美国ABI公司)。DMEM培养基(健顺生物科技有限公司)、胎牛血清(杭州四季青公司);逆转录试剂盒(DR036A,大连宝生物工程有限公司),GoTaq®qPCR Master Mix扩增试剂盒(A6010,promega公司),一抗和二抗分别由博士德生物和中杉金桥公司提供。加味当归贝母苦参丸主要药物由黄芪、当归、浙贝母、苦参、山慈菇等组成,购自甘肃中医药大学附属医院,顺铂注射液,20 mg/支,江苏毫森药业股份有限公司(批号:H20010743)。
1.3 方法
1.3.1 荷瘤鼠模型的建立
将收集好的小鼠体内传代的细胞计数后,用PBS将细胞浓度调整为15×106/mL的悬液,在小鼠腋下接种胃癌MFC细胞,每只接种量为0.2 mL。
1.3.2 治疗及分组
造模后观察肿瘤达到0.5 cm左右直径时,剔除体积过大或过小的小鼠,将筛选合格的48只小鼠随机分设为模型组、顺铂阳性对照组、加味当归贝母苦参丸高、低剂量组、顺铂联合加味当归贝母苦参丸高、低剂量组共6个组。分组后第二天开始治疗,模型组:每只小鼠予蒸馏水0.2 mL灌胃, 同时予理盐水0.1 mL腹腔注射;中药组予中药水提物0.2 mL灌胃;联合组予中药和顺铂0.1 mL(剂量25 mg/kg)腹腔注射;顺铂组:予蒸馏水0.2 mL灌胃, 同时予顺铂0.1 mL(剂量25 mg/kg)腹腔注射隔日给药。以上药物顺铂5日给药1次,共3次,当归贝母苦参丸加味方每日1次,共14 d。
1.3.3 RT-qPCR检测VEGFA、MMP13和TGF-β mRNA的表达
将肿瘤组织从液氮中取出片刻后,用电子天平称取30 mg置于经DEPC处理的EP管中,加入Trizol试剂裂解液匀浆,常规低温抽提总RNA后,用无RNA酶水溶解并检测其质量和浓度。用Takara 036A逆转录试剂盒逆转录合成cDNA,提取完成后,进行逆转录反应,反应条件如下:37 ℃ 15 min,85 ℃ 5 s。使用PREMEGO扩增试剂GoTaq®qPCR Master Mix扩增试剂进行PCR扩增反应。扩增条件为:95℃5 min预变性,95℃ 10 s变性、60℃ 20 s退火40个循环,而后分析溶解曲线,确认扩增产物的特异性,以β-actin作为内参基因,相对表达量计算采取2-△△CT法计算,独立样本重复3次检测, 小鼠VEGF、 MMP13、TGF-β基因的引物序列见表1。
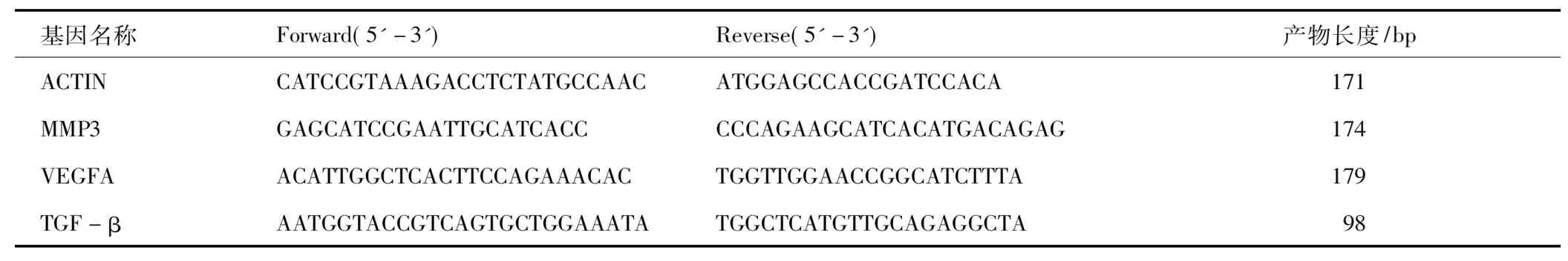
表1 小鼠MMP13、VEGF、TGF-β和基因的扩增引物序列
1.3.4 免疫组织化学技术检测MMP13、VEGFA和TGF-β蛋白表达
免疫组织化学检测方法采用ABC法。其简要过程如下:各组肿瘤组织样本石蜡切片常规脱蜡水化,以3%去离子水灭活内源性酶10 min,微波修复抗原5 min,间隔重复1次;然后依次滴加一抗、生物素化山羊抗兔;滴加SABC,DAB显色,苏木素复染,梯度脱水透明后封片,显微镜下观察、拍照。结果判定:以胞浆中出现棕黄色颗粒为阳性。应用图像分析系统记录各组样本的VEGF、MMP13和TGF-β平均灰度,作为蛋白表达的量化指标。
1.4 统计学处理
2 结果
2.1 RT-qPCR分别检测VEGFA、MMP13和TGF-β mRNA的表达
各组RT-qPCR结果显示,与对照组相比,各干预组VEGFA、MMP13、TGF-β mRNA表达量均显示有不同程度下调,其中中药高剂量组,顺铂组以及中药高剂量加顺铂组下调较为明显。尤其以中药高剂量加顺铂组用药组下调表达较为显著(P<0.05,见表2)。
2.2 免疫组化法分别检测VEGFA、MMP13和TGF-β蛋白的表达
免疫组化法检测各指标,图片显示:胞浆或胞膜出现的黄色或棕黄色颗粒为阳性着色。各组蛋白表达结果显示,VEGFA、MMP13、TGF-β蛋白着色与模型组相比呈现深着色现象,表明为强阳性或阳性表达,而模型组呈现弱阳性或阴性表达,差异具有统计学意义。平均灰度分析可见,与模型组比较,各治疗VEGFA、MMP13和TGF-β的表达均有下降,顺铂组VEGFA、MMP13、TGF-β的表达改变优于中药低剂量组、高剂量组;中药高剂量加顺铂组、中药低剂量加顺铂组VEGFA、MMP13、TGF-β的表达改变明显优于顺铂组、中药高剂量、低剂量组。见表3,图1~3。
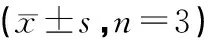
表2 各组肿瘤VEGFA、MMP13和TGF-β的mRNA表达的比较
注:与模型组比较,▲P<0.05,▲▲P<0.01;与中药低剂量组比较,△△P<0.01;与顺铂组比较,▼P<0.05,▼▼P<0.01;与中药高剂量组比较,※P<0.05,※※P<0.01

图1 免疫组化染色检测各组MMP13表达(免疫组化染色,×400)

图2 免疫组化染色检测各组VEGF表达(免疫组化染色,×400)
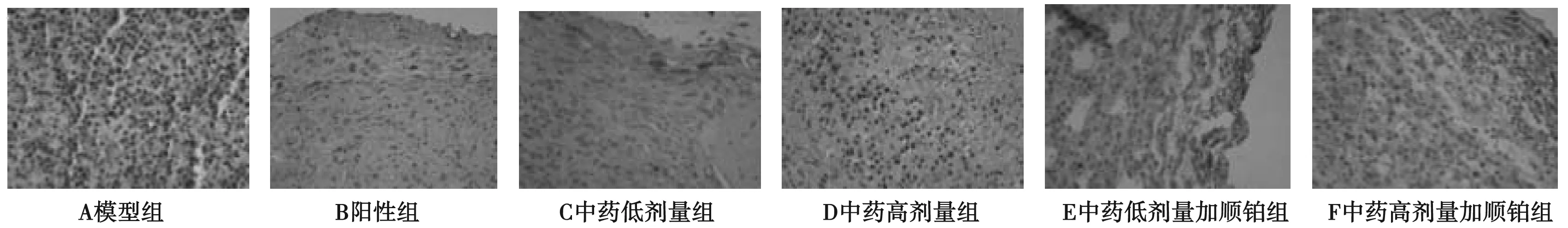
图3 免疫组化染色检测各组TGF-β表达(免疫组化染色,×400)

组别n MMP13VEGFATGF-β模型组571.43±4.5986.67±2.6597.34±3.77顺铂组599.53±2.12▲▲114.94±3.08▲▲119.53±1.47▲▲中药低剂量组580.61±2.06▼▼95.61±3.12▲▼▼103.33±2.01▼▼中药高剂量组587.45±1.65▲▲△△▼▼105.24±2.46▲▲△△▼▼114.86±1.97▲△△▼中药低剂量加顺铂组5109.36±1.96▲▲△△▼▼※※119.29±1.12▲▲△△※※123.73±1.42▲▲△△▼※※中药高剂量加顺铂组5115.71±2.25▲▲△△▼▼※※123.66±1.90▲▲△△▼※※127.92±1.84▲▲△△▼▼※※
注:与模型组比较,▲P<0.05,▲▲P<0.01;与中药低剂量组比较,△△P<0.01;与顺铂组比较,▼P<0.05,▼▼P<0.01;与中药高剂量组比较,※P<0.05,※※P<0.01
3 讨论
侵袭转移是肿瘤的恶性表征之一,难以彻底治愈的重要原因。近年来,通过重要生物标志物靶向治疗是抑制肿瘤侵袭转移研究的热点之一。其中,血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)具有促进细胞迁移、增殖和血管形成的作用[6],人基质金属蛋白酶-13(matrix metalloproteinase-13,MMP13)作为蛋白水解酶降解细胞外基质参与肿瘤侵袭转移[7],转化生长因子-β(transforming growth factor-β,TGF-β)直接依赖于Smad,p38 MAPK, 和PI3K/Akt多个肿瘤抑制和肿瘤促进作用侵袭转移[8]。因此,VEGFA、MMP13、TGF-β均为肿瘤侵袭转移相关的重要肿瘤标志物。黄钢丁等[9]研究显示,胃癌组织MMP-13蛋白表达率显著高于癌旁组织,淋巴结转移组显著高于无转移组;胃癌组织MMP-13蛋白表达率增高与胃癌的浸润和转移有关。文献报道,胃癌肿瘤组织中MMP-13的高表达与总生存期缩短呈显著相关[10]。因此,MMP-13可作为判断胃癌恶性程度和预测预后的参考指标。
TGF-β的表达与肿瘤的浸润深度、淋巴结转移及TNM分期密切相关;TGF-β1阳性的患者比其阴性的患者更易发生淋巴结和远处转移[11];研究报道,胃癌细胞中高表达的TGF-β1的可以诱导腹膜间皮细胞纤维化,伴有E-cadherin上调,αSMA下调[12]。TGF-β1受体阻滞剂SB-431542可以阻断上述改变,部分减轻早期胃癌腹膜播散。TGF-β1诱导胃癌细胞的浸润转移,经由fascin蛋白介导,包括ERK和JNK信号转导通路也参与其中。
胃癌组织中VEGF的表达显著高于正常胃黏膜组织;且癌组织中VEGF的表达与肿瘤浸润深度、淋巴转移、远处转移、静脉侵犯和TNM分期均有显著相关性[13-14]。对于接受根治性手术治疗的Ⅰ~Ⅲ期胃癌患者,VEGF和HIF-1α阳性表达可能是影响胃癌患者的不良预后因素[15]。高表达VEGFA和VEGFC的胃癌组织,其肿瘤体积较大,淋巴管密度、微血管密度、淋巴管浸润、淋巴结转移程度高于癌周组织[16]。而且,体外实验研究显示,沉默VEGF-A基因的表达能显著抑制胃癌细胞增殖[16-17];动物体内试验显示,沉默VEGFA基因能缩小肿瘤体积。研究报道[7]:沉默VEGFA 基因还可以下调荷瘤鼠肿瘤组织中SIRT1、Survivin和Bcl-2的表达,而上调p53和p21的表达。
本研究显示:当归贝母苦参丸加味方可抑制肿瘤组织中VEGFA、MMP13和TGF-β mRNA RNA和蛋白的表达, 并且在与化疗药物联用后,VEGFA、MMP13和TGF-β mRNA和蛋白的下调表达更加明显,加味当归贝母苦参丸可以调控VEGFA、MMP13和TGF-β的表达,发挥抗肿瘤作用。
当归贝母苦参丸出自《金匮要略》,原用于治疗妊娠小便困难,具有养血开郁清热除湿的功效。加味当归贝母苦参丸在此基础上加黄芪、全蝎、山慈菇等益气解毒药组成新方。新方具有益气扶正,养血活血,化痰散结,清热利湿,解毒散结,通络止痛等功效,新方契合了肿瘤正气不足,痰(湿)浊、癌毒、瘀血内阻的发病机制。前期研究显示,当归贝母苦参丸对消化道常见肿瘤胃癌和肝癌具有明确抑瘤作用和相应机制[3-5]。现代药理学研究表明,本研究中所用药材含有效成分,如黄芪多糖、当归多糖、贝母碱、苦参碱等成份均对多种癌细胞有明显的抑制作用,这些有效成分可能是抗肿瘤作用的物质基础。综上所述,当归贝母苦参丸加味方发挥对荷瘤小鼠MFC胃癌的抗肿瘤作用与下调VEGFA、MMP13和TGF-βmRNA的表达和蛋白的表达有关。
