基于双壳贝类的多环芳烃生物标志物检测技术的研究
2018-08-24卓艺蓉
卓艺蓉
(平潭综合实验区海洋与渔业执法支队,福建 平潭 350400)
多环芳烃(PAHs)主要来源于有机物的热解或不完全燃烧,是最早被发现和研究的致癌类化合物之一,其中以苯并(a)芘{B[a]P}最具代表性,该污染物会对海洋生物产生严重危害[1-2]。随着海上石油和轮船运输业的发展,我国海洋PAHs的污染日益加重,如青岛胶州湾近岸海水和表层沉积物中的PAHs的含量分别为8.23~272.03 ng/L、82~4 562 ng/g,达到或接近中等污染水平[3]。目前我国许多沿海城市已将石化、造船、港口等产业集群作为优先发展的支柱产业,这些都可能成为持久性有害物质(PTS)的潜在污染源,必将对我国近海生态环境安全和人类健康带来潜在的风险。
已有研究表明PAHs进入生物体后首先与芳烃受体(AhR)结合,之后经过细胞色素P450酶系(CYP450s)如芳烃羟化酶(AHH)等代谢转化为更具极性的Ⅰ相代谢中间产物,这些代谢产物在Ⅱ相代谢酶的催化下进一步与内源物质分子结合,加快了代谢产物排出体外的速度[4]。另一方面在解毒代谢过程中产生大量的活性中间产物和自由基,在一定范围内,这些自由基能被体内抗氧化防御系统如超氧化物歧化酶(SOD)等清除,当抗氧化防御系统不能消除这些活性氧时,会造成DNA损伤等毒性效应[5]。吕晏锋等[6]的研究结果表明多环芳烃类污染物中的菲鲤鱼的亚急性毒性作用显著;崔培等[7]通过研究萘暴露下牙鲆肝脏抗氧化防御系统相关指标的变化,发现SOD、CAT及LZM的响应较AKP更为敏感。目前这些研究主要集中在哺乳动物和鱼类中,有关贝类方面的研究较少[8-12],而PAHs对菲律宾蛤仔分子生物标志物的研究报道也较少。本文拟研究B[a]P对菲律宾蛤仔消化盲囊和鳃丝毒理学指标的影响及DNA损伤效应,探讨PAHs对菲律宾蛤仔的致毒机理,全面筛选用于PAHs毒性评定的生物标志物,为我国近海PAHs污染评价与监测提供理论依据和技术支撑。
1 材料与方法
1.1 实验材料
实验用菲律宾蛤仔购于青岛南山水产品市场,在30 cm×40 cm×50 cm的塑料水槽中暂养10 d,海水盐度31,pH为8.1,温度为15℃,连续充气,日换水100%,养殖密度为300~400个/m3,并在换水后投喂螺旋藻粉,日投饵量6 g/m3。
1.2 实验方法
1.2.1 实验梯度的设置
通过HPLC测定,青岛近海海域自然海水中B[a]P的浓度为0.155 ng/L,实验中各浓度梯度的设置主要依据是污染水体中PAHs的浓度可能达到50.0 μg/L,而深海或未污染水域中PAHs含量一般低于1 μg/L[13],实验采用Sigma公司生产的B[a]P。首先将B[a]P溶解于一定量的3 μg/L丙酮(助溶剂)中,制备一定浓度的储备液,再分别用自然海水配制浓度梯度为0、0.01、0.2 μg/L B[a]P实验组,分别以未添加PAHs和只加入3 μg/L丙酮的自然海水处理组作为实验对照组,所有实验梯度均设3个平行组,各处理组丙酮维持相同浓度。
各实验组分别用50 cm×40 cm×30 cm的塑料水槽盛放,从暂养的菲律宾蛤仔中挑选健康、活力强的菲律宾蛤仔放置于每个水槽中,每个水槽分别放置36只,实验期间的养殖管理与暂养期间完全相同,换水时分别加入相应各实验梯度的养殖用水,实验期间菲律宾蛤仔无死亡现象。实验开始后于0、1、3、6、10 d取样。取样时,每个梯度各水槽随机选取6只菲律宾蛤仔,取鳃丝和消化盲囊于-80℃冰箱内保存,用于各实验指标的测定。
1.2.2 样品制备
酶液的制备:分别将菲律宾蛤仔鳃丝和消化盲囊样品约100 mg。置于pH=7.6 预冷的缓冲液(Tris20 mmol/L、蔗糖0.5 mol/L、KCl 0.15 mol/L、EDTA 1 mmol/L、10%甘油),在冰浴中匀浆3 min,转速为12 000 r/min,然后将匀浆液离心25 min,转速为3 000 r/min,所得上清液即为酶液。
DNA提取:取菲律宾蛤仔鳃和消化盲囊各0.5 g,研磨剪碎后分装,加入0.45 mL裂解缓冲液(50 mmoL/L Tris、100 mmoL/L EDTA、pH 8.0)和 80 μL 10%SDS。再加入2.5~5.0 μL(一般3 μL)蛋白酶K(20 mg/mL),使其终浓度达100 μg/mL,混匀。55℃水浴3 h至过夜。样品中加入150 μL饱和NaCl,室温13 000 rpm离心20 min(T=15℃),去沉淀。配制PCI抽提液,加入等体积苯酚抽提,轻轻混匀,静止5 min。4℃、13 000 rmp离心10 min。将上层水相移入小离心管中,用PCI抽提液(苯酚∶氯仿异∶戊醇=24∶25∶1)重复抽提2次。加二倍体积(约0.5 mL)无水乙醇和1/10体积(150 μL)醋酸钠(3 mol/L,pH 5.2)。在-20℃冰箱中放置3 h至过夜,13 000 rmp离心15 min,弃去表面相。最后用500 μL 70%乙醇洗涤2次,干燥,溶于600 μL TE(10 mmol/L Tris、1 mmol/L EDTA)中。
1.2.3 解毒代谢酶活力的测定
芳烃羟化酶(AHH)活性的测定参照Walton(1978)[14]的方法:取170 μL 酶液,加入10 μL NADPH,200 μL Tris-HCl(0.1 mmol/L,pH 7.6,含MgCl2)缓冲液;放到30℃水浴锅中预培养2 min,加入20 μL(2.5 mg/mL)PPO起始反应,反应液培养30 min;加入1 mL预冷丙酮终止反应;加3.25 mL正己烷萃取。吸出2 mL有机相,用5 mL水溶的(1 mol/L)NaOH反相萃取,取下层水相3 mL,用荧光分光光度计测荧光值(吸收355 nm/发射515 nm)。AHH活力单位:产物荧光强度/mg 蛋白。
谷胱甘肽-S-转移酶(GST)活性的测定参照Habig(1974)[15]的方法:按每孔150 μL 反应体系[0.05 mmol/L(pH 为6.9)磷酸钾缓冲液100 μL;15.0 mmol/L CDNB 10 μL;15.0 mmol/L GSH 10 μL;20 μL 重蒸水;10 μL 匀浆液]和10 μL粗酶液加入96 孔微孔板,加入样品30 s后,在温度30℃、波长340 nm处时间间隔为20 s连续读数6次。酶活力用每min每mg蛋白催化产生的2,4-dinitrophenyl glutathione 的nmol量来表示,单位nmol·min-1·mg-1pro。
超氧化物歧化酶(SOD)活性的测定参照Marklund(1974)[16]的方法:pH=8.3、50 mmol/L Tris-HCl缓冲液4.5 mL;0.1 mL样液;10 μL 50 mmol/L连苯三酚,迅速摇匀;波长325 nm处每隔30 s测一次A值,使自氧化速率△A325nm/min控制在0.070 OD/min左右。单位用nmol·min-1·mg-1pro表示。
谷胱甘肽过氧化物酶(GSH)总量测定参照范崇东(2004)[17]的方法:取匀浆上清液100 μL,加入300 μL NaOH(0.15 mol/L)溶液,摇匀;加入体积分数3%甲醛(用水配)(pH=12)100 μL,摇匀,静置2 min;加入500 μL DTNB (10 mmol/L)分析溶液,摇匀,在25℃水浴保温5 min;测定在波长412(405、414)nm处的吸光度A,通过计算或从标准曲线上得出相应GSH浓度。酶活力单位(U)表示为每mg 蛋白的荧光强度。
1.2.4 DNA损伤的测定
双链:取分离的双链DNA 100 μL于试管中,加入100 μL 50 mmol/L NaCl,5 μL含0.2%SDS的2 mmol/L EDTA,3 mL 0.2 mol/L磷酸钾缓冲液(pH 6.9),3 μL二苯丙咪唑,混匀后至于暗处反应15 min后测荧光;单链:取DNA 100 μL,于80℃加热30 min,取分离的单链DNA 100 μL于试管中,加入100 μL 50 mmol/L NaCl,5 μL含0.2%SDS的2 mmol/L EDTA,3 mL 0.2 mol/L磷酸钾缓冲液(pH 6.9),3 μL二苯丙咪唑,混匀后置于暗处反应15 min后测荧光;碱解旋:将分离纯化的DNA样品100 μL,加入50 μL 0.05 mol/L NaOH,混匀后于0℃孵育30 min。取出,快速加入50 μL 0.05 mol/L HCl,及2 μL 0.5%SDS,21号针头吸放6次混匀。在上述碱解旋后的DNA样品中加入3 mL 0.2 mol/L磷酸钾缓冲液(pH 6.9),3 μL二苯丙咪唑(10 μg/L),混匀后置于暗处反映15 min后荧光。
DNA完整性通常以F值表示,计算公式为:
F={X(auDNA)-XL(ssDNA)}/{XL(dsDNA)-XL(ssDNA)}
式中,X为荧光值;dsDNA为双链DNA;ssDNA为单链DNA;auDNA为解旋后的DNA。
1.3 数据统计分析
所有数据均以3个平行组数据的平均值±标准差(Means±SD)表示,并采用SPSS软件进行单因素方差分析(ANOVA)和Duncan检验法统计分析。
2 实验结果
2.1 B[a]P对菲律宾蛤仔组织解毒代谢酶活力的影响
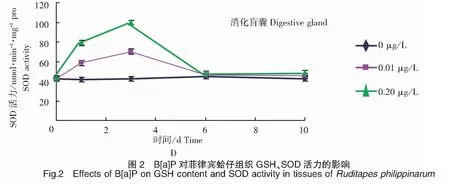
由图1可见,菲律宾蛤仔鳃丝和消化盲囊AHH、GST活力受B[a]P诱导发生显著变化(P<0.05),而对照组无明显变化。所有处理组组织AHH活力均表现为显著的诱导作用(P<0.05),于3 d达到最大值,然后趋于稳定。各处理组组织GST活力在实验时间内呈先升高后下降趋势,分别于1 d、3 d时达到最大值和最小值,然后保持稳定,并显著低于对照组水平(P<0.05)。同时各处理组组织AHH活力在稳定后与B[a]P浓度呈正相关性,GST活力在稳定后与B[a]P浓度呈负相关性。

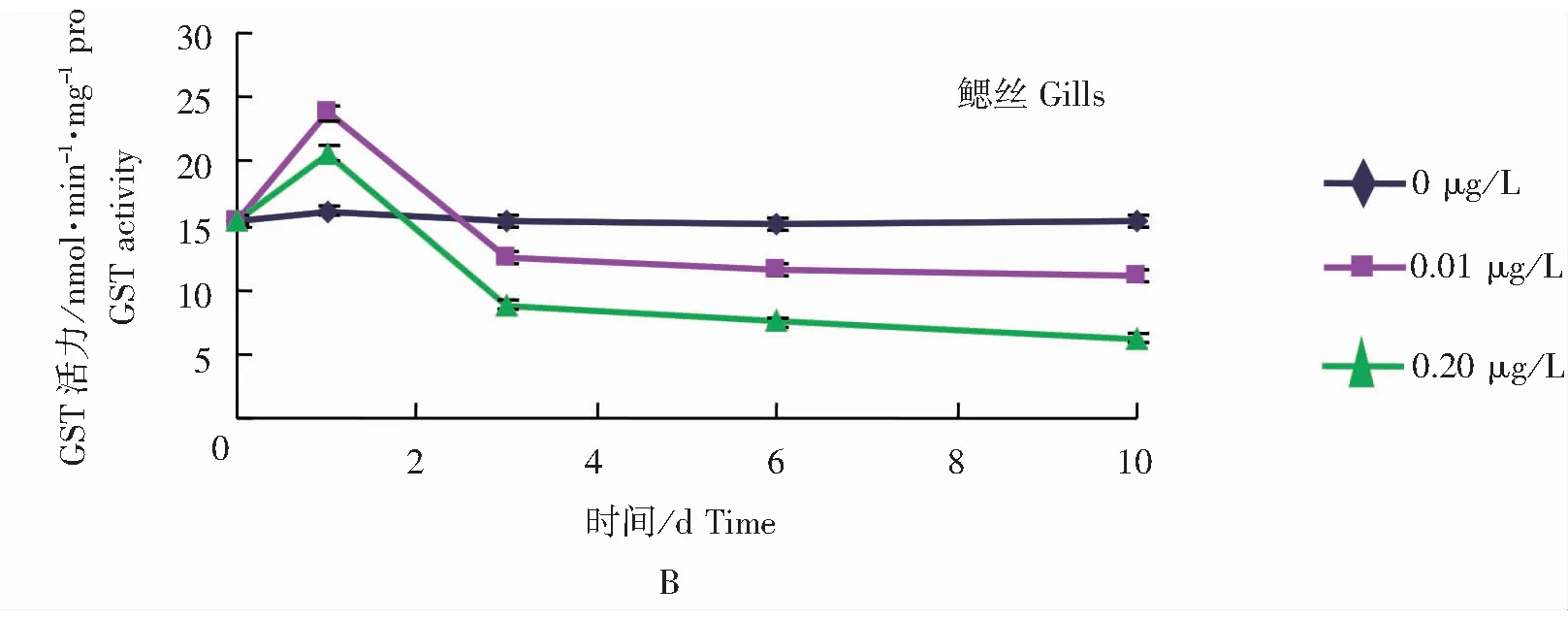

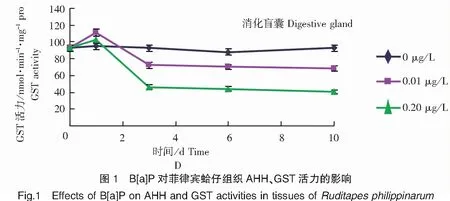
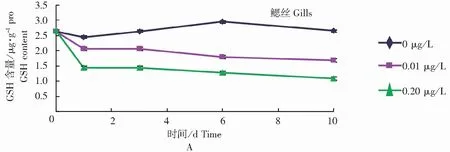
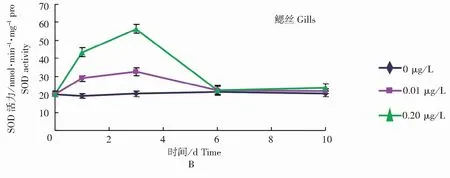
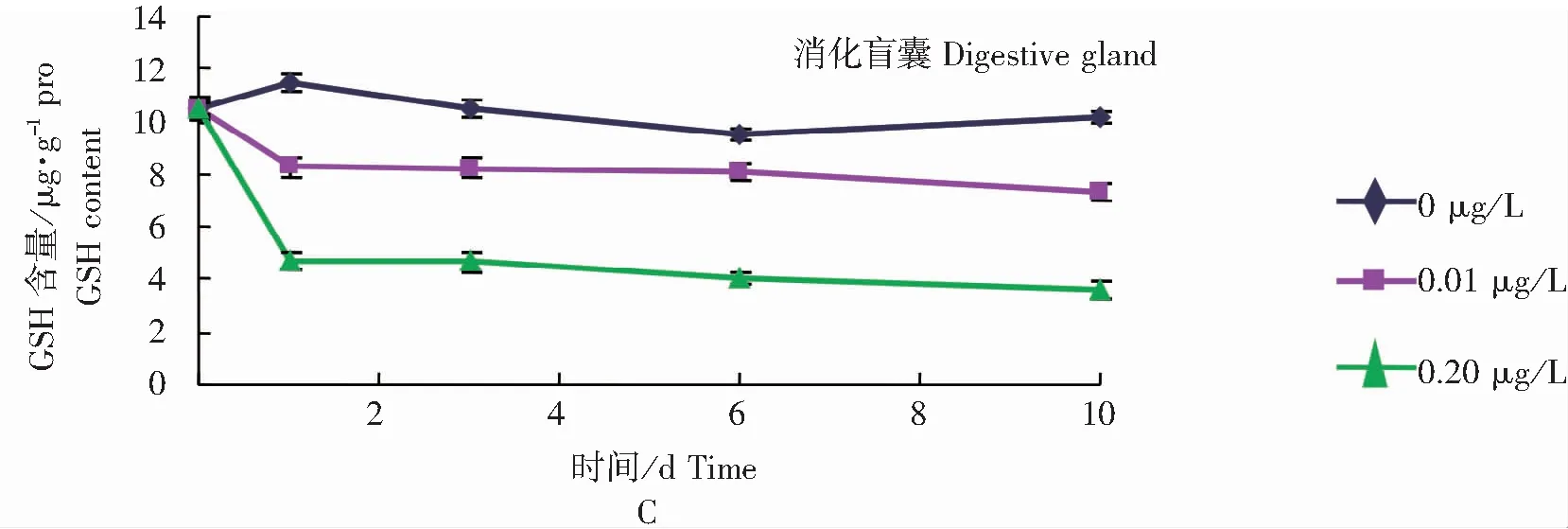
图2表明,暴露于B[a]P环境中的菲律宾蛤仔鳃丝和消化盲囊GSH含量、SOD活力被显著诱导和抑制(P<0.05),而对照组无明显变化。所有处理组组织GSH的含量均表现为显著的抑制作用(P<0.05),于1 d达到最小值,然后趋于稳定。各处理组组织SOD活力在实验时间内呈先升高后下降趋势,分别于3 d、6 d时达到最大值和最小值,然后保持稳定,恢复至对照组水平。
2.2 B[a]P对菲律宾蛤仔组织DNA单链断裂水平的影响
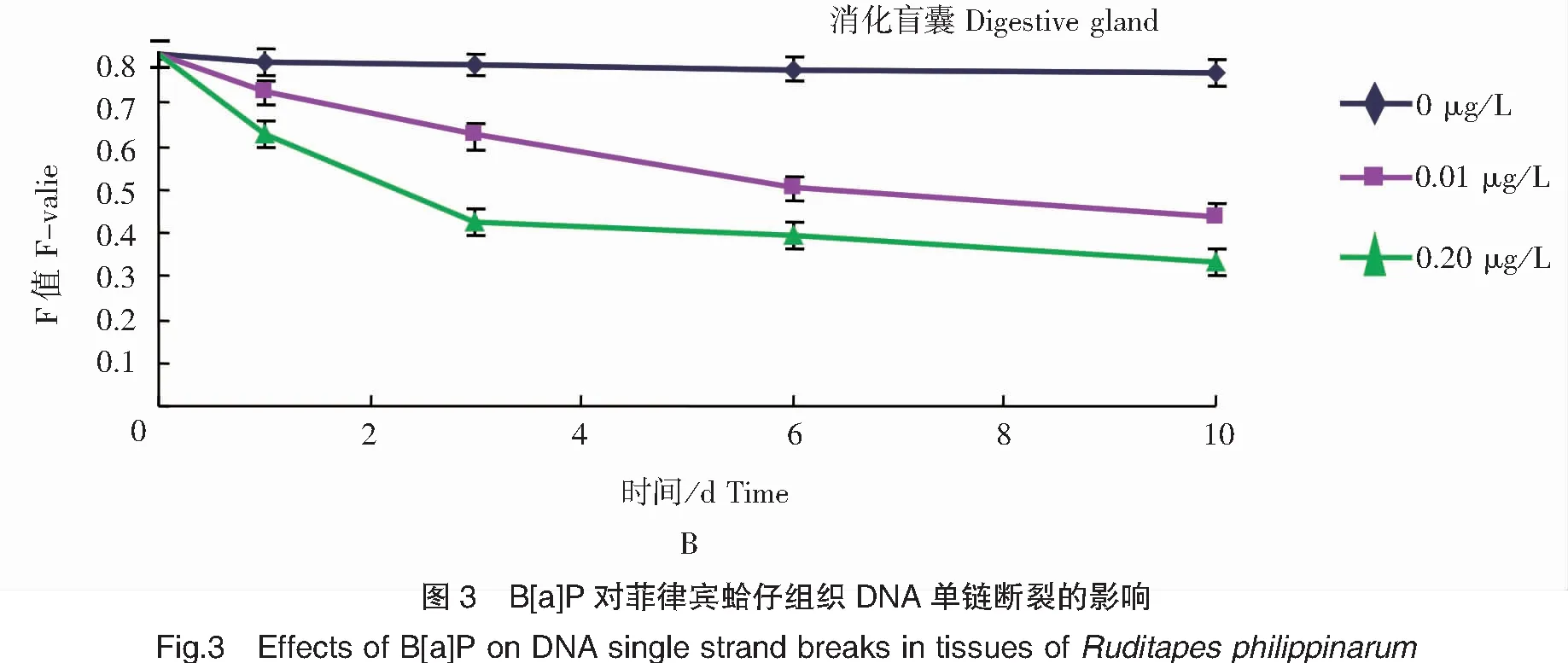
图3表明,各处理组菲律宾蛤仔鳃丝和消化盲囊DNA损伤(以F值表示)显著(P<0.05),而对照组无明显变化。各染毒处理组组织F值随着实验天数的增加而明显下降。在鳃丝处理组中,染毒1 d后F值迅速降低,在3 d后达到最低值,然后趋于稳定。而在消化盲囊处理组中,0.01 μg/L处理组在染毒后F值逐渐降低,6 d时达到最低值;0.20 μg/L处理组在染毒后F值迅速降低,在第3 d达到最低值,然后趋于稳定。各处理组组织F值在稳定后,均与B[a]P浓度呈显著负相关(P<0.05)。



注:紫色线段表示染毒3 d时各指标实验数据的剂量效应关系图;绿色线段表示染毒10 d时各指标实验数据的剂量效应关系图。
Notes:The purple line segment represented the dose-effect relation diagram of the experimental data of each index at 3 days after the exposure.The green line segment represented the dose-effect diagram of the experimental data of each index at 10 days of exposure.

表1 在染毒3 d时菲律宾蛤仔解毒代谢和DNA损伤指标与B[a]P的相关分析
2.3 菲律宾蛤仔组织解毒代谢和DNA损伤指标与B[a]P浓度的相关性
由图4、表1可知,除菲律宾蛤仔鳃丝GSH含量这个指标外,其他指标(鳃丝的AHH、GST、SOD活力和DNA损伤,消化盲囊的AHH、GST、SOD活力和GSH含量和DNA损伤)在B[a]P暴污3 d时与B[a]P浓度均呈明显的线性关系,其中鳃丝和消化盲囊AHH和SOD活力与B[a]P浓度呈显著的正相关,GST活力、GSH含量、DNA损伤与B[a]P浓度表现为明显的负相关。

表2 在染毒10 d时菲律宾蛤仔解毒代谢和DNA损伤指标与B[a]P的相关分析
由图4、表2可知,除鳃丝GSH含量和消化盲囊DNA损伤这两个指标外,菲律宾蛤仔在B[a]P污染环境中暴污10 d时,其组织AHH、GST、SOD活力和GSH含量、DNA损其伤与B[a]P浓度均呈明显的线性关系,其中鳃丝和消化盲囊AHH和SOD活力与B[a]P浓度呈显著的正相关,GST活力、GSH含量、DNA损伤与B[a]P浓度表现为明显的负相关。
3 讨论
3.1 B[a]P对菲律宾蛤仔组织解毒代谢酶活力的影响
研究表明,持久性有机污染物(Persistent organic pollutants,POPs)通过Ⅰ相细胞色素P450酶(Cytochromep 450,CYP450)代谢成为更具极性的代谢中间产物进入生物体内,这些代谢产物在Ⅱ相代谢酶谷胱甘肽-S-转移酶等催化下与内源性分子结合,加快了代谢产物排出体外的速度;另一方面在POPs代谢过程中产生大量的自由基,可被体内抗氧化防御系统(如SOD等)清除。
冯涛等[18]和王静等[19]分别对大弹涂鱼(Boleophthalmuspectinirostris)、栉孔扇贝(Chlamysfarreri)解毒代谢酶活力进行研究,发现多环芳烃类(PAHs)可诱导上述两种水产动物组织AHH活力显著升高,并且其变化规律与PAHs暴污浓度呈现明显的剂量-效应关系。吴伟等[20-21]通过鲫鱼(Carassiusauratus)暴露于BDE-47中来研究鱼体的抗氧化防御系统,研究发现鲫鱼肝脏GST活性呈现先增加后减少的变化趋势,而总抗氧化能力(T-AOC)和超氧化歧化酶(SOD)活性随着BDE-47浓度的增加,其活性逐渐降低,说明BDE-47对鱼体造成明显的氧化损伤;吴伟等[22]还对罗非鱼(Oreochromisaurea)肝脏组织非酶类抗氧化剂进行了研究,发现在溴氰菊酯的污染下,罗非鱼肝脏组织GSH含量呈现先增加后减少的趋势,说明溴氰菊酯对罗非鱼抗氧化防御系统产生了影响。因此认为解毒代谢酶活力和抗氧化防御系统可以在环境污染监测体系中起到预警作用。
本实验结果表明,菲律宾蛤仔鳃丝和消化盲囊解毒代谢酶AHH活力对B[a]P污染比较敏感,能够在短时间内被迅速诱导上升,且诱导水平与污染浓度呈现正相关,这个结果和其他研究者在鱼类和栉孔扇贝AHH活力的研究结果相似[18-19,23-24]。而抗氧化防御系统的标志物GST活力、SOD活力和GSH含量,在受低浓度B[a]P污染时,GST和SOD活力首先呈现被诱导升高的趋势,接着受到抑制下降,分别在3 d和6 d达到稳定值,达到平衡以后GST活力与B[a]P的浓度呈负相关,SOD活力最终恢复到对照组水平;GSH含量在一开始染毒就呈现出被显著抑制的趋势,在1 d后达到稳定值,稳定后GSH含量与B[a]P浓度呈现负相关。菲律宾蛤仔鳃丝和消化盲囊AHH、GST、SOD活力和GSH含量对B[a]P污染表现出了较强的敏感性,且变化出现较强的规律性,这显示菲律宾蛤仔解毒代谢酶和抗氧化防御系统的标志物能指示外界B[a]P的污染程度,具有重要的参考意义。
3.2 B[a]P对菲律宾蛤仔组织DNA单链断裂水平的影响
正常的遗传方式下,DNA半保留复制的特性将遗传物质传递给下一代,确保了DNA基因组的稳定性,也确保了有机体的正常新陈代谢和繁殖。但当正常的生长环境被破坏时,例如存在化学诱变物、电离辐射、代谢过程中产生的活性氧自由基或发生光化学反应、氧化还原反应等,生物细胞内的DNA分子可能会被损伤。本实验重点研究了化学物诱导的DNA损伤,化学物进入生物体内,经细胞新陈代谢产生中间产物,与DNA结合形成加合物,导致DNA单链断裂。B[a]P进入生物体,经细胞新陈代谢生成具化学活性中间产物,如二醇环氧化物{B[a]PDE}[25],B[a]PDE可与DNA形成稳定或不稳定加合物,导致DNA链上的碱性不稳定位点,引发DNA链断裂[26]。
本实验采用了碱解旋技术测定了受到不同浓度及时间B[a]P胁迫的菲律宾蛤仔鳃及消化盲囊的DNA单链断裂程度,由实验结果可以看出,B[a]P可诱导菲律宾蛤仔鳃和消化盲囊DNA产生明显的损伤效应,随着B[a]P浓度和染毒时间的增加,F值逐渐减小,即DNA受损伤的程度加深,并表现出较好的时间-剂量效应。因此,作者认为菲律宾蛤仔组织暴露于B[a]P污染物中DNA损伤效应明显,DNA损伤水平可以作为B[a]P污染程度的生物效应指标。
3.3 基于菲律宾蛤仔多环芳烃生物标志物的筛选
近年来,大量的染毒实验证明生物体的某些指标与环境中的污染物呈现较好的敏感性和相关性,因此利用生物体的某些指标来反映污染物污染程度的方法已经得到了广泛的认可和应用。Versteeg等[27]和Cooper等[28]提出了评估生物标志物的14条通用标准;Cheung等[29]将这14条标准进一步简化概括总结为四条:1)生物标志物可以被环境中污染物的实际浓度所诱导;2)生物标志物的变化与不同污染物浓度之间存在明显的剂量效应;3)生物标志物具有稳定性;4)生物标志物不受季节变化的影响。
根据菲律宾蛤仔的解毒代谢过程和B[a]P对机体的毒性效应,本文逐步筛选和分析AHH活力、GST活力、GSH含量、SOD活力和DNA损伤这5项指标。本文前两个讨论结果表明,在外界环境被B[a]P污染的情况下,上述5项指标均被诱导,并呈现时间-剂量效应关系(P<0.05),这一变化情况符合Cheung等[29]所提出的生物标志物的第一、第二两点要求。但海洋环境的多变和生物体自身的复杂,导致单一的生物标志物可能很难准确地评估环境污染程度,因此可以考虑结合两个或三个生物标志物形成综合生物标志物。总结本次研究,依据实验中菲律宾蛤仔两种组织各项解毒代谢酶活力被诱导的情况以及DNA损伤情况,认为可以整合解毒代谢酶AHH活力和DNA单链断裂水平两项生物标志物形成一个组合作为评估B[a]P污染程度的生物标志物,将AHH活力作为防御型生物标志物,DNA单链断裂水平作为损伤型生物标志物,在两个方面、双重保障的情况下对环境中B[a]P的污染程度作出精确地评估,为我国海洋环境中多环芳烃的污染监测提供有效、确实可行的技术支撑。
