基于MALDI-TOF MS与FCM联合应用对临床血流感染病原体鉴定和药敏试验新方法的建立和应用*
2018-08-22谷钰峰张晓录黄葆华孙成铭烟台毓璜顶医院检验中心山东烟台264000
谷钰峰,李 昱,张晓录,黄葆华,孙成铭 (烟台毓璜顶医院检验中心,山东烟台 264000)
血流感染(blood stream infection,BSI)是导致重症疾患病人死亡的最常见原因之一[1],早期、针对性的抗生素治疗可明显提高此类患者的生存率。血培养目前仍然是诊断临床血流感染的金标准,但该方法从培养到鉴定至少需要18~48 h,若再进行药敏试验,则报告的总耗时可能长达36~72 h[2]。因此,改进方法,缩短微生物鉴定和药敏试验的报告时间是传统微生物学检验面临的巨大挑战之一。
近年来,包括基质辅助激光解吸电离飞行时间质谱技术(MALDI-TOF MS)、流式细胞学(FCM)以及高通量测序等技术在临床微生物学领域的应用中得到了迅猛的发展,其中以MALDI-TOF-MS的运用最为广泛[3]。基于不同细菌间存在特异性蛋白质谱峰差异的原理,通过MALDI-TOF MS技术,可以在1 h内完成对血培养阳性标本中高纯度病原菌的鉴定[4]。
由于目前的数据库中尚缺乏耐药性相关蛋白的质谱数据,因此病原体的药敏试验仍依靠传统的纸片扩散法或稀释法来完成。由于其原理是基于微生物的代谢反应,细菌培养的较长耗时仍是不可避免的,因此尚不能满足快速药敏试验的要求[5]。随着流式细胞学(FCM)灵敏度的不断提高,其应用面已从最初的真核细胞免疫表型分析扩展到对原核生物甚至病毒的检测。FCM以其快速、灵敏、多参数等特点,不仅可以将临床药敏的报告时间缩短至3 h以内,而且可对与临床预后紧密相关的病原菌耐药的异质性进行检测[6]。
本研究的目的是通过将MALDI-TOF-MS与FCM联合应用,以创新性的菌体纯化系统为基础开发一套临床血流感染快速诊断的新方法,以达到将病原菌的鉴定和药敏试验报告时间控制在3 h以内的目的。
1 材料与方法
1.1 标本及菌株来源 本研究中所有血培养标本均来自烟台毓璜顶医院微生物检验科,共收集到血培养阳性标本238例。当血培养仪提示标本培养阳性时立即将其取出,进行革兰染色以及常规培养和鉴定程序,并按革兰染色结果将标本分为革兰阳性菌组、革兰阴性菌组以及真菌组。本研究选择了临床常用的抗生素敏感试验明确的标准菌株作为质控菌株,其中包括:粪肠球菌(E.faecalis,ATCC 29212)、金黄色葡萄球菌(S.aureus,ATCC 29213)、大肠埃希菌(E.coli,ATCC 35218)、铜绿假单胞菌(P.Aeruginosa,ATCC 27853)以及大肠埃希菌(E-.coli,ATCC 25922)和本室保存的白假丝酵母菌临床分离株。
1.2 仪器和试剂 流式细胞仪为美国BD公司CantooII型;MALDI-TOF质谱仪购自美国 Bruker Daltonik公司;全自动微生物鉴定和药敏系统为法国生物梅里埃公司VITEK2型。所使用的抗生素标准品来自北京中国药品生物制品检定所;碘化丙啶(PI)及细胞活性染料荧光素二乙酸酯(FDA)等均购自美国Sigma公司。
1.3 方法
1.3.1 常规培养鉴定及药敏试验:当血培养仪提示有阳性出现时,将阳性瓶取出后进行革兰染色以判断病原体的染色性,取适量标本接种于血平板和麦康凯平板上进行培养并采用VITEK2系统及相应的鉴定卡对病原菌进行鉴定和药敏试验。
1.3.2 直接分离胶-吸附法纯化法分离血培养阳性标本中的菌体:用无菌注射器取5 ml阳性血培养物于无菌凝胶分离管中1000 r/min室温离心5 min;吸取上层液体置于吸附柱内,1000 r/min室温离心5 min后将离心管内液体弃去;无菌去离子水洗涤两次后向滤膜上加入100 μl无菌水,混匀后备用。
1.3.3 MALDI-TOF MS鉴定和判定标准:用无菌微量吸头取5μl菌液,滴加于靶板上,自然干燥后覆盖70%的甲酸溶液 5 μl,干燥后再加 5 μl基质液,待再次干燥后即可上机检测。使用配套软件采集并对质谱峰图进行分析,根据制造商提供的结果判定标准,将得分<1.7视为鉴定不可靠(NRI);得分介于1.7~2.0的鉴定可以确认到属;得分>2.0者为极好的鉴定,结果可明确到种。若鉴定得分>1.7时,通过软件提供的微生物列表我们选取第一个微生物作为鉴定结果。
1.3.4 流式细胞学快速药敏试验:取纯化后的菌液50 μl,接种于2 ml LB 培养液内,37℃震荡增菌培养1 h。分别取200 μl增菌培养物置于含有不同抗生素(表1)的LB培养液内。37℃震荡培养2 h后离心。将上清液弃去后,向沉淀中加入PI和FDA染料各4 μl,避光孵育15 min,加入 PBS溶液0.3 ml上机检测。抗生素浓度及折点判读以CLSI 2016版为参考。
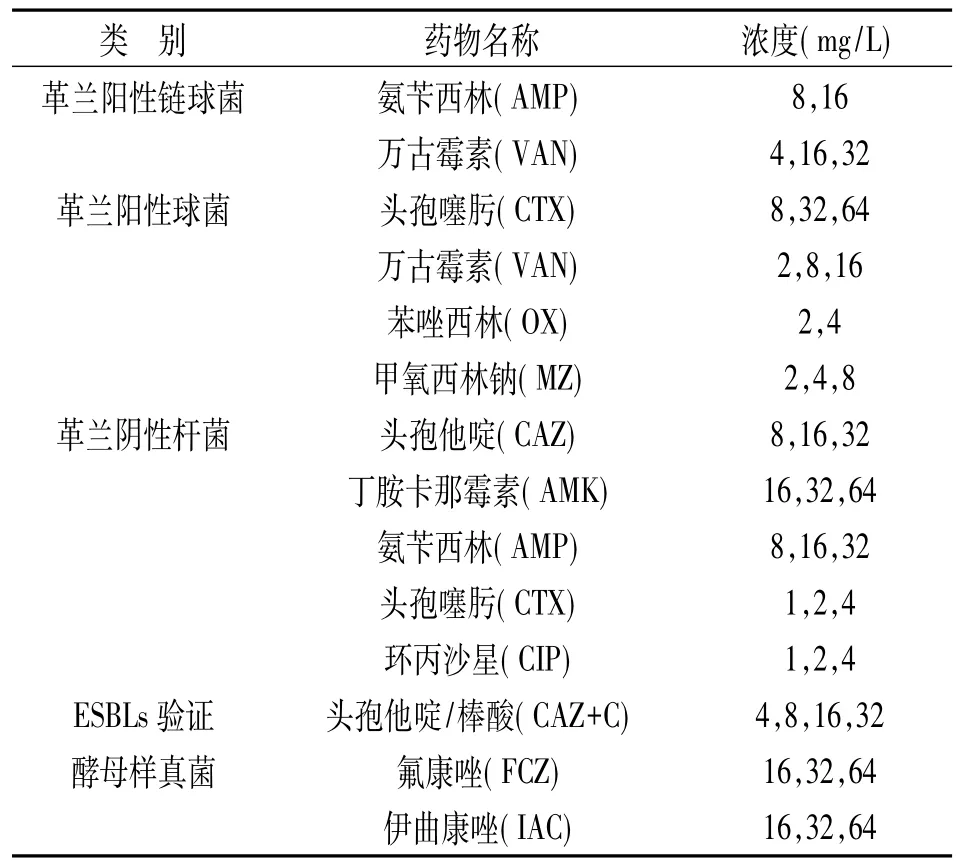
表1 流式细胞学快速药敏试验所涉及到的抗生素及浓度
1.4 统计学分析 本研究的统计学处理采用SPSS 18.0软件完成,采用t检验进行统计学分析。P<0.05为差异有统计学意义。
2 结果
2.1 血培养阳性标本的革兰染色分组 本研究中共收集到血培养阳性标本238例,经革兰染色后进行分组。其中,革兰阳性组76例,均为阳性球菌;革兰阴性组134例,为革兰阴性杆菌;真菌组28例。
2.2 MALDI-TOF MS和VITEK2鉴定结果 见表2。本研究分别采用了 MALDI-TOF MS法和VITEK2鉴定系统两种方法对所分离的238株病原体进行鉴定。结果显示,整体上MALDI-TOF MS法与VITEK2二者的鉴定结果基本相符。238株病原菌的鉴定结果如下:革兰阴性杆菌134株:其中大肠埃希菌32株、肺炎克雷伯菌30株、铜绿假单胞菌21株、产气肠杆菌13株、鲍曼不动杆菌10株、产酸克雷伯杆菌8株、奇异变形杆菌5株、阴沟肠杆菌3株、弗劳地枸椽酸杆菌3株、其他菌9株;革兰阳性球菌76株:其中金黄色葡萄球菌18株、溶血葡萄球菌11株、人葡萄球菌9株、粪肠球菌9株、表皮葡萄球菌8株、模仿葡萄球菌8株、屎肠球菌6株、其他7株;真菌28株:其中白色念珠菌11株、热带念珠菌7株、光滑念珠菌3株、近平滑念珠菌2株、葡萄牙念珠菌1株、克柔念珠菌1株、菌膜念珠菌1株、解脂念珠菌1株、产朊念珠菌1株。对常见细菌而言,两种方法的种鉴定准确率均大于90%。对真菌组,MALDI-TOF-MS法可将75%(21/28)的菌株鉴定到种,VITEK2仅有60%(17/28);在对真菌的鉴定中,VITEK2出现了14%(4/28)的无法鉴定株,而 MALDI-TOF MS的未鉴定率为3%。
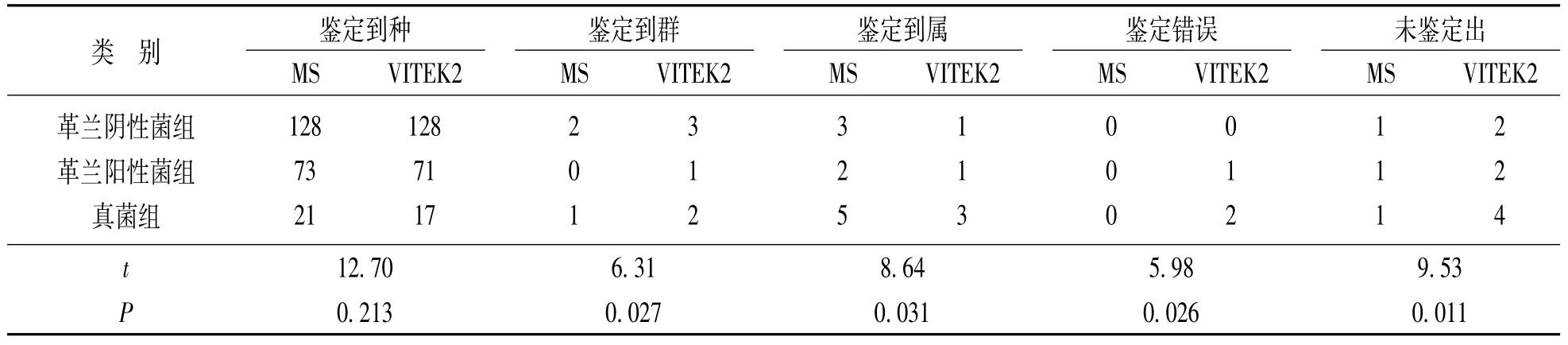
表2 MALDI-TOF-MS法和VITEK2鉴定系统对238株病原菌的鉴定情况
2.3 流式细胞学快速药敏试验结果 本研究采用流式细胞学直接药敏试验法对分离到的238株临床病原菌进行了药敏试验。结果表明,FCM法的快速药敏实验结果与 VITEK2法的结果无明显差异(t=4.30,P=0.127),见表3。部分菌株的流式检测结果见图1。

表3 FCM法和VITEK2系统对238株病原菌进行药敏实验的对比

图1 部分菌株的流式细胞学快速药敏试验结果
革兰阴性菌中有94.7%(127/134)的菌株对氨苄西林耐药,53.7%(72/134)的菌株为产超广谱β-内酰胺酶的菌株。部分耐药菌株的流式细胞学鉴定结果见图2。通过与VITEK2系统的药敏结果进行比对后发现,流式细胞学快速药敏试验结果与其结果完全一致。
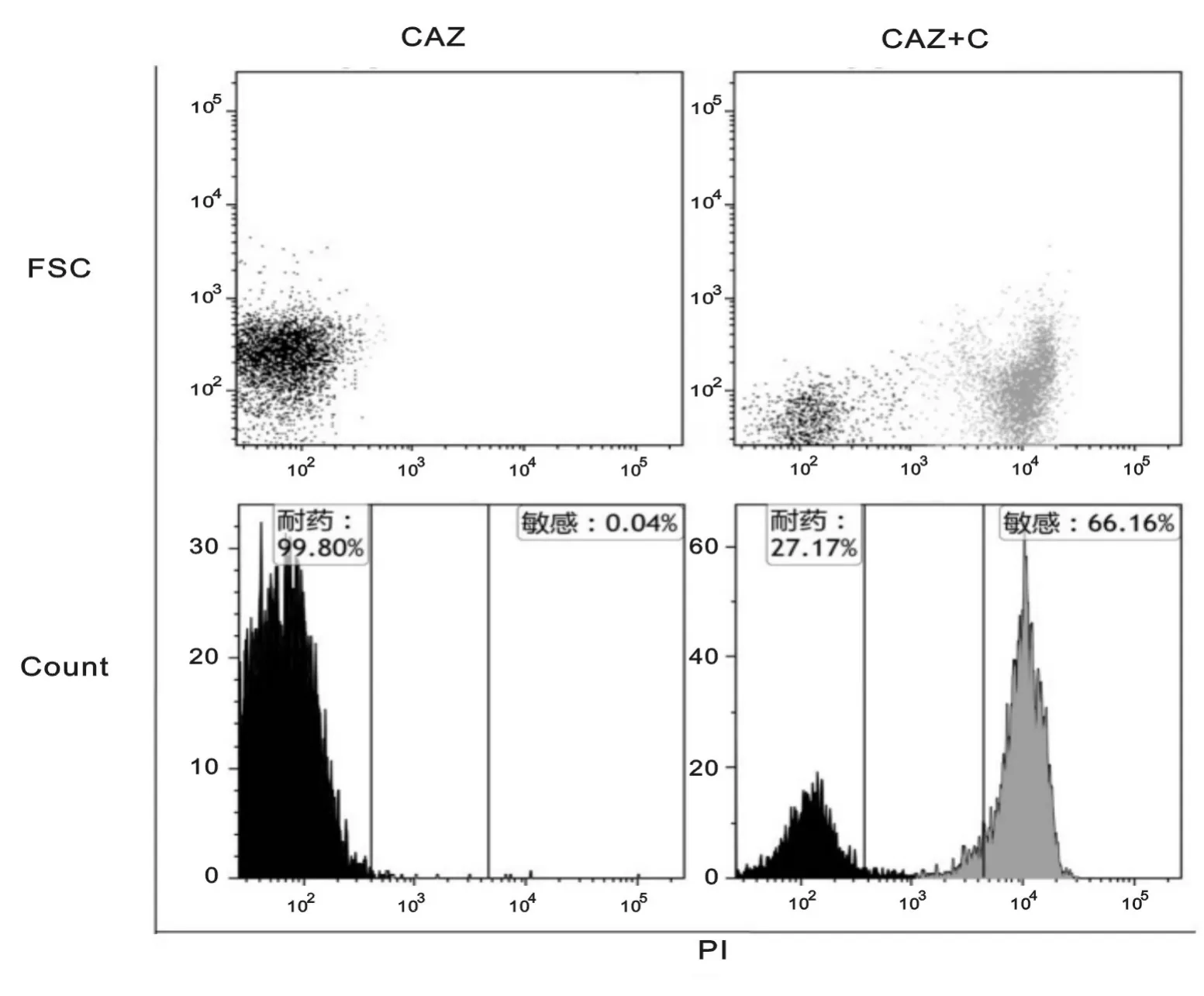
图2 部分产超广谱β-内酰胺酶菌株的流式细胞学药敏鉴定结果
本研究中通过细胞活性染料FDA的加入,我们在5例患者的感染菌群中发现了明显的抗生素敏感异质性,见图3。
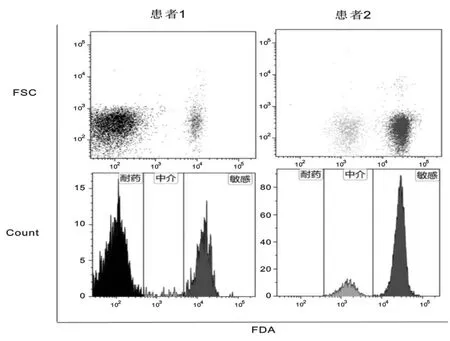
图3 部分菌株的抗生素敏感异质性流式细胞学检测结果
3 讨论MALDI-TOF MS技术的出现为细菌的快速鉴定提供了可靠、高效、廉价的新方法[7]。由于质谱技术对蛋白的丰度和纯度都有较高的要求,因此需要先对培养物中的菌体进行分离,以去除其中的细胞及血浆蛋白对实验结果造成的干扰[8]。本课题先通过分离胶将培养物的细胞组分去除,再将富含菌体的血浆通过吸附膜吸附,最后用去离子无菌水进行洗涤。整个实验过程在一只离心管中进行,且不引入其他裂解剂。通过富集5ml培养物,所得菌体不仅可以满足质谱鉴定的需求,还可以进行流式细胞学快速药敏试验。与目前常见的菌体分离方法如差速离心法、活性剂裂解法和商品化试剂盒等相比,本方法具有省时、高效,不携带裂解剂污染等优点,且废弃物可方便处理、整体成本较低,非常适用于快速诊断。
在本研究中,我们采用MALDI-TOF MS技术对所纯化的238株病原菌进行了鉴定,结果发现与常规鉴定方法相比,二者对常见菌均有大于90%的鉴定到种的能力。MALDI-TOF MS可将75%的真菌菌株鉴定到种而VITEK2仅有60%;且在对真菌的鉴定中,VITEK2出现了14%(4/28)的无法鉴定株,而MALDI-TOF MS的未鉴定率为3%。这表明MALDI-TOF MS可以很好地对各种常见病原体进行鉴定,这与相关报道的结论一致。
流式细胞学(FCM)可通过对微生物的代谢参数如膜的完整性、光散射特性及酶活性的检测从而反映微生物对抗生素的敏感性[9]。该技术不仅具有高效、快速、多参数等特点。本研究通过流式细胞学对分离到的238株临床病原菌进行了药敏试验,结果表明与VITEK2系统的药敏结果几乎完全一致。二者结果间微小差异的产生可能是由于方法学的差异所造成的,此外,细胞活性染料FDA的加入可以很好地发现感染菌群中的耐药异质性,这对于临床具有重要价值。通过FDA的检测结果不仅可以早期对患者体内病原体的耐药性变化进行检测,而且还可以提示临床医师进一步优化抗生素的使用方案[10]。即使是某些MALDI-TOF MS不能得出可靠鉴定结果的罕见微生物的感染,在经过革兰染色后,我们仍然可以采用流式细胞学对病原菌进行药敏试验,并将结果及时告知临床,为临床医生争取宝贵的用药时间[11]。
本研究将MALDI-TOF MS和FCM技术相结合,不仅可应用于血流感染的快速鉴定和药敏分析,更适用于对无菌体液的分析。采用本研究方法,可将微生物报告时间从传统的36~72 h缩短至3 h以内。本研究尚存一定的局限性,比如在FCM法快速药敏试验中,我们涉及的抗生素并不全面,因此还需要进一步探索。
