RI与ANG相互作用对BALB/C裸鼠人膀胱癌移植瘤生长转移及PI3K/AKT/mTOR信号通路的影响*
2018-08-22刘玉林黄晓楠赵琪林胥国强赵明才陈俊霞
刘玉林,黄晓楠,赵琪林,胥国强,赵明才,陈俊霞
(1.遂宁市中心医院检验科,四川遂宁 629000;2.重庆医科大学细胞生物学与遗传学教研室,重庆 400016)
膀胱癌(bladder cancer)是泌尿生殖系统肿瘤最常见的类型之一,发病率逐年增高。目前的治疗方法包括手术、化学疗法、免疫疗法等,但效果不佳,膀胱癌目前仍具有很高的复发率和死亡率[1],因此寻找新的治疗膀胱癌的靶点是当前研究的热点。核糖核酸酶抑制因子(ribonuclease inhibitor,RI)是一种多功能酸性蛋白质,存在于细胞胞浆内,含有460个氨基酸残基,包括32个半胱氨酸残基和15个亮氨酸重复序列(LRRs),不仅是核糖核酸酶A(RNase A)的抑制剂,还可能与血管生成素结合,调节其生物学活性,抑制肿瘤血管生成[2]。血管生成素(angiogenin,ANG)是非常重要的血管生成因子,由147个氨基酸组成,其中编码的蛋白质由123个氨基酸组成,还含有一段信号肽序列,属于 RNA酶超家族的一员,具有弱 RNA酶活性[3]。研究表明,ANG在多种肿瘤中表达升高,与血管生成及肿瘤发生发展密切相关[4]。ANG不仅能促进血管内皮细胞的增殖、侵袭而促进血管生成,还能促进肿瘤细胞增殖,抑制ANG功能可显著抑制肿瘤的生长及恶化[5]。前期研究证明了RI与ANG 在体内存在相互作用[6,7]。然而,RI与 ANG相互作用对膀胱癌移植瘤的生长转移及PI3K/AKT/mTOR信号通路的影响未见报道。为了进一步探讨RI与ANG的相互作用机制,我们通过建立膀胱癌裸鼠移植瘤模型,运用HE染色、免疫组织化学染色、免疫荧光和免疫印迹法检测了通路中的靶蛋白,为膀胱癌的发生、发展及治疗提供理论依据。
1 材料与方法
1.1 实验材料 人膀胱癌BIU87细胞购自南京凯基生物有限公司;BALB/C裸鼠购自北京大学动物实验中心,4~6周龄,体重20±3 g。脂质体 Lipofectamine 2000购自美国Invitrogen公司;ANG单克隆抗体购自英国Abcam公司;多克隆RI抗体本室保存;其余通路蛋白抗体购自美国Bioworld公司;免疫组化相关试剂向中杉金桥购买。
1.2 实验方法
1.2.1 各组稳定细胞株的建立:人膀胱癌BIU87细胞用含10 g/dl胎牛血清的RPMI1640培养液培养,培养条件为37℃,5 ml/dl CO2。待细胞生长至60%左右时,用 Lipofectamine 2000分别转染pIRES2-EGFP-RI(本课题组构建保存),pIRES2-EGFP-ANG,pIRES2-EGFP-RI+pIRES2-EGFP-ANG和pIRES2-EGFP。根据GenBank提供的人RI cDNA序列(NM_002939)设计上游引物:5’-CGGAATTCCTTCACCTCCACCATGAGC-3’;下游引物:5’-GCGTCGACAGGAAGACCTCAGGAGATG-3’;酶切位点为EcoR I和Sal I。ANG cDNA序列(NM_001097577)设计上游引物:5’-CCCAAGCTTATGGTGATGGGCCTGGGCG-3’;下游引物:5’-CGGGATCCGCTGGTTACGGACGACGG-3’;酶切位点为HindⅢ和 BamHI。转染 48 h后加入 600 μg/ml G418培养14天,14天后浓度降为 300 μg/ml,最后挑选阳性克隆即为稳定转染细胞系,分别命名为BIU-87+RI,BIU-87+ANG,BIU-87+ANG+RI和 BIU-87+空质粒组。
1.2.2 建立BALB/C裸鼠移植瘤模型:收集各组处于对数期的 BIU-87+ANG,BIU-87+RI,BIU-87+ANG+RI和BIU-87+空质粒组细胞,PBS重悬并计数,细胞数量为2×107/ml。裸鼠购自北京大学动物实验中心,4~6周龄,体重20±3 g。培养稳定转染的各组细胞,待长到对数期时收集细胞并计数,每只BALB/C裸鼠注射0.1 ml约含2×106个细胞,随时观察裸鼠状态及实体瘤形成情况,一个月后脱颈法处死裸鼠,手术取出实体瘤瘤体称量并记录数据。4 g/dl多聚甲醛固定液固定部分实体瘤组织标本和肺样本,余下部分置于液氮中保存后续做冰冻切片。
1.2.3 苏木精-伊红染色(HE染色)和免疫组织化学:肿瘤组织用石蜡包埋固定,切片机4 μm切片,先用二甲苯再用系列梯度乙醇(70,80,90,95,100 ml/dl酒精)脱蜡,流动水轻轻冲洗,去出残余试剂。切片置于苏木精中染色5 min,流动水轻轻冲洗,1 ml/dl盐酸乙醇分化30 s,流动水轻轻冲洗,然后伊红染色 5 min,系列梯度酒精(70,80,90,95,100 ml/dl酒精)脱水,通过二甲苯 3次,每次 1 min,最后滴加中性树胶,将有细胞的一面向下固定于载玻片上,显微镜观察拍照。
1.2.4 免疫组织化学和免疫荧光:石蜡包埋固定后的肿瘤组织,4 μm切片;60℃恒温烤箱烘烤30 min脱蜡,二甲苯Ⅰ和二甲苯Ⅱ各处理10 min。乙醇梯度脱水5 min,脱水后蒸馏水洗3次,共6 min,用0.3 ml/dl Triton X-100进行通透8 min,PBS洗涤3次去除残留试剂。每组切片用3 ml/dl H2O2溶液和枸橼酸钠缓冲溶液(pH=6.0)抗原修复处理。37℃恒温生化培养箱静置30 min后,滴加一抗 RI,ANG,p-mTOR,p-AKT,p-GSK3β,稀释比例RI为1∶200,其余均为1∶100,注意将抗体滴在组织样本处,水平放置于湿盒中4℃过夜孵育。苏木素复染视情况而定,中性树胶封片,正置显微镜观察拍照。冰冻切片10 μm切片,固定30 min,室温自然风干,-80℃保存备用。PBS洗涤15 min,0.1 ml/dl Triton X-100通透10 min;5 ml PBS洗涤3次,每次5 min。用3 ml/dl H2O2除去内源性过氧化物酶使其失活;37℃,3 g/dl BSA封闭非特异性位点;然后加一抗,CD31 1∶50稀释,RI 1∶200稀释,兔抗 p-Akt(S473),p-mTOR,p-GSK 3β(S9)和ANG均1∶100稀释,放置于湿盒中4℃孵育过夜;PBS脱色摇床上洗涤3次,每次10 min。山羊抗兔IgG(Alexa Fluor 594)和山羊抗鼠IgG(Alexa Fluor 488)均1∶100稀释后,37℃避光孵育1 h;最后用PBS洗涤去除未结合抗体;滴加抗荧光淬灭剂封片,荧光显微镜下观察表达情况。
1.3 统计学分析 每组实验重复三次,实验结果使用SPSS19.0软件进行分析。用t检验进行两组间的差异分析,以P<0.05为差异有统计学意义。
2 结果
2.1 共表达RI与ANG抑制BALB/C裸鼠移植瘤生长、转移及微血管生成 注射各组细胞的BALB/C裸鼠在动物实验中心培养7天后有实体瘤形成,培养一月后脱颈法处死小鼠,手术取出实体瘤瘤体并用电子称称重,记录各组数据。结果表明,BIU-87+ANG组实体瘤瘤体重量最重,BIU-87+RI组与BIU-87+ANG+RI组与对照组相比明显更轻,两者差异具有统计学意义(P<0.05),(图1AB)。过表达ANG表明有更高的肺部转移,但过表达RI组与RI和ANG共表达组肺部转移明显减少(图1 C,D)(P<0.05)。常规石蜡切片HE染色检测血管标志物 CD31,BIU-87+ANG组高表达CD31,BIU-87+RI组CD31信号较弱,微血管密度比BIU-87+ANG+RI组少,差异具有统计学意义(P<0.05)(图 1E,F)。
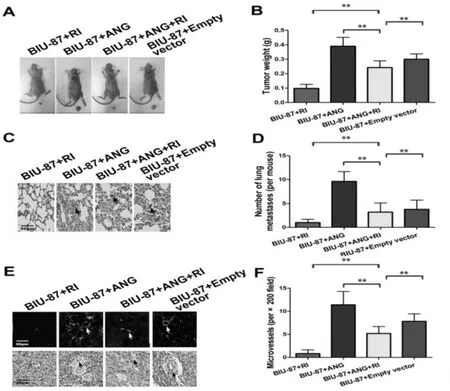
图1 共表达ANG与RI对肿瘤生长、转移和BALB/C裸鼠肿瘤微血管生成的影响
2.2 RI与ANG相互作用影响PI3K/AKT/mTOR信号通路中磷酸化蛋白水平 免疫组织化学(IHC)和组织免疫荧光(IF)结果显示,BIU87-ANG组荧光强度高,表明p-Akt,p-GSK3β和p-mTOR高表达。p-Akt和p-PI3K棕染,BIU87+RI组与BIU-87+ANG+RI相比则表达明显减弱(图2A,B)。结果表明,RI与ANG的相互作用可以调控PI3K/AKT/mTOR信号通路。
2.3 RI调控ANG介导的PI3K/AKT/mTOR信号通路 为了探讨RI与ANG相互作用潜在的作用机制,我们检测了PI3K/AKT/mTOR信号通路中的相关靶蛋白,使用BIO-RAD软件进行半定量分析结果表明通路蛋白中非磷酸化蛋白表达量无变化,差异无统计学意义。BIU87+ANG组中p-mTOR,p-PI3K,p-Akt和p-GSK3β 表达升高,而BIU87+RI组和BIU-87+ANG+RI组表达下降(图3A,D)。
3 讨论蛋白与蛋白相互作用在生命进程中扮演着非常重要的角色。核糖核酸酶抑制因子(RI)属于酸性胞质蛋白,其独特的结构和功能致使其成为亮氨酸残基重复序列(LRRS)研究的中心蛋白质[8]。前期研究表明,RI表现出强烈的肿瘤抑制作用,能抑制某些肿瘤的生长及转移和肿瘤微血管生成[9,10]。血管生成素(ANG)是一种重要的血管生成因子,在许多癌症组织中高表达。在ANG的123个残基蛋白质中包含许多重要的生物活性位点,比如核转位序列(NLS)、核受体结合位点、ribonucleolytic活性位点等,此类位点可能与ANG的未知生物功能相关[11]。ANG的重要生物学功能就是促进肿瘤血管生成和肿瘤细胞增殖,是促进体内血管生成的潜在因素。ANG可通过AKT/PI3K/mTOR信号通路刺激核糖体RNA转录和核糖体生物合成。ANG在癌症发生发展中的双重作用表明它将在癌症治疗中发挥重要作用。

图2 过表达RI调控ANG促PI3K/AKT/mTOR信号通路磷酸化作用水平
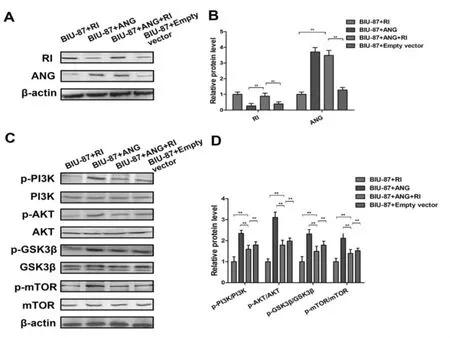
图3 过表达RI调控ANG激活PI3K/AKT/mTOR信号通路
前期实验证实了过表达RI通过抑制ANG和ILK/PI3K/AKT信号通路可以抑制黑色素瘤B16细胞和 B16-F10细胞的生长和凋亡[12]。随后发现,在体内外上调RI可以降低通过ANG引起的p-PI3K,p-AKT,p-GSK-3β和 p-mTOR 蛋白的水平。下调ANG基因的表达能显著抑制膀胱癌移植瘤生长,并通过降低 CD31,p-AKT,p-GSK-3β 和 pmTOR表达抑制膀胱癌BALB/C裸鼠移植瘤增殖及转移的潜能[13]。PI3K/AKT/mTOR信号通路可以调节细胞增殖、分化、细胞代谢、细胞凋亡和肿瘤细胞生存[14]。研究表明ANG和AKT通路之间有一个交互应答,ANG可激活AKT,而AKT的激活又能促进ANG的核转位。mTOR作为AKT下游的一个效应器,AKT能直接激活mTOR的磷酸化。ANG诱导AKT的磷酸化形成,该过程可促进伤口愈合和鸡胚绒毛尿囊膜血管的生成,ANG不仅能促进PKB/AKT磷酸化并激活PKB传导通路,抑制上皮细胞凋亡,还能使GSK-3β和mTOR蛋白磷酸化,磷酸化可抑制其作用。本研究通过RI与ANG的相互作用研究表明,BIU87+ANG组中p-mTOR,p-PI3K,p-Akt和 p-GSK3β表达升高,而BIU87+RI组和BIU-87+ANG+RI组表达下降,证实其相互作用能通过降低信号通路关键蛋白的磷酸化蛋白的表达来抑制膀胱癌BIU87细胞增殖和血管的形成,抑制BALB/C裸鼠移植瘤的生长、转移,为进一步研究RI与ANG相互作用在膀胱癌中的分子机制提供实验依据。
