表面增强拉曼光谱技术检测隐球菌脑膜炎患者血清中CD93+外泌体及其意义*
2018-08-22李腾达龙曙萍黄元兰张薇薇谷明莉邓安梅
李腾达,刘 鹏,龙曙萍,刘 云,黄元兰,张薇薇,郭 杰,谷明莉,邓安梅
(1.第二军医大学长海医院,上海 200433;2.解放军455医院,上海 200052)
新生隐球菌是一种普遍存在的机会性致病真菌,其常侵犯免疫力低下的人群如HIV感染者、肝癌患者等造成病人的肺部或脑膜感染[1]。目前诊断隐球菌脑膜炎的方法中印度墨汁染色法在脑脊液真菌量小于1000 CFU/ml时灵敏度显著下降,易漏诊早期病患;真菌培养至少需1周时间才能得到可靠结果,结果的主观影响因素较大;病理学方法是隐球菌脑膜炎的确诊性实验,但其取样困难,易与免疫缺陷造成的假性肉芽肿混淆[1]。基于现有隐球菌脑膜炎的诊断状况,发展一种高灵敏度和相对特异度的检测手段,对于该病的早期诊断、提高病人术后预后有重要意义。
表面增强拉曼光谱技术(surface-enhanced raman scattering technology,SERS)是一种由于非规则检测表面等离子激活致电磁场变化而产生的增强拉曼信号技术,具有灵敏度高、检测限低等特点[2]。随着外泌体等液态活检技术的兴起,SERS亦被用于该领域的检测,研究表明SERS技术可动态观察SKOV3细胞系来源外泌体在干燥过程中内容物的变化[3],亦可用于对结肠癌细胞系和健康细胞来源的外泌体进行定性和定量[4],该类研究证明了SERS用于外泌体检测具有灵敏度高等优势。为进一步提高隐球菌脑膜炎检测的特异度,本实验结合前期对CD93+外泌体在隐球菌脑膜炎血清中显著增高的研究发现,利用SERS技术对其进行高灵敏度检测,以优化隐球菌脑膜炎的疾病检测手段,辅助临床对该病的诊断。
1 材料和方法
1.1 研究对象 以38例2013年12月~2017年3月在上海长海医院和长征医院确诊的隐球菌脑膜炎患者血清作为实验组,诊断标准为脑脊液染色新生隐球菌阳性或培养阳性,患者男性14例,女性24例,中位年龄为39.7±6.3岁。健康对照组为同期体检的38例血清标本,男女比例为8∶11,中位年龄为40.1±6.7岁,实验组与对照组年龄及性别差异无统计学意义(P>0.05)。本研究经第二军医大学长海医院医学科研伦理委员会批准,所有受试对象均签署知情同意书。
1.2 试剂与仪器 抗体(美国 Abcam公司),HAuCl4·3H2O及对氨基巯苯酚(PATP)等(美国Sigma-Aldrich公司),SM3-P100磁珠(Alrun Nano Science&Technology公司),ELISA试剂盒(Thermo公司),超速离心机(HITACHI公司),拉曼光谱仪(法国Horiba Jobin Yvon公司),纳米颗粒追踪分析仪 (英国Malvern Company)。
1.3 方法
1.3.1 受试对象血清收集:将研究对象非抗凝血于采集后1~2 h内进行2500×g,10 min分离,或置于室温自然搁置形成血清,将形成的血清于-80℃保存待用。
1.3.2 血清外泌体的分离:将患者血清经0.2 μm过滤器过滤,用PBS稀释到适合浓度后于2000×g,离心20 min,收集上清,经0.2 μm 过滤器过滤,于120000×g,离心3 h,收集沉淀,用PBS重悬后重复离心后再次收集沉淀,以PBS重悬待测。
1.3.3 纳米追踪分析进行外泌体定量:将待检测的外泌体用PBS稀释到适宜浓度,经0.22 μm过滤器过滤,取1 ml进行外泌体定量,仪器相关参数:激光为Blue 488,检测阈值为3,温度为22.9℃~23.1℃。实验重复五次,取均值计算小于200 nm的外泌体的浓度。
1.3.4 SERS探针的合成及检测前样品制备:用传统的Fren’s方法合成16 nm金纳米颗粒约600 μl,在该体系中加入 100 μl Tris-HCl(50 mmol/L/,pH8.5),100 μl 50 μmol/L PATP 水溶液,1 mg/dl BSA溶液反应30 min后进行离心(6000 r/min,20 min)分离沉淀,用PBS重悬,加入抗体孵育2 h将抗体连接到材料上。每个血清标本分离得到的外泌体溶液取20 μl,利用磁珠连接的抗体进行捕获,捕获得到的外泌体用以上相应抗体标记的材料进行标记及SERS信号检测。
1.3.5 ELISA试剂盒检测细胞因子:按照ELISA试剂盒操作说明检测血清中TNF-α,IFN-γ等因子的表达情况。
1.4 统计学分析 本研究中两连续计量资料的比较采用两独立样本t检验,两变量之间的相关性用Pearson系数表示,检验水准α为0.05,线性拟合采用 Origin软件进行,统计分析软件为 Graph Prism 6.0。
2 结果
2.1 两组间血清外泌体表面蛋白SERS检测信号的比较 首先在10例实验组与10例对照组血清外泌体中检测CD93,CD9及CD63等外泌体表面蛋白的SERS信号,结果显示以CD93为靶点的SERS信号在实验组与对照组血清外泌体中分别为3789.45±267.76 vs 676.98±107.76,差异具有统计学意义(t=34.10,P<0.0001)。而CD9在实验组与对照组 SERS信号强度分别为 1563.78±432.98 vs 1478.09±488.17(t=0.4153,P=0.6828),CD63 分别为 2193.53±298.06 vs 1987.93±301.87(t=1.533,P=0.1428),差异均无统计学意义。见图1。
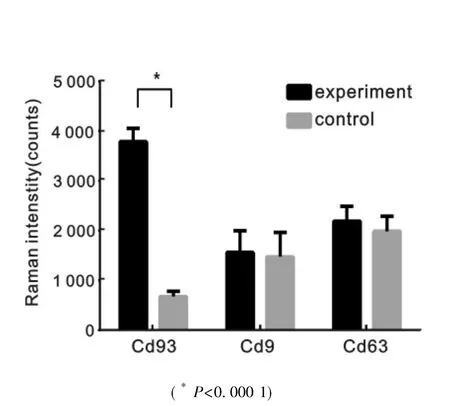
图1 两组间血清外泌体表面蛋白SERS检测信号的比较
2.2 SERS检测实验组血清CD93+外泌体的标准曲线 取三例实验组血清约2 ml进行外泌体分离,用nanosight对外泌体原始溶液浓度进行定量,调整其浓度均为5.50×108个/ml。以抗 CD93抗体标记的纳米材料对实验组不同浓度的外泌体进行标记,并观测其SERS信号。将外泌体浓度与SERS信号强度分别取对数值后进行相关性分析,结果显示,随着外泌体浓度的增加,SERS信号亦增加,线性拟合方程为Y=(1.3186±0.0501)+(0.2765±0.00788)X,差异具有统计学意义(R=0.99596,P<0.0001)。最低检测的外泌体浓度为5500个/ml,本实验滴加的稀释液为20 μl,故其最低检测限的外泌体约为110个/ml,见图2。
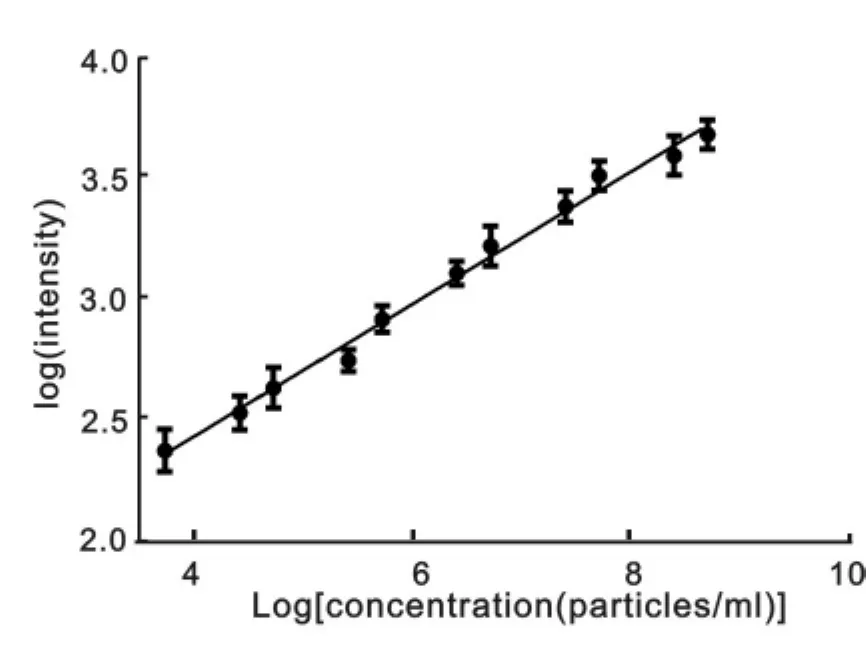
图2 SERS检测实验组血清CD93+外泌体的标准曲线
2.3 实验组与对照组血清CD93+外泌体的log(SERS信号) 利用该体系检测38例实验组与对照组血清CD93+外泌体的SERS信号,并取对数值。实验组为 2.75±0.59,对照组为 2.47±0.15,差异具有统计学意义(t=2.835,P=0.0059)。
2.4 该检测方法与ELISA法的相关性分析 用传统ELISA法检测实验组血清中IFN-γ与TNF-α的结果分别为 209.54±56.90 pg/ml,468.98±102.76 pg/ml。拉曼光谱仪检测实验组血清中纳米材料标记的CD93+外泌体的log(SERS信号)值与ELISA检测得到的IFN-γ,TNF-α结果进行相关性分析,结果表明该检测方法得到的结果与IFN-γ,TNF-α的ELISA结果呈正相关,差异具有统计学意义(r=0.389,0.478,P<0.05)。
3 讨论新生隐球菌是一种广泛分布于外界环境的哺乳动物机会性致病菌,在人体免疫力低下时,其可侵入人体致病人颅脑感染,形成隐球菌脑膜炎[5]。目前辅助隐球菌脑膜炎诊断的方法有染色法、影像学、分子诊断技术以及病理组织学检查等,但此类方法亦存在一些不足:如印度墨汁染色法对于真菌负荷小于1000 CFU/ml的情况,其灵敏度会显著下降;CT及MRI等影像学方法较难发现隐球菌脑膜炎颅脑部病变早期病灶;PCR等分子生物学方法检测时间长(2~3天),需专业人员操作;脑脊液乳胶凝集实验在类风湿因子存在的情况下会出现假阳性结果,难以区分死亡病菌与活菌;病理组织学方法取样困难,对患者颅脑损伤大,易与免疫缺陷造成的假性肉芽肿混淆;LFA虽然相比较于传统检测手段其灵敏度和特异度有所提高,但其检测限有待进一步提高[1]。现有检测方法的不完善使得隐球菌脑膜炎发现时间延后,造成患者预后差,因此发展一种灵敏度高、检测时间短、特异度较高的隐球菌脑膜炎检测方法具有重要意义。外泌体是一种胞外囊泡,高表达CD9,CD63等分子,直径50~180 nm,被视为细胞的“指纹印记”,其可由一种细胞分泌后作用于临近细胞影响其功能的表达,亦可随血液、淋巴液等作用于远端脏器,是一种颇具价值的疾病监测指标[6,7]。近来有报道称SERS技术可检测SKOV3细胞系来源的外泌体,并且可以在单个外泌体层面上对其干燥过程中内容物的变化进行监测[3];亦有研究表明利用金纳米颗粒对红细胞和胶质瘤细胞来源的外泌体进行标记,得到的外泌体溶液具有很好的单分散性、均一性,有利于实现对外泌体良好的观测[6]。本课题前期对隐球菌脑膜炎外周循环外泌体的研究表明,CD93+外泌体在患者血清中表达丰富,且与疾病发生发展可能存在相关性,基于此,我们以外泌体CD93为标志物并结合SERS技术对隐球菌脑膜炎血清中的外泌体进行检测,结果表明SERS能够检测到的外泌体的最低量为110个/ml,隐球菌脑膜炎患者血清用量为20 μl,相比较于传统的 ELISA检测法显著降低了临床标本用量,进一步对不同浓度的实验组血清CD93+外泌体进行检测,结果表明log(SERS信号)与log(外泌体浓度)有较好的线性关系,且该方法检测实验组血清标本的结果与ELISA试剂盒检测的TNF-α,IFN-γ结果呈正相关,这就为其应用于临床研究奠定了理论基础。但本实验标本量有待进一步扩大,SERS检测体系有待进一步优化以降低检测限,实现微量检测和无创液态活检,从而减轻病理诊断给患者造成的痛苦。
