水苏糖对圈养猕猴肠道菌群及血液生理生化指标的影响
2018-08-21杨世丽李海芳陈科元陈小丽唐耀马燕梅
杨世丽李海芳陈科元陈小丽唐耀马燕梅
(1.福建农林大学动物科学学院,福州,350002;2.福建省福州动物园,福州,350012)
动物肠道菌群在长期的进化过程中已经演变为机体的正常组成部分,它们与宿主保持着紧密联系,机体对其不产生免疫反应(免疫耐受),处于动态平衡状态,这种平衡与宿主的多种生理功能密切相关,如促进宿主肠道发育[1],参与宿主的营养和代谢[2-3],具有免疫屏障功能[4-5],还与延缓宿主衰老、抵抗肿瘤发生、预防肠道疾病等有复杂紧密的联系[6]。肠道菌群组成复杂,数量庞大,研究得较多的是作为益生菌的双歧杆菌(Bifidobacterium)和乳酸杆菌(Lactobacillus),通过添加益生菌活菌制剂或益生元制剂等以增加肠道益生菌的数量或促进益生菌的生长[7-8],其中益生元制剂与非消化性低聚糖(NDOs,non-digestible oligosaccharides)的协同作用成为人们的研究热点。
非消化性低聚糖是一类促双歧杆菌生长因子,由于其经济且适用性强,被较广泛地应用于改善消化道机能[9]。水苏糖是一种四碳糖,存在于地灵、豆类之中,其分子结构为果糖-葡萄糖-半乳糖-半乳糖,相对分子量666.59 g/mol,分子式为C24H42O21,分子间主要以β-1,4糖苷键相连,属于非消化性低聚糖。由于哺乳动物自身胃肠道产生的消化酶系只能降解α-1,4糖苷键,因此水苏糖经过胃和小肠时可保持结构完整,到达结肠后可被双歧杆菌属及少数乳酸杆菌的酶系统分解,为这些菌的增殖提供能量,同时其酵解终产物为短链脂肪酸,可降低肠道pH,具有促进有益菌增殖和抑制有害菌繁殖的作用,对机体的生理功能也有重要影响[10-11]。
猕猴(Macacamulatta),别名猢猴、黄猴、沐猴、恒河猴、广西猴,在动物分类学上隶属于哺乳纲,灵长目(Primates),猴科(Cercopithecidae),猕猴属。由于圈养环境的饲养管理方式与野外环境大不相同,同时存在少数游客不文明的投食行为,可能造成猕猴出现营养不均衡,肠道菌群失调的现象[12]。本试验通过给福州动物园兽类表演场的猕猴饲喂水苏糖,检测其粪便菌群(双歧杆菌、乳酸杆菌和大肠杆菌Escherichiacoli等)数量的变化,研究水苏糖对双歧杆菌、乳酸杆菌的增殖作用及对大肠杆菌的抑制作用,分析水苏糖改善肠道微生态及促进机体健康等方面的作用。
1 材料和方法
1.1 试验动物及分组
将福州动物园兽类表演场圈养的15只猕猴,分为对照组和试验组,每组分为幼年组(年龄1.5~5岁,体重1.5~4 kg)、成年组(年龄6~15岁,体重4~15 kg)和老年组(年龄15~25岁,体重8~15 kg),对照组每组2只,试验组每组3只。参照人类水苏糖的最佳口服剂量,给幼年组、成年组和老年组每天分别饲喂0.63 g、 0.85 g和1.26 g的水苏糖(纯度80%,购自河南德大化工有限公司)。对照组为空白组,不饲喂水苏糖。饲养试验为期6 周。为确保试验的准确性,采样前3个月未向动物饲喂或注射任何可能对肠道菌群结构造成影响的药物及添加剂。
1.2 粪便样品的收集及处理
每个个体分4次采集粪便样品,每间隔2周采集1次。所有样品在动物每次排便后30 min内采集,采集过程严格执行无菌操作,并用无菌采样袋收集,标记后立即置于采样箱(内置干冰)中保存,1 h内送至实验室,-80℃超低温冰箱保存备用。
1.3 粪便样品细菌DNA提取
将冻存的每个个体的4次采集的粪便样品,分别取200 mg作为检测样品并编号。提取步骤参照粪便基因组DNA提取试剂盒(购于天根生化科技(北京)有限公司)的操作说明书进行,最后用40 μL的EB溶液将DNA从吸附柱中洗脱,置-20℃冰箱保存备用。
1.4 双歧杆菌、乳酸杆菌及大肠杆菌qPCR定量分析
以提取的灵长类动物粪便基因组DNA样品为模板,利用2×TaqMaster PCR Mix进行PCR扩增 16S rRNA 目的基因片段。引物序列见表1。
表1 PCR引物序列
分别将双歧杆菌、乳酸杆菌和大肠杆菌的PCR扩增产物,以1.2%琼脂糖凝胶125V电泳30 min,用凝胶成像系统进行成像,切下目的片段,应用琼脂糖凝胶回收试剂盒回收,操作步骤参照试剂盒使用说明。回收后取1.5 μL纯化产物于NanoDrop-2000检测所提DNA浓度,计算目的片段拷贝数,作为双歧杆菌、乳酸杆菌和大肠杆菌的标准品,置-20℃冰箱保存备用。
拷贝数计数公式:
拷贝数=阿伏伽德罗常数×片段浓度/片段分子量
即:copy number(copies·μL-1)=(6.02×1023×(ng·μL-1×10-9)/(DNA length×660)
将已制备的双歧杆菌、乳酸杆菌和大肠杆菌标准品绘制扩增标准曲线,对未知样品进行qPCR定量分析。
1.5 血液样品采集及分析
在试验6 周结束前后对猕猴进行血样采集,采血前禁食12 h,采血时间为9:00 。从猕猴前肢肘中静脉采集血样,其中2 mL 抗凝血用于测定血常规,4 mL血液分离血清测定血清生化值,并用全自动血细胞分析仪和全自动生化分析仪检测猕猴血液生理生化指标。
1.6 数据统计与处理
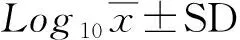
2 结果与分析
2.1 水苏糖对猕猴肠道菌群结构的影响
2.1.1 水苏糖对猴肠道双歧杆菌的影响
表2结果表明,饲喂水苏糖的猕猴的肠道双歧杆菌数量极显著的提高,空白组双歧杆菌数量未见明显变化。在添加水苏糖过程中,试验组猕猴粪便中双歧杆菌的数量第2 周时较添加前增加了4~8倍,第4 周增加了8~10倍,第6 周增加了8~13倍。0~2周双歧杆菌快速增长,2~4 周较快增长,但增长趋于缓和。不同年龄组趋势相似。总体来说,水苏糖对猕猴肠道菌群的增长速率在2~3 周达到最大值,数量增加10倍以上,3~6周双歧杆菌增势放缓,数量趋于稳定,达到109数量级。
2.1.2 水苏糖对猕猴肠道乳酸杆菌的影响
表3结果分析可知,试验组0~6 周乳酸杆菌数量差异明显。总体来说乳酸杆菌增加了2~4倍。空白组乳酸杆菌数量无明显变化。
2.1.3 水苏糖对猕猴肠道大肠杆菌的影响
表4结果表明,试验组0~6 周大肠杆菌数量减少极显著。与添加水苏糖前对比,试验组大肠杆菌降低了4~8倍。空白组试验期间未见明显变化。
2.1.4 水苏糖对猕猴粪便外观变化的影响
试验期间观察猕猴粪便外观形状的变化(图1),由饲喂水苏糖6周前后的对比结果可知,猕猴粪便的形状、颜色、水分含量均有明显的变化。未饲喂水苏糖前,有的猕猴排便次数多、粪便不成形以及部分猕猴肛周有粪便,有的猕猴排便次数少、排便困难、粪便干结甚至有便秘现象。试验过程中这些情况逐渐改变,试验结束时猕猴排便正常,粪便外观黄色,呈疏松条状。这些改变都表明猕猴肠道功能得到了改善。
表2 粪便双歧杆菌qPCR检测结果

Tab.2 Bifidobacterium qPCR test results in the fecal
注:同行肩标相同小写字母者差异显著(P<0.05),同行肩标相同大写字母者差异极显著(P<0.01)。下同
Note:The same lowercase superscript letters mean significant difference in the same line(P<0.05),and uppercase letters indicate very significant difference(P<0.01).The same as below
表3 粪便乳酸杆菌qPCR检测结果

Tab.3 Lactobacillus qPCR test results in the fecal
表4 粪便大肠杆菌qPCR检测结果
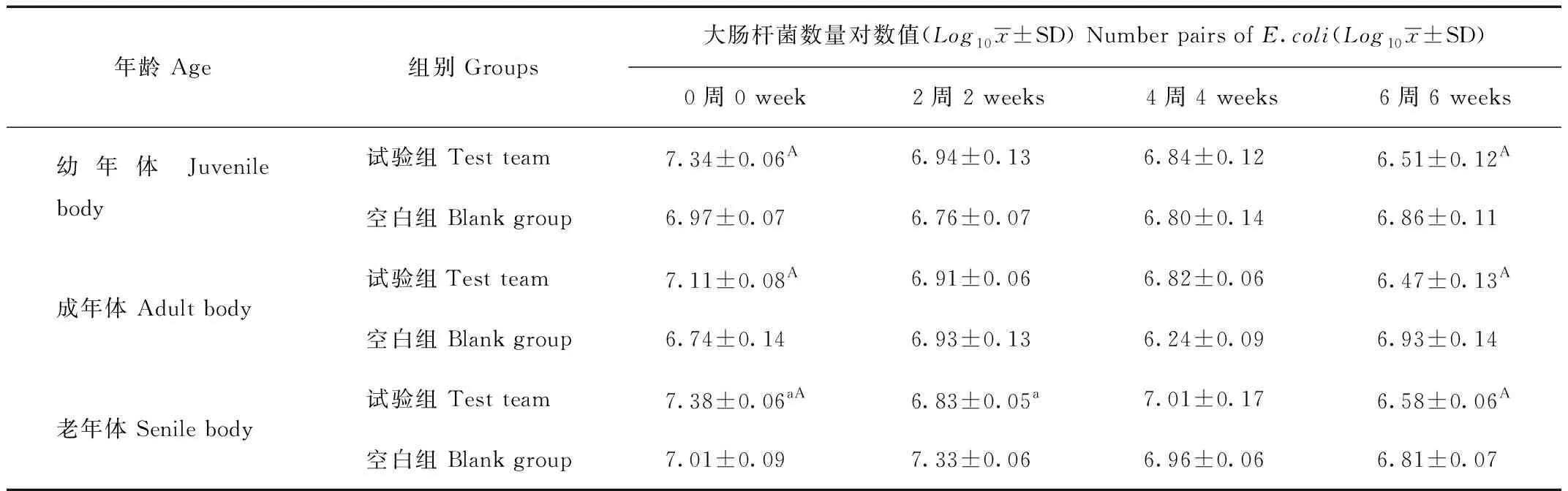
Tab.4 E.coli qPCR test results in the fecal

图1 猕猴粪便外观Fig.1 Macaques feces appearance(a.Before the test;b.After the test)
2.2 水苏糖对猕猴血液生理生化指标的影响
2.2.1 水苏糖对猕猴血细胞含量的影响
由表5得出,在给猕猴饲喂水苏糖后,猕猴血液红细胞、淋巴细胞有显著增加(P<0.05)。其他指标都有少许增加(单核细胞减少外),但差异不显著(P>0.05)。
表5 猕猴血细胞含量

Tab.5 Cell levels in macaque blood
2.2.2 水苏糖对猕猴血液肝功能生化指标的影响
由表6得出,在水苏糖添加前后猕猴血液总蛋白、白蛋白、腺苷脱氨酶和血钙等指标有显著提高(P<0.05)。谷丙转氨酶含量减少极显著(P<0.01)。血清总胆红素、间接胆红素、谷草转氨酶及碱性磷酸酶都有减少,但差异不显著(P>0.05)。
表6 猕猴血液肝功能生化水平
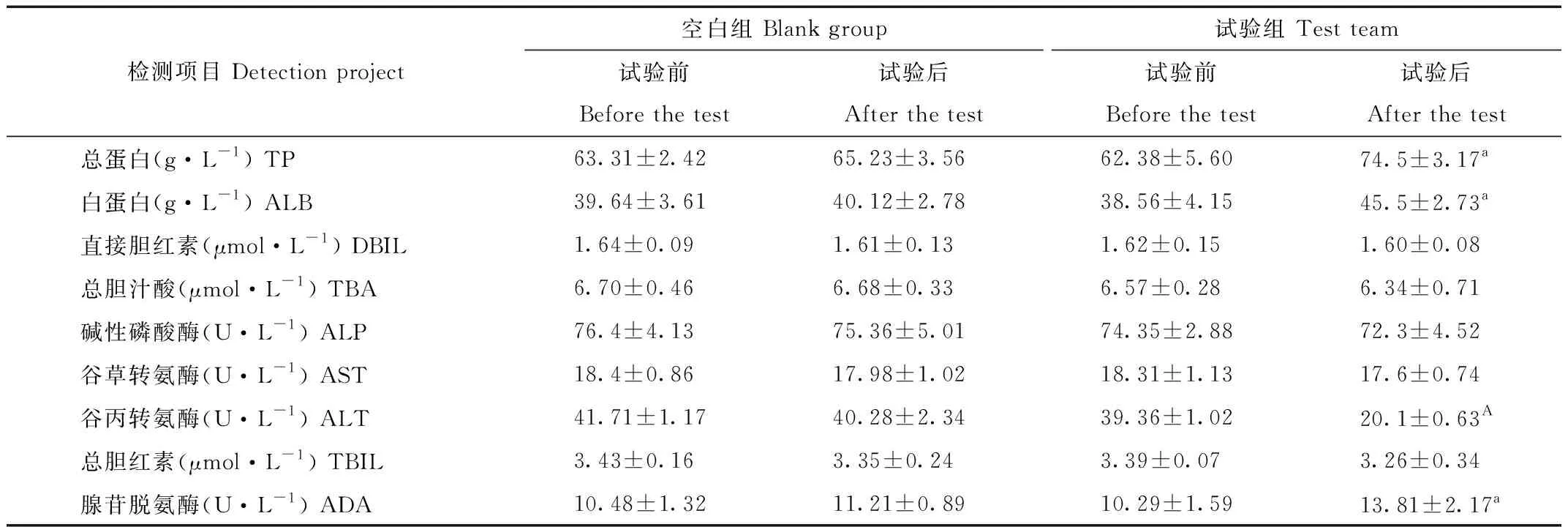
Tab.6 Liver function biochemical levels in macaque blood
2.2.3 水苏糖对猕猴血液肾功能指标及离子的影响
由表7得出,在水苏糖添加前后猕猴血液尿素含量降低极显著(P<0.01),且钙含量显著升高(P<0.05)。镁、磷及K+、Na+、Cl-无显著变化(P>0.05)。
表7 猕猴血液肾功能生化水平
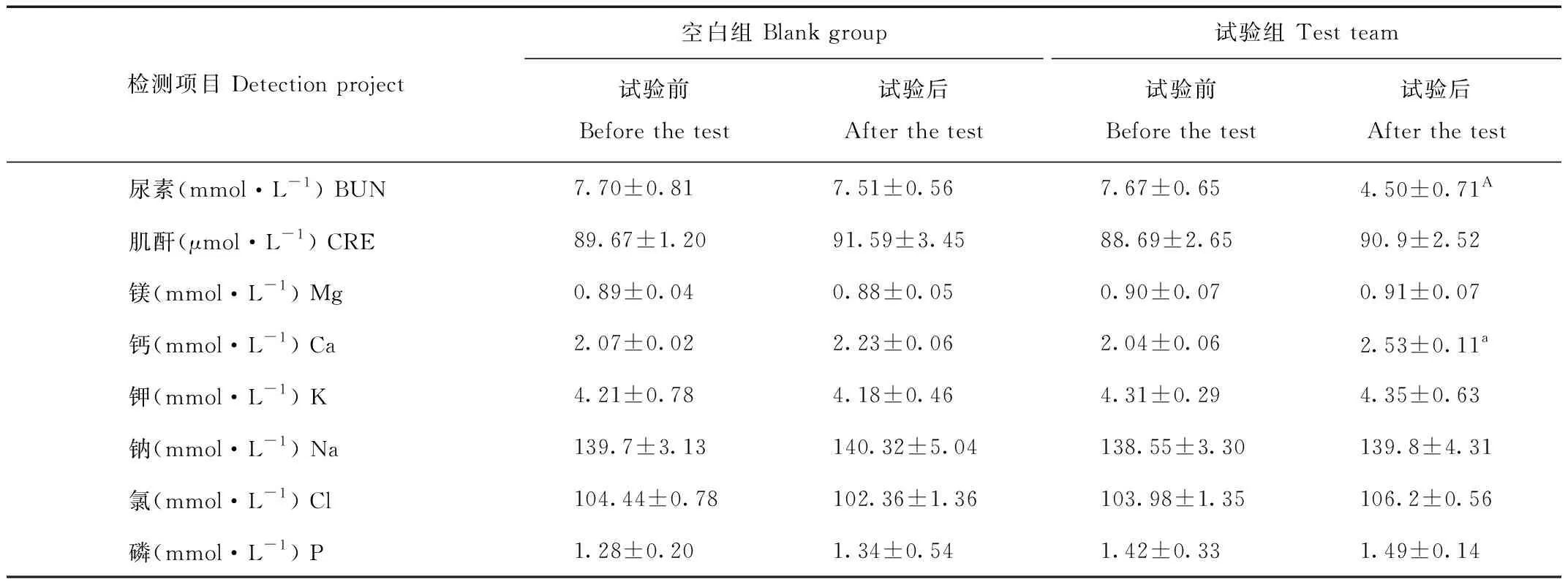
Tab.7 Kidney function biochemical levels in macaque blood
2.2.4 水苏糖对猕猴血液蛋白质、脂类和糖类代谢指标的影响
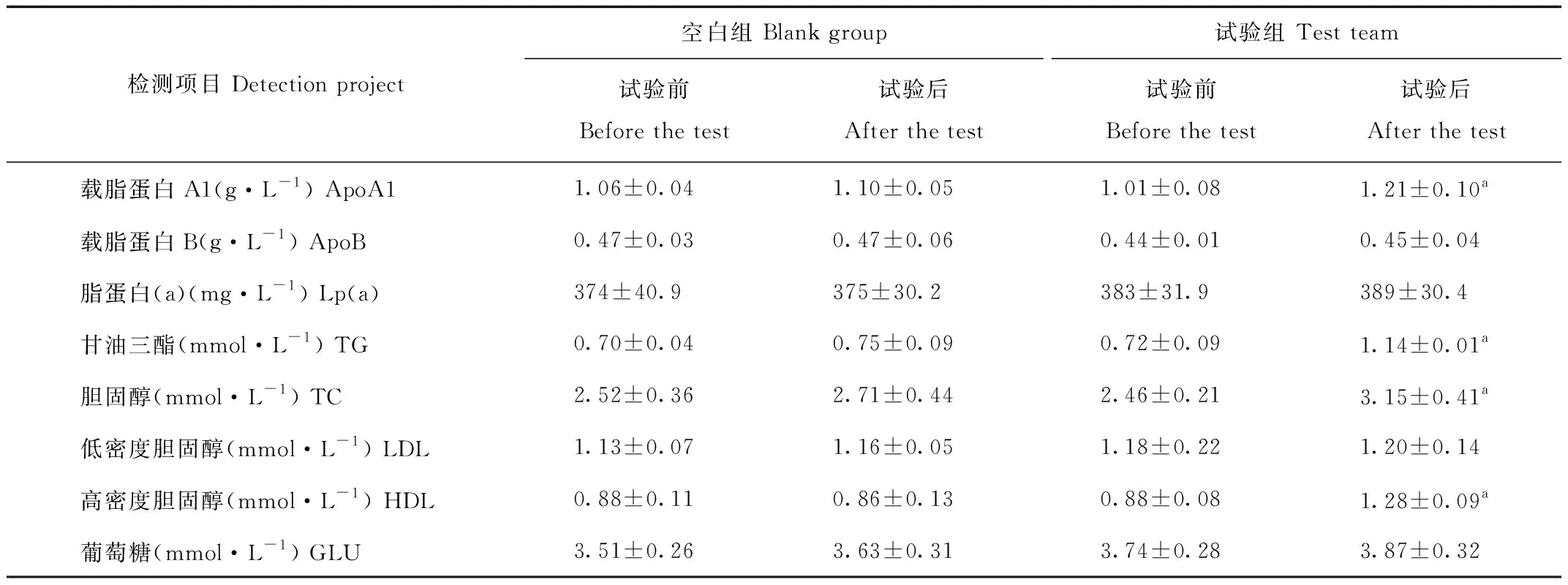
由表8得出,在水苏糖添加前后猕猴血液载脂蛋白、胆固醇、甘油三酯、HDL胆固醇指标有显著提高(P<0.05)。载脂蛋白B、脂蛋白aLp(a)无明显变化(P>0.05)。LDL胆固醇有所升高,但不显著(P>0.05)。血液葡萄糖含量有所提高,但效果不显著(P>0.05)。
表8 猕猴血液脂类和糖类水平
Tab.8 Lipid and sugar levels in macaque blood
2.3 讨论
2.3.1 水苏糖对猕猴肠道菌群结构的影响
给猕猴饲喂6周的水苏糖后,检测猕猴粪便中双歧杆菌、乳酸杆菌及大肠杆菌的数量,结果表明,试验组双歧杆菌在1~2周增长显著(P<0.01),3~6周增长趋势缓慢,不同年龄段均有增加,菌群数量增加了10倍以上,最终可达109CFU/g以上。成年体及老年体增长数量较幼年体较少,但与空白组对比均有极显著的增长(P<0.01)。试验结果与高鹏等[13]研究水苏糖对人类肠道菌群影响的结果基本相似,与舒国伟等[14]报导水苏糖等低聚寡糖体外增菌试验(增菌效率为40倍)结果有显著差异,这可能与体内试验时动物肠道菌群之间的相互作用有关。乳酸杆菌在试验期间增长趋势比双歧杆菌慢,但0~6 周不同年龄段均有2~4倍的数量变化,前后差异明显(P<0.05),这与王利红等[15]的水苏糖对酸乳增菌效果的研究结果一致。大肠杆菌数量在试验期间不同年龄段均有显著减少(P<0.05),饲喂6 周后大肠杆菌数量降至106~107CFU/g,这可能与饲养试验周期较短,肠道菌群之间的相互作用有关。试验结果表明,水苏糖作为非消化性低聚糖能够到达消化道后端,并被双歧杆菌等有益菌分解利用,对双歧杆菌有显著的增殖作用,有利于调节肠道微生态的结构,促进有益菌增殖,抑制有害菌在肠道内定植和繁殖,促进机体的肠道健康。
2.3.2 水苏糖对猕猴血液生理生化指标的影响
给猕猴饲喂6周的水苏糖后,分析其血液生理生化指标的变化,结果显示,猕猴血液红细胞、淋巴细胞、血液总蛋白、白蛋白、腺苷脱氨酶、载脂蛋白、胆固醇、甘油三酯、HDL胆固醇和血钙等指标有显著提高(P<0.05),谷丙转氨酶含量减少极显著(P<0.01),这与Mansour等、张红梅、易中华等[16-18]的研究结果相近,但猕猴血液胆固醇、甘油三酯、HDL胆固醇也显著提高,这与以上研究结果不同。在查阅了福州动物园建立的猕猴血液生理生化指标库,对比人类血液生理生化指标后,发现在现有饲养条件下,大多数猕猴血液胆固醇、甘油三酯、HDL胆固醇指标都处于人类指标的最低临界值水平,这可能与猕猴在现有饲养条件下长期素食,造成的营养不良有较大的关系。因此在饲喂水苏糖后猕猴肠道菌群结构改善,促进了机体营养物质的消化吸收,导致猕猴血液脂类指标的上升。综上,水苏糖可以显著地影响血液胆固醇、甘油三酯等脂类在体内的代谢,对钙也有良好的促进吸收作用,因此水苏糖可以通过改善猕猴肠道菌群结构,促进机体营养物质消化吸收,提高猕猴的免疫机能和抗病能力。
