激活的STAT3通过上调大鼠脊髓CXCL12的表达参与腰椎间盘髓核突出诱导的持续疼痛*
2018-08-20张怀奇刘纪文
李 贺 李 辉 周 红 张怀奇 肖 思 刘纪文
(中山大学附属第八医院疼痛科,深圳 518033)
腰椎间盘突出症(lumbar disc herniation, LDH)作为一类常见病、多发病,是临床上引起腰腿痛的最主要的病因之一,严重影响了病人的工作和生活质量。既往认为髓核的机械压迫和化学刺激[1,2]及其诱发的炎症反应所释放的IL-1β,IL-6和IL-8等细胞因子[3~5]在椎间盘突出诱导的腰痛和坐骨神经痛中起重要作用,但是LDH诱导痛觉过敏的确切机制并不十分清楚。因此,深入探讨该机制对临床防治LDH诱导的持续疼痛具有重要的理论和实际意义。趋化因子(chemokine)是一类可以引起白细胞向炎症部位移行的细胞因子的统称,部分趋化因子也参与神经系统的部分功能调控[6]。近期有研究发现:趋化因子CXCL12可由中枢神经系统的神经元和胶质细胞分泌,在神经系统和免疫系统相互作用中起着至关重要的作用[7]参与神经损伤、化疗药物诱导的多种病理性疼痛的发生[8,9]。然而脊髓CXCL12是否参与LDH诱导持续疼痛的发生尚无文献报道。有研究发现,腰椎间盘突出通过激活信号转导和转录激活因子3 (signal transducer and activator of transcription factor 3, STAT3)增强背根神经节神经元的兴奋性诱导的持续疼痛的发生[10],另有研究显示神经损伤可通过激活脊髓STAT3参与痛觉过敏的发生,抑制STAT3的活性则显著缓解神经病理性疼痛[11,12]。但是脊髓STAT3是否参与腰椎间盘突出诱导的持续疼痛,目前并不清楚。化疗药物可通过激活转录因子STAT3介导趋化因子CXCL12转录,上调CXCL12的表达,从而增强脊髓背角神经元的兴奋性,诱导痛觉过敏的发生[8]。因此,我们推测,腰椎间盘突出通过激活脊髓STAT3上调CXCL12的表达介导持续疼痛的发生。
本研究自2017年6月至2018年3月采用自体髓核移植的方法建立LDH大鼠模型,以探讨:髓核突出对脊髓CXCL12及p-STAT3表达的影响;抗CXCL12中和性抗体对髓核突出引起的痛反应的作用;STAT3活性抑制剂(S3I-201)对髓核突出引起的痛反应及上调CXCL12表达的影响,为进一步阐明LDH诱导持续疼痛的发生机制提供新的实验依据。
方 法
1.实验动物
实验采用雄性SD大鼠128只,体质量为200~220 g,由中山大学实验动物中心提供。动物分别分笼饲养,自由饮食。室温保持在22℃~25℃,湿度在50%~60%,12小时/12小时白天-黑夜循环照明。所进行的所有实验都按尽量减轻动物痛苦的原则并按照有关实验动物的使用原则操作。
本研究共分为三个实验:
实验一随机分为两组:假手术组(Sham组)共16只大鼠和模型组(LDH 组)共32只大鼠,分别检测两组建模前后的机械撤足阈值以及建模后脊髓CXCL12和p-STAT3的表达;
实验二随机分为四组:假手术组(Sham组)、模型组(LDH 组)、中和性抗体 + LDH组(Antibody + LDH组)和IgG + LDH组,每组8只,Antibody + LDH组和IgG + LDH组分别鞘内注射anti-CXCL12 的中和性抗体 8 μg (10 μl)和 IgG 8 μg(10 μl),建立模型术后连续注射7天。分别检测四组大鼠建模前后的机械撤足阈值;
实验三随机分为三组:假手术组 (Sham组)、STAT3抑制剂+ LDH组(S3I-201 + LDH组)和溶剂对照+ LDH组(Vehicle + LDH组),每组16只,S3I-201+ LDH组和Vehicle + LDH组分别鞘内注射S3I-201 100 μg (10 μl)和生理盐水溶液 10 μl,建立模型术后连续注射7天。分别检测三组大鼠建模前后的机械撤足阈值以及建模后脊髓CXCL12的表达。
2.鞘内置管
在实验二和实验三中,在LDH模型建立之前,先对Antibody + LDH组、IgG + LDH组、S3I-201+LDH组和Vehicle + LDH组大鼠行鞘内导管埋置术。参照Watanabe等人[13]的方法行鞘内导管埋置术。腹腔注射50 mg/kg的戊巴比妥钠麻醉大鼠后,俯卧位固定大鼠,L4-S2脊髓节段沿中线做一纵行切口,将无菌的 PE-10管从L4-L5椎间隙的硬膜下隙向头端小心插入,使导管尖端置于脊髓腰膨大处,将大鼠置于垂直体位后若导管内有脑脊液流出说明导管尖端位于椎管内,将导管固定于周围肌肉组织上。最后,逐层缝合周围肌肉组织,暴露于切口外的导管埋置于皮毛中。鞘内置管术后,立即进行LDH模型置备。
3.模型置备
参照Kawakami等人[14]建立的腰椎间盘突出模型方法,以其L5、L6棘突间为中心,钝性分离左侧椎旁肌肉,行左侧第5腰神经下关节突、第6腰神经上关节突及第5腰神经椎板切除术,暴露左侧第5腰神经背根神经节;然后于尾部行纵行切口,暴露第2尾椎至第3尾椎间隙后切取髓核组织,并将其置于暴露的第5腰神经背根神经节,但不要对其造成机械压迫,后逐层缝合。假手术组仅暴露相应的手术部位,不放置髓核。最后,逐层缝合周围肌肉组织。
4.行为学测试
为使大鼠适应测试环境,消除心理因素对测试结果的影响,实验前每天将大鼠置于透明有机玻璃箱内适应20分钟,至大鼠洗脸、行走、直立、搔抓等活动停止,共适应3天。行为学测试时用von Frey纤维丝通过箱底金属网孔对大鼠足底部皮肤施加机械性刺激,von Frey 纤维丝垂直,微弯,在大鼠足心部停留6~8 s。以2.041 g刺激强度为初始刺激强度。如果撤足反应为阴性,则再选用刺激强度呈对数递增的相邻von Frey 纤维丝继续刺激。如果撤足反应为阳性,则再选择相邻递减的刺激强度给予刺激。大鼠分别于术前1天及术后第7、14、21及28天进行机械撤足阈值测试。采用“up-down”的方法计算机械撤足阈值。
5.药物
Anti-CXCL12的中和性抗体(8 μg,10 μl;Torrey Pines Biolabs,美国),isotype IgG(8 μg,10 μl;Sigma,美国),STAT3活性抑制剂 S3I-201(100 μg,10 μl;Selleckchem,美国),抗 CXCL12抗体(1:50;Cell Signaling Technology,美国),抗p-STAT3 (Tyr705) 抗体 (1:1 000,Abcam,美国),抗 β-actin 抗体(1:2 000,Cell Signaling Technology,美国) 等。
6.Western blot
实验一、三中,大鼠行手术及药物处理后的第7、14、28天,各取8只,采用腹腔注射350 mg/kg的水合氯醛麻醉大鼠,在冰上迅速取出脊髓腰膨大段,分离出术侧腰膨大,称重后加入10倍蛋白裂解液,低温匀浆30 s后,15 000转/分离心,30分钟后取上清液,采用 BCA 蛋白定量试剂盒行蛋白定量。SDS-PAGE分离目的蛋白后转移到PVDF膜上。5%脱脂奶粉室温下封闭PVDF膜2小时后,分别加入抗 CXCL12抗体 (1:50)、抗 p-STAT3 (1:1 000)、抗β-actin抗体 (1:2 000),4℃孵育过夜。洗膜后加入相应的二抗(1:6 000),室温下孵育1小时。洗膜后加入ECL发光液显色曝光。采用Image J软件测定灰度值并进行相关统计分析。
7.统计学分析
采用SPSS 20.0统计学软件对结果进行分析,所得计量资料以均数±标准差(±SD)表示,行为学测试结果采用非参数检验进行分析,实验结果的组间比较采用完全随机设计的单因素方差分析ANOVA和LSD-t检验,P< 0.05为差异有统计学意义。
结 果
1.腰椎间盘髓核突出诱导大鼠出现机械痛敏,上调大鼠脊髓CXCL12的表达,明显增加大鼠脊髓STAT3的磷酸化水平
机械痛阈测试结果 (见图1A)显示:腰椎间盘髓核突出模型组大鼠的机械痛阈于手术后第7天开始明显下降,并持续至实验结束的第28天,且与假手术组相比较,差异具有统计学意义(P< 0.01)。上述结果提示,大鼠非压迫性腰椎间盘髓核突出模型建模成功,大鼠呈现机械痛觉过敏。Western blot结果(见图1B)显示:与假手术组比较,腰椎间盘髓核突出模型组大鼠脊髓的CXCL12表达水平于手术后7天明显升高,并持续至实验结束的第28天,差异具有统计学意义(P< 0.01)。Western blot结果(见图1C)显示,与假手术组相比较,腰椎间盘髓核突出模型组大鼠脊髓p-STAT3表达水平于手术后第7天明显升高,并持续至实验结束的第28天,差异具有统计学意义 (P< 0.01)。
2.鞘内注射抗CXCL12的中和性抗体显著缓解腰椎间盘突出诱发的痛觉过敏
行为学结果(见图2)显示:与假手术组相比较,腰椎间盘髓核突出模型组大鼠的机械痛阈于手术后第7天后明显降低,持续至实验结束的第28天,差异具有统计学意义 (P< 0.01);与鞘内注射IgG的腰椎间盘髓核突出模型组大鼠相比,鞘内注射抗CXCL12的中和性抗体(8 μg,10 μl/天,共7天)组在手术后的第7、14、21和28天的机械撤足阈值显著升高 (P< 0.01),这表明鞘内注射抗CXCL12的中和性抗体能够显著抑制LDH手术引起的机械撤足阈值的降低,提示CXCL12的上调可能参与了大鼠腰椎间盘髓核突出引起的痛觉过敏。
3.抑制STAT3的活化显著缓解腰椎间盘突出诱导的机械痛觉过敏
行为学结果(见图3)显示:与假手术组相比较,腰椎间盘髓核突出模型组大鼠的机械痛阈于手术后第7天后明显降低,持续至实验结束的第28天,差异具有统计学意义 (P< 0.01);与鞘内注射Vehicle的腰椎间盘髓核突出模型组大鼠相比,鞘内注射 STAT3 活性的抑制剂S3I-201(100 μg,10 μl/天,共7天)组在手术后的第7、14、21和28天的机械撤足阈值显著升高 (P< 0.01),这表明鞘内注射S3I-201能抑制LDH手术引起的机械撤足阈值的降低,提示脊髓STAT3的激活可能参与了大鼠腰椎间盘髓核突出引起的痛觉过敏。

图1 大鼠腰椎间盘髓核突出对大鼠机械撤足阈值及脊髓CXCL12表达的影响 (n = 8,x±SD)A:大鼠椎间盘髓核突出手术组(LDH)的机械撤足阈值于术后第7天开始下降并持续至第28天;B:大鼠椎间盘髓核突出手术组(LDH)的脊髓CXCL12表达于术后第7天开始上调并持续至第28天。**P< 0.01,与假手术组(sham)比较。C:大鼠腰椎间盘髓核突出对脊髓p-STAT3表达的影响。**P< 0.01,与假手术组 (sham)相比较。LDH:腰椎间盘突出症Fig.1 The effect of nucleus pulposus herniation of lumbar intervertebral disk on the paw withdrawal threshold (A) and spinal cord CXCL12 expression (B) in rats (n = 8,x±SD).**P< 0.01, compared with sham group.The effect of nucleus pulposus herniation of lumbar intervertebral disk on the expression of p-STAT3 in the spinal cord of rats.**P< 0.01, compared with sham group.LDH: lumbar disc herniation.

图2 抗CXCL12中和性抗体对大鼠腰椎间盘髓核突出引起的痛反应变化的影响 (n = 8,x±SD)**P< 0.01, 与假手术组 (sham)比较;##P< 0.01,与鞘内注射IgG的LDH (IgG + LDH)组相比较Fig.2 The effect of intrathecal injection of anti-CXC12 neutralizing antibody on the mechanical allodynia induced by nucleus pulposus herniation of lumbar intervertebral disk (n = 8,x±SD)**P< 0.01, compared with sham group; ##P< 0.01,compared with group IgG + LDH.
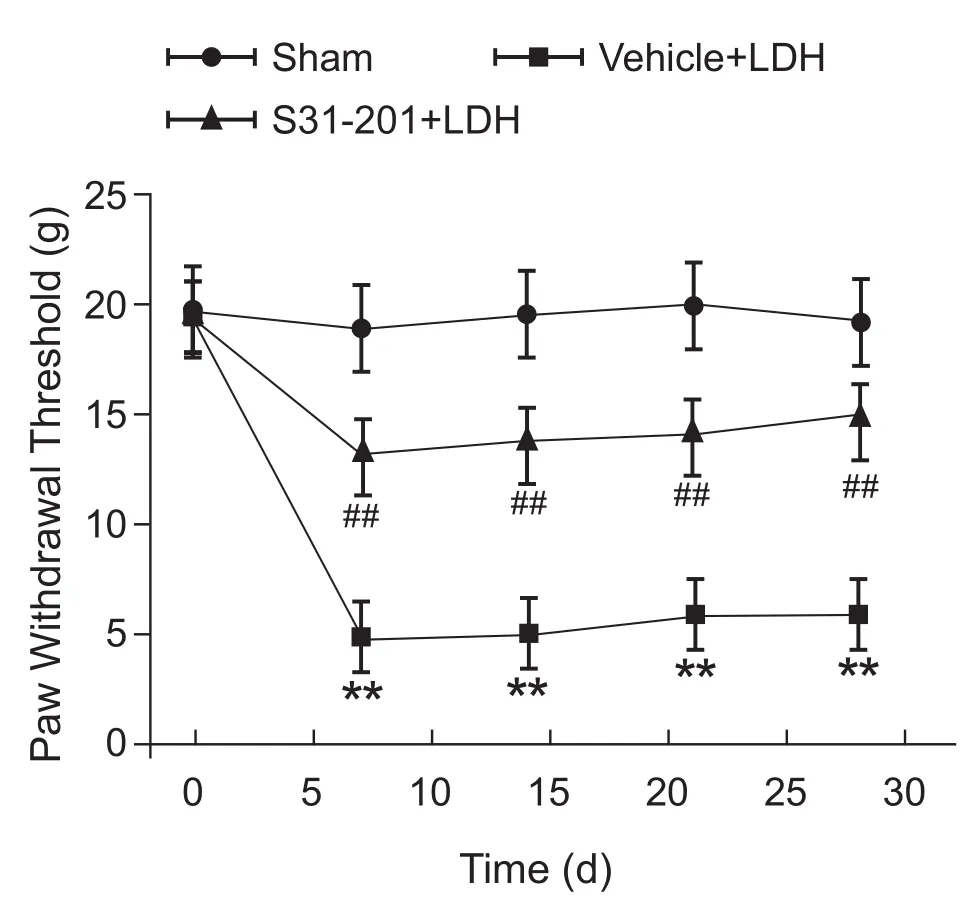
图3 STAT3活性抑制剂S3I-201对大鼠腰椎间盘髓核突出引起的痛反应变化的影响 (n = 8,x±SD)**P< 0.01,代表与假手术组(sham)比较;##P< 0.01,与鞘内注射溶剂对照的椎间盘突出(Vehicle + LDH)组相比较Fig.3 The effect of intrathecal injection of STAT3 activity inhibitor S3I-201 on the mechanical allodynia induced by nucleus pulposus herniation of lumbar intervertebral disk (n = 8,x±SD)**P< 0.01, compared with sham group; ##P< 0.01,compared with group Vehicle + LDH.
4.抑制STAT3的活化抑制腰椎间盘突出诱导的CXCL12上调
Western blot结果(见图4)显示,与假手术组相比较,手术后第14天,腰椎间盘髓核突出模型组大鼠脊髓p-STAT3表达水平明显升高,差异具有统计学意义 (P< 0.01),而与鞘内应用溶剂对照Vehicle的腰椎间盘髓核突出模型组相比,鞘内应用STAT3活性的抑制剂模型组大鼠CXCL12的表达显著降低,差异具有统计学意义 (P< 0.01)。以上结果提示腰椎间盘髓核突出可能通过激活脊髓的STAT3调控CXCL12的表达。

图4 术后第14天,STAT3活性抑制剂S3I-201对大鼠腰椎间盘髓核突出诱导脊髓CXCL12表达变化的影响 (n = 8,x±SD)**P< 0.01,与假手术组(Sham)相比较;##P< 0.01,与鞘内注射Vehicle的腰椎间盘突出(Vehicle +LDH)组相比较Fig.4 The effect of intrathecal injection of STAT3 activity inhibitor S3I-201 on the expression of CXCL12 induced by nucleus pulposus herniation of lumbar intervertebral disk (n = 8,x±SD)**P< 0.01, compared with sham group; ##P< 0.01,compared with group Vehicle + LDH.
讨 论
CXCL12是一种重要的趋化因子,近年来在神经突触可塑性方面的研究备受关注。例如CXCL12孵育脊髓可显著增强脊髓背角微小兴奋性突触后电流的幅度[9]。有研究还发现初级传入神经元可释放CXCL12,然后迁移至脊髓背角调节伤害性信号的传导[15]。此外,近期有报道表明,神经损伤或化疗后脊髓CXCL12的表达显著增加,而拮抗CXCL12的受体后显著缓解痛行为[8,9]。以上提示CXCL12参与了病理性疼痛的发生,但是CXCL12是否参与LDH诱导的持续性疼痛并不清楚。本研究发现LDH显著上调了脊髓CXCL12的表达,且应用抗CXCL12的中和性抗体显著缓解LDH诱导的机械痛敏。这些研究结果进一步扩展了CXCL12在其他形式疼痛中的作用。
STAT3是JAK-STAT信号通路中一种重要的核转录因子,p-STAT3在细胞的增殖、分化凋亡及免疫调节等过程中发挥着重要作用[16]。众所周知,STAT3作为一种转录因子,参与调节炎症和免疫反应,在神经元的退行性变、突触可塑性和学习记忆等多种神经生物学过程发挥重要作用。最近研究报道:STAT3还参与了神经病理性疼痛的发生。例如 神经损伤或化疗药物处理均可显著激活脊髓STAT3,上调p-STAT3的表达,而抑制STAT3的激活可显著缓解神经损伤或化疗药物诱导的痛觉过敏[10~12]。我们的研究首次发现,LDH显著上调脊髓p-STAT3的水平,STAT3活性抑制剂S3I-201可显著缓解LDH诱导的机械痛觉过敏。这与最近Zhang等人报道的LDH可诱导背根神经节STAT3的激活相一致[10],他们的研究也进一步证实了鞘内注射S3I-201可显著缓解LDH诱导的触诱发痛。这提示STAT3的激活在LDH诱导的痛觉过敏中发挥至关重要的作用。尽管已有报道表明LDH可显著上调背根神经节RAGE表达从而激活STAT3介导痛觉过敏的发生[10],但是LDH诱导脊髓STAT3激活的机制目前并不清楚,仍有待进一步研究。此外,鉴于已有研究表明STAT3可调控脊髓CXCL12的表达[9],我们进一步观察了抑制剂S3I-201对CXCL12表达的影响,发现S3I-201可显著抑制LDH诱导的脊髓CXCL12上调。这些结果进一步提示LDH可能通过激活脊髓STAT3上调CXCL12的表达,进而诱导痛觉过敏的发生。本研究为深入阐明大鼠LDH诱导的持续疼痛的发生机制提供了实验依据,也为其临床防治提供了新的思路。
