丹参注射液对兔软骨细胞增殖与凋亡的影响*
2018-08-15段洪超王庆超杰黑龙江中医药大学附属第二医院黑龙江哈尔滨150009
段洪超,王庆超,张 杰黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150009
骨性关节炎(osteoarthritis,OA)是一种关节软骨退行性骨关节疾病,被称为老年性关节炎、增生性关节炎、退行性关节炎、骨关节病、肥大性关节炎等,是中老年人常见的进展性骨关节疾病。临床表现为功能障碍、疼痛。重症患者表现为关节残废,比如髋、膝及脊柱等的残废[1]。在我国OA的致残率为51%[2-3],严重影响患者的生活质量,成为医学研究的热点。有文献报道[4-5]丹参注射液能有效降低实验性兔模型关节液中白细胞介素1及肿瘤坏死因子的水平,且兔膝软骨细胞破坏程度明显低于造模组,表明丹参关节内注射能有效治疗OA。柯青等[6]发现丹参注射液在治疗膝关节骨性关节炎方面取得和透明质酸钠类似的疗效,而且还可大幅度提高患者的生活质量。本研究从分子生物学角度探讨丹参注射液促进OA软骨细胞修复的机制,为临床治疗提供理论依据。
1 材料与方法
1.1实验动物健康4周龄雄性新西兰大白兔24 只,体质量(1.2±0.1)kg,平均 1.2 kg,由黑龙江中医药大学GLP中心提供,实验动物生产许可证号:SCXK(黑)2013-004,实验动物使用许可证号:SYXK(黑)2013-012。
1.2药物丹参注射液(正大青春宝制药,批号:1704133,规格:10 mL/ 支);DMEM 培养基(武汉普诺赛Procell生命科技有限公司);胎牛血清(Amresco公司);Ⅱ型胶原酶(Invitrogen公司);胰蛋白酶(上海书吉生物科技有限公司);甲苯胺蓝(上海紫一试剂厂);MTT(四甲基偶氮噻唑蓝,北京华越洋生物科技有限公司);cDNA第一链合成试剂盒(上海信裕生物科技有限公司);丙烯酰胺(郑州鸿祥化工有限公司);甲叉双丙烯酰胺(大连美仑生物科技有限公司);引物合成(武汉金开瑞生物工程有限公司);磷酸酶抑制剂(上海朝瑞生物科技有限公司);RIPA裂解液(上海威奥生物科技有限公司);兔抗GAPDH 37KD(北京中杉生物科技有限公司);HRP标记羊抗兔二抗,兔抗p-erk 42、44KD,兔抗p-p38 43KD(均购自上海科兴生化试剂有限公司)。
1.3仪器5424小型高速离心机(Eppendorf中国有限公司);utrao-SM 800全自动酶标仪(上海永创医疗器械有限公司);SLAN-96P型实时荧光定量PCR仪(上海宏石医疗科技有限公司);MPK5000电转仪(上海智岩科学仪器有限公司);My Cycler型PCR仪(伯乐生命医学产品有限公司);ZF-6型紫外分析仪(上海嘉鹏科技有限公司);Bio Spectrometer分光光度计(艾本德中国有限公司);HE-120型水平电泳仪(上海实生细胞生物技术有限公司);DHG-9030A型电热恒温鼓风干燥箱(上海之信仪器有限公司);CQT-191IR型CO2恒温培养箱(苏州珀西瓦尔实验设备有限公司);PC500型流式细胞仪(贝克曼库尔特公司);ZD-9556型水平摇床(金坛盛蓝仪器制造有限公司)。
1.4实验方法
1.4.1 兔软骨细胞培养与鉴定
1.4.1.1 兔软骨细胞的分离与培养 1)将空气栓塞注入兔耳缘静脉,处死后消毒。2)无菌条件下切取股骨髁和胫骨平台关节软骨,PBS缓冲液漂洗3次,剪成1 mm大小,PBS重复漂洗,剪碎的软骨放置于离心管内,加PBS缓冲液,静止后弃上清液,加2 mL质量分数为0.25%胰蛋白酶,37℃条件下消化30分钟。加入2 mL DMEM培养基Ⅰ,3 000 r/min离心3分钟,弃去上清液,加入4 mL混合消化液,37℃消化至第2天。加入等量DMEM培养基Ⅰ,吹打均匀。3 000 r/min离心5分钟,加入DMEM培养基Ⅱ重悬细胞沉淀,接种到无菌培养皿中,置于CO2培养箱中培养,48小时后根据细胞贴壁情况,每3天更换培养液1次。使用倒置显微镜观察软骨细胞生长情况,等细胞汇合成片,分布在大部分培养皿,细胞密度大约80%左右,弃培养液,PBS漂洗1次,加1~2 mL质量分数为0.25%胰蛋白酶消化细胞。显微镜下,消化1~2分钟,观察可见细胞相互分离变圆,消化完成后,弃胰酶溶液,加培养基,制成单细胞悬液,按1∶3的比例传代,饱和湿度条件下扩大培养。
1.4.1.2 细胞的鉴定 通过甲苯胺蓝染色法鉴定软骨细胞。将已分布细胞的玻片用PBS溶液漂洗3次,3 min/次;用4%的多聚甲醛固定玻片15分钟,用PBS溶液漂洗3次,3 min/次;入水浴锅预热60℃,使用甲苯胺蓝染液染色30分钟,双蒸水洗3次;95%乙醇分化,脱色,显微镜下背景清楚即可;100%酒精脱水,二甲苯透明,置于通风橱条件下,干燥后中性树胶封片;镜下观察细胞结构。1.4.2 MTT法检测2~5代细胞增殖曲线 取良好生长的第2~5代软骨细胞,接种于96孔板中,取浓度为10%胎牛血清(FBS)的DMEM溶液培养24小时;通过无FBS的DMEM溶液培养24小时消化软骨细胞,加浓度为10%FBS的DMEM溶液培养,每代细胞设定为6孔,分别于第1~10天;弃去培养溶液,使用PBS溶液10 μL漂洗1次,每孔加入浓度为0.5%MTT溶液20 μL,37℃孵育4小时,弃去MTT溶液,使用PBS溶液10 μL漂洗1次,加入体积为200 μL的二甲基亚砜(DMSO)溶液,37℃振荡10分钟;设定酶标仪波长570 nm,检测OD值,记录数据,绘制第2~5代细胞的生长曲线。
1.4.3 建立细胞活性的时效及量效关系
1.4.3.1 梯度时间法优化丹参注射液干预软骨细胞活性的时效关系 取良好生长的第3代软骨细胞,接种于96孔板中,取浓度为10%FBS的DMEM溶液培养24小时;加入含丹参注射液终浓度为0、50 μg/L含10%FBS的DMEM溶液中培养,每组细胞设定为6孔,培养24小时、48小时、72小时、96小时。弃去培养基,使用PBS溶液10 μL漂洗1次,每孔加入浓度为0.5%MTT溶液20 μL,37℃孵育4小时,弃去MTT溶液,使用PBS溶液10 μL漂洗 1 次,加入体积为 200 μL的 DMSO溶液,37℃振荡10分钟,使结晶溶解。设定酶标仪波长570 nm,检测OD值,记录数据,找到丹参注射液对软骨细胞活性的时效关系。
1.4.3.2 梯度浓度法优化丹参注射液干预软骨细胞活性的量效关系 取良好生长的第3代软骨细胞,接种于96孔板中,取浓度为10%FBS的DMEM溶液培养24小时;加入含丹参注射液终浓度为0、25、50、100、200、400 μg/L含 10%FBS 的 DMEM 溶液中培养,每组细胞设定为6孔,培养72小时。弃去培养基,使用PBS溶液10 μL漂洗1次,每孔加入浓度为0.5%MTT溶液20 μL,37℃孵育4小时,弃去MTT溶液,使用PBS溶液10 μL漂洗1次,加入体积为200 μL的DMSO溶液,37℃振荡10分钟,使结晶溶解。设定酶标仪波长570 nm,检测OD值,记录数据,找到丹参注射液对软骨细胞活性的量效关系。
1.4.4 RT-PCR法检测各组软骨细胞Bcl-2、Bax的表达
1.4.4.1 T-RNA的提取 第3代软骨细胞→加1mL Trizol溶液反复吹打→转入1.5 mLEP管中→颠倒混匀5次,放置5分钟→加三氯甲烷200 μL,颠倒混匀10次,放置15分钟→4℃条件下,12 000 r/min离心15分钟,管内分4层→转上层水相(约500 μL)于1.5 mL EP管中→加入等体积异丙醇(约500 μL),颠倒混匀10次,放置10分钟→4℃条件下,12 000 r/min离心10分钟,弃上清液,可见贴壁薄层及白色的RNA→加75%乙醇1 mL→4℃条件下,7 500 r/min离心5分钟,弃上清液,干燥10分钟→加20 μL纯净水溶解RNA→核酸蛋白检测仪验证抽取是否成功→逆转录成cDNA。
1.4.4.2 逆转录反应 逆转录反应体系及条件见表1—2。

表1 逆转录反应体系

表2 逆转录反应条件
1.4.4.3 引物的设计与合成 查询新西兰兔相关基因序列,输入引物设计软件设计上、下游引物序列,将其进行对比,上、下游引物匹配率均为100%。
1.4.4.4 PCR反应 PCR反应体系及条件见表3—4。

表3 PCR反应体系
1.5统计学方法采用SPSS 13.0统计学软件处理数据,计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,同组干预前后采用配对t检验,检验水准为α=0.05。
2 结果
2.1第2~5代细胞的增殖曲线第1天各代细胞OD值没有显著差异(P>0.05),第2天增殖缓慢,第3天逐渐加快增殖,第4天进入生长期,第5、6天增殖变慢,第7、8天增殖进入平台期,第9、10天增殖抑制。OD值随细胞传代呈减低趋势,第2、3 代高于第 4、5 代,但没有显著差异(P>0.05),见图1。

图1 各组软骨细胞增殖曲线
2.2优化丹参注射液干预细胞活性的时效关系2组干预24小时OD值没有显著差异(P>0.05),干预48小时OD值中剂量组大于对照组(P<0.05),干预72、96小时OD值中剂量组明显大于对照组(P<0.01),中剂量组干预72小时OD值显著大于24、48、96小时(P<0.05),故选择细胞干预72小时作为以后实验检测时间点,见表5。
表5 梯度时间法优化丹参注射液干预软骨细胞活性的时效关系(±s)

表5 梯度时间法优化丹参注射液干预软骨细胞活性的时效关系(±s)
注:与对照组相比,*表示P<0.01,□表示P<0.05;与同组干预前比较,△表示P<0.05,#表示P<0.01
组别 干预前 干预后24 h 干预后48 h 干预后72 h 干预后96 h对照组 0.19±0.03 0.27±0.02△ 0.38±0.03△ 0.51±0.04# 0.48±0.03#中剂量组 0.20±0.02 0.29±0.02△ 0.39±0.02□△ 0.57±0.02*# 0.51±0.03*#
2.3优化丹参注射液干预细胞活性的量效关系第3代软骨细胞用不同丹参注射液终浓度的10%FBS DMEM溶液干预,干预前细胞OD值没有明显差异(P>0.05);干预 72 小时候后,400、200、100、50、25 μg/L浓度细胞的OD值显著大于0 μg/L浓度OD 值(P<0.01);50 μg/L浓度细胞 OD 值显著大于400、200、100、25 μg/L 浓度OD 值(P<0.01);100 μg/L浓度的细胞 OD值显著大于 400、200、25μg/L浓度OD 值(P<0.01);100 μg/L浓度细胞OD值与50μg/L浓度细胞OD值比较差异无统计学意义(P>0.05),见表6。
表6 梯度时间法优化丹参注射液干预软骨细胞活性的量效关系(±s)
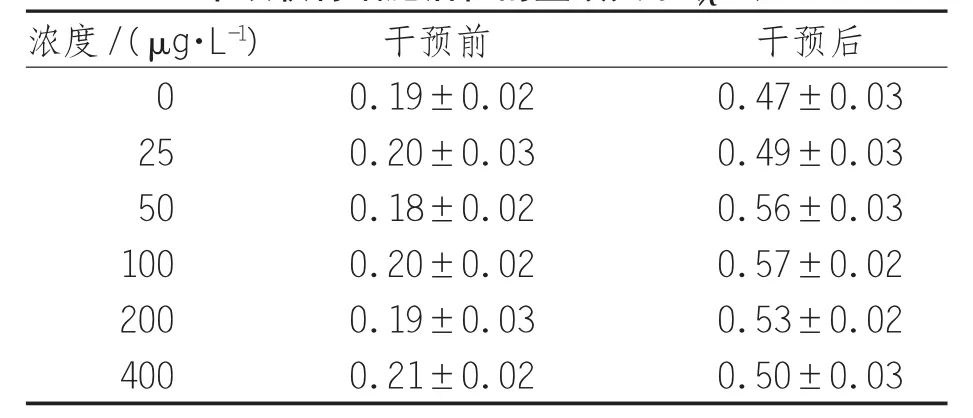
表6 梯度时间法优化丹参注射液干预软骨细胞活性的量效关系(±s)
浓度/(μg·L-1) 干预前 干预后0 0.19±0.02 0.47±0.03 25 0.20±0.03 0.49±0.03 50 0.18±0.02 0.56±0.03 100 0.20±0.02 0.57±0.02 200 0.19±0.03 0.53±0.02 400 0.21±0.02 0.50±0.03
2.4RT-PCR检测细胞Bcl-2、Bax的表达诱导凋亡的第3代软骨细胞,加丹参注射液干预24小时后细胞Bax表达中、高剂量组小于模型组(P<0.05),高剂量组小于低剂量组(P<0.05);细胞Bcl-2表达中、高剂量组大于模型组(P<0.05),高剂量组大于低剂量组(P<0.05),见表7。
表7 丹参注射液干预后细胞Bcl-2、Bax的表达(±s)

表7 丹参注射液干预后细胞Bcl-2、Bax的表达(±s)
注:与模型组比较,■表示P<0.01,□表示P<0.05;与低剂量组比较,▲表示P<0.01,△表示P<0.05
组别 Bcl-2 Bax正常组 2.697±0.532△■▄ 1.135±0.793▲模型组 0.908±0.259 6.674±1.257低剂量组 1.723±0.451 6.108±1.982中剂量组 2.239±0.564□ 4.170±2.134□高剂量组 3.134±0.702□■ 2.458±0.675□■
3 讨论
OA是一种关节软骨降解进展性疾病,其主要病理变化由软骨细胞分解、合成活动失衡导致。软骨细胞属于终末分化细胞,其在体外的传代培养过程中出现增殖停滞,表型丧失,呈老化状态,这种老化属于复制性老化。细胞老化是细胞周期调控下多基因参与的复杂的生理病理过程,具有一定可控性。细胞周期调控因子相互作用导致细胞老化[7-8]。有研究[9]证明关节软骨细胞的凋亡与细胞周期调控因子Bcl-2等活性密切相关,软骨细胞凋亡过盛可能使关节软骨退变发展成骨关节炎。
祖国医学认为骨性关节炎属“骨痹”范畴。中医对其认识和治疗有悠久的历史。《素问·痹论篇》曰:风寒湿三气杂至,合而为痹也。历代医家又从实践中不断加以发展。王清任《医林改错》一书提出“痹由瘀血致病”说,书中列有身痛逐瘀汤等方剂,治疗别具一格。丹参味苦性微寒,归心、肝经,功能活血通络,《日华子本草》曰:“通利关脉,治……骨节疼痛,四肢不遂。”《本草正义》言:“专入血分,其功在活血行血,内之达脏腑而化瘀滞,故积聚消而瘕破,外之利关节而通经络,则腰健而痹著行。”现代医学研究[10]发现其有效成分丹参酮对炎症有良好的治疗作用,且可抗氧化,改善微循环;丹参注射液关节内注射可有效减轻关节软骨损伤及退行性改变[11];还可保护软骨细胞,防止关节软骨退变[12]。
本研究结果表明丹参注射液可修复退变软骨,防治骨性关节炎,该作用与减少软骨细胞凋亡密切相关,机制可能是:上调抗凋亡调控因子Bcl-2的表达,下调促凋亡调控因子bax的表达,从而减少软骨细胞凋亡,丹参注射液的调控效果与其浓度有一定关系。今后应设计大样本、双盲、随机对照试验,结合现代医学方法,深层次探讨丹参注射液对骨性关节炎治疗作用的机制。
