肿瘤免疫微环境在肿瘤常规治疗效应中的作用
2018-08-11柯娇娇
柯娇娇
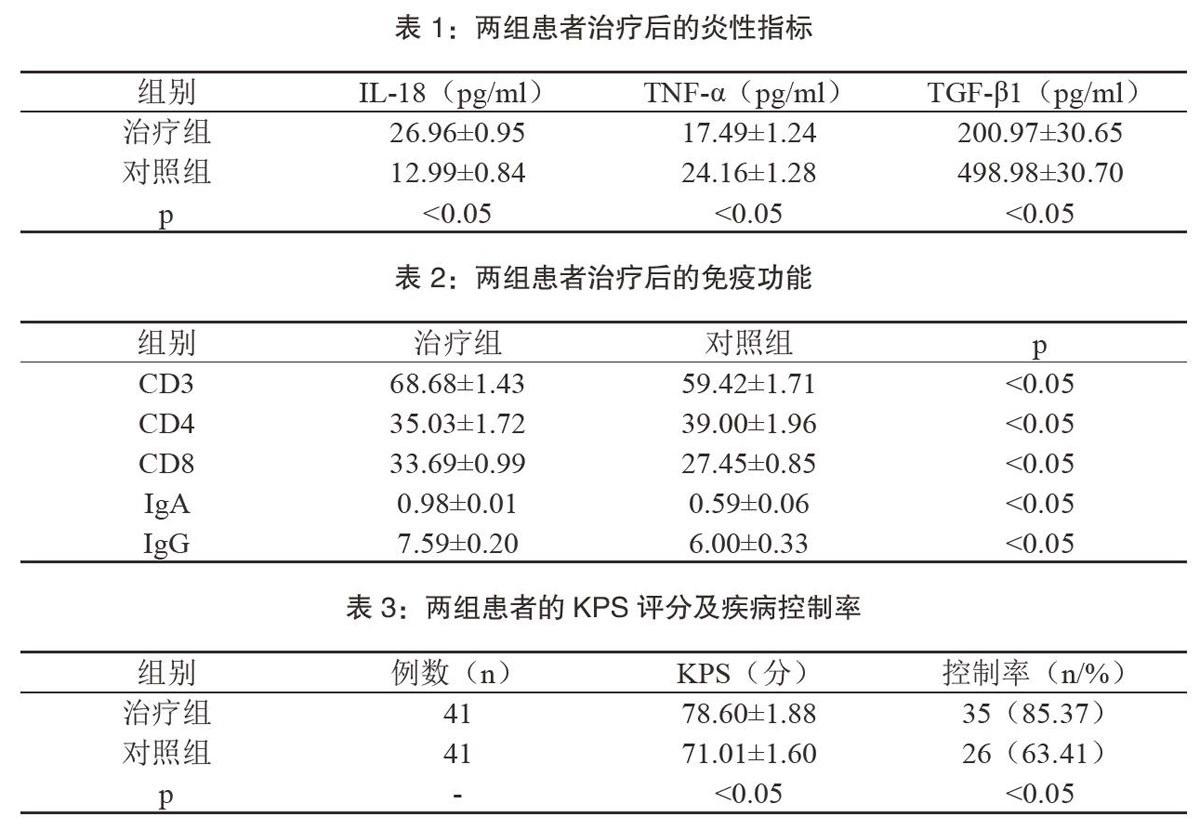
【摘要】目的:观察肿瘤免疫微环境在肿瘤常规治疗效应中的作用。方法:选取本院收治的恶性肿瘤患者82例作为样本,随机分为治疗组与对照组。对照组采用常规方法治疗,治疗组将肿瘤免疫微环境应用到治疗中。结果:治疗后,治疗组IL-18(26.96±0.95)pg/ml、TNF-α(1 7.49±1.24)pg/ml、TGF-β1(200.97±30.65)pg/ml、CD3(68.68±1.43)、CD4(35.03±1.72)、CD8(33.69±0.99)、IgA(0.98±0.01)、IgG(7.59±0.20)、KPS(78.60±1.88)分、
疾病控制率85.3 7%,与对照组相比差异显著(p 【关键词】肿瘤免疫微环境;炎性指标;免疫功能 恶性肿瘤的常规治疗方法以放化疗为主,可在一定程度上抑制病情进展,但复发率较高。有研究指出,构建肿瘤免疫微环境,有助于提高治疗有效率,降低复发率。本文于本院2015年10月-2017年10月收治的恶性肿瘤患者中,随机选取82例作为样本,观察了肿瘤免疫微环境在肿瘤常规治疗效应中的作用,得到报告如下: 1资料与方法 1.1一般资料 于本院2015年10月-2017年10月收治的恶性肿瘤患者中,随机选取82例作为样本。根据治疗方法的不同,将患者随机分为治疗组与对照组2组。 治疗组患者资料:例数:共41例。性别:男:女=17:24例。年龄(45-80)岁,平均(59.74±1.85)岁。肿瘤位置:消化系统15例、呼吸系统12例、泌尿系统13例、其他1例。对照组患者资料:例数:共41例。性别:男:女=18:23例。年龄(44-81)岁,平均(59.82±1.90)岁。肿瘤位置:消化系统14例、呼吸系统13例、泌尿系统12例、其他2例。两组资料对比,无显著差异(p>0.05)。 1.2纳入标准 (1)疾病均已确诊; (2)患者无精神及意识障碍; (3)自愿参与研究。 1.3方法 对照组采用常规方法治疗,包括手术切除肿瘤、放疗及化疗等。 治疗组将肿瘤免疫微环境应用到肿瘤常规治疗过程中,方法如下:1周1次,对患者的炎性介质、T淋巴细胞计数情况、免疫功能等进行检测。根据检测结果,调整治疗方案。如患者中性粒细胞水平及WBC水平较低,则应加强对感染的预防。如患者伴随免疫抑制症状,同样需予以干预,提高治疗有效率。 1.4观察指标 观察两组患者治疗后炎性指标的变化情况,包括IL-18、TNF-α、TGF-β1共3项指标。观察两组患者治疗后免疫功能指标的变化情况,包括CD3、CD4、CD8、Ign、IgB共5项指标。观察两组患者的KPS评分及疾病控制率,当肿瘤无转移、病情无进展时,视为疾病已得到了控制。 1.5統计学方法 采用SPSS 20.0软件处理数据,计数采用X2检验,以(%)表示。计量采用t检验,以(均数±标准差)表示。当p<0.05时视为数据差异具有统计学意义。 2结果 2.1两组患者治疗后的炎性指标 两组数据对比差异显著(p<0.05)。详见表1。 2.2两组患者治疗后免疫功能指标的变化情况 两组免疫功能数据对比差异显著(p<0.05)。详见表2。 2.3两组患者的KPS评分及疾病控制率 两组数据对比差异显著(p<0.05)。详见表3。 3讨论 炎性反应及免疫抑制,属于恶性肿瘤患者的常见不良反应,是影响疾病治疗安全性及疾病控制率的主要因素,肿瘤免疫监视学说指出,机体免疫系统对恶变细胞的排斥反应,与免疫反应相同,均需要在先天性与获得性免疫的双重作用下方可实现。随着恶性肿瘤的进展以及肿瘤基质的重建,以IL-18、TNF-α、TGF-β1为代表的炎性指标,同样会发生一定的变化。本文研究发现,接受常规治疗者,治疗后,IL-18(12.99±0.84)pg/ml、TNF-α(24.16±1.28)pg/ml、TGF-β1(498.98±30.70)pg/ml。表明,放化疗在抑制炎性反应方面,具有重要的价值。 从免疫机制的角度分析,如先天免疫效应机制能够被激活,肿瘤细胞所释放的抗原量将显著提升。肿瘤细胞浸润的树突状细胞在获取抗原后,淋巴结转移现象即可随之产生,致使疾病进展。当恶性肿瘤患者发生淋巴结转移后,以CD3、CD4、CD8为代表的T淋巴细胞指标将明显下降,提升患者的免疫功能已经受损。CD4为细胞因子的一种,可支持CD8细胞识别并将肿瘤细胞杀除,提高肿瘤患者的健康水平。可见,机体的免疫机制,具有较强的识别肿瘤细胞之功能。但恶性肿瘤治疗过程中,却仍可见大部分患者发生淋巴结及远端转移。表明,肿瘤细胞能够通过免疫系统的负调控机制,建立起肿瘤微环境免疫抑制网络,进而导致机体CD8等免疫细胞对肿瘤细胞的识别能力降低,抑制CD4及CD8等免疫细胞的功能。此时,临床免疫功能检验即可见CD3、CD4及CD8等免疫指标下降的现象。本文研究发现,接受常规治疗者,治疗后CD3(59.42±1.71)、CD4(39.00±1.96)、CD8(27.45±0.85)、IgA(0.59±0.06)、IgG(6.00±0.33)。表明,患者的免疫功能有所增强,证实了放化疗在提高恶性肿瘤患者免疫功能方面的显著效果。肿瘤免疫抑制微环境,可限制机体的抗肿瘤免疫反应,进而导致恶性肿瘤的控制率降低,拉低患者的健康水平及生活质量。临床研究发现,采用放化疗方法治疗恶性肿瘤,虽能够有效抑制病情进展、延长患者的寿命,但却难以提高T细胞的免疫功能。免疫抑制微环境,是肿瘤细胞通过逃逸免疫监视的途径,利用机体的负调控机制,所建立的免疫抑制网络。该网络具有动态性强的特点,给予抗体治疗以及淋巴细胞过继治疗后,机体免疫功能可显著提升。本文研究发现,接受常规治疗者,KPS(78.60±1.88)分、疾病控制率85.37%,表明,放化疗可在一定程度上抑制肿瘤进展。但如肿瘤细胞发生了免疫逃逸,免疫抑制微环境,又会被重新建立起来。可见,肿瘤免疫微环境在肿瘤的进展中广泛参与,而改善肿瘤免疫抑制,则是提高肿瘤常规治疗有效率的主要途径。本文研究发现,将肿瘤免疫微环境应用到肿瘤常规治疗中,每周一次,对患者的炎性指标、免疫功能指标进行检验,并根据检验结果调整治疗方案后,患者的各项指标均有所改善。其中,炎性指标中,IL-18(26.96±0.95)pg/ml、TNF-α(17.49±1.24)pg/ml、TGF-B1(200.97±30.65)pg/ml。与常规治疗者相比,优势显著(p<0.05)。通过对患者免疫功能指标的观察发现,治疗后,CD3(68.68±1.43)、CD4(35.03±1.72)、CD8(33.69±0.99)、IgA(0.98±0.01)、IgG(7.59±0.20)。与常规治疗者相比,患者免疫功能的增强幅度更大,进一步证实了肿瘤免疫微环境在肿瘤常规治疗中的重要作用。通过对患者KPS评分以及疾病控制率的观察发现,治疗后,患者KPS(78.60±1。88)分、疾病控制率85.37%,与常规治疗相比,优势显著(p<0.05)。 综上所述,肿瘤免疫抑制微环境,对机体抗肿瘤免疫反应具有主导抑制作用,临床应进一步加强对该因素的研究,为疾病治疗方案的改进,以及疾病控制率的提升奠定基础。
