下调lmna基因促进斑马鱼胚胎细胞凋亡
2018-08-08李雪华侯仕芳周艳华何志旭舒莉萍
李雪华,侯仕芳,周艳华,何志旭,*,舒莉萍,,4*
(贵州医科大学 1.临床医学院 儿科学教研室; 2.组织工程与干细胞实验中心; 3.基础医学院 免疫学教研室;4.动物实验中心,贵州 贵阳 550004)
lmna(lamin A/C)基因是核纤层蛋白合成的关键基因,是细胞核形态及功能的主要决定因素,与基因复制、转录翻译活动密切相关。lmna突变可导致早衰[1-2],目前尚未发现有效治疗方法。因此,研究LMNA下调时细胞凋亡机制对寻找核纤层蛋白病治疗方法有一定意义。
吗啡代寡核苷酸(morpholine oligonucleotide, MO)通过抑制mRNA的剪切和翻译来抑制基因表达。有研究证实:将lmna-EGFP-pCS2+质粒同特异性吗啉代寡核苷酸共注入斑马鱼单细胞期的胚胎,各时相胚胎中绿色荧光均消失,说明lmna-MO能有效下调lmna基因[3]。
AKT磷酸化是激活AKT通路的重要一步,p-AKT通过抑制凋亡而促进细胞存活[4]。激活的AKT能够使丝氨酸、苏氨酸磷酸化,从而诱导抗凋亡蛋白基因的表达。BCL-2家族可辨识促凋亡成员,避免细胞进入凋亡。细胞的存活受到AKT、BCL-2蛋白的共同调控,且AKT的表达对BCL-2起着重要的调控作用[5-6]。本研究利用吗啉代寡核苷酸技术下调斑马鱼lmna基因,探讨核纤层蛋白异常与细胞凋亡机制之间的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物:野生型Tüebingen斑马鱼系由本课题组自行饲养培育。养殖方法:在带有过滤和消毒的恒温循环水系统中进行养殖,光照时间12 h/d,水温(28±2)℃,喂食草履虫及丰年虫。
1.1.2 试剂:Western blot免染胶试剂盒(Bio-Rad公司)、一抗(S473 p-AKT蛋白、AKT蛋白、BCL-2蛋白)(Gene Tex公司)、Annexin-V PE/7AAD凋亡试剂盒(BD公司)、蛋白酶K(Sigma公司),PBS溶液、胎牛血清(FBS)、胰蛋白酶(四季青试剂公司),二抗、电泳液、转膜液、TBST溶液(碧云天试剂公司)。
1.2 方法
1.2.1 下调斑马鱼lmna基因:采用显微注射技术,将lmna-MO注射入单细胞时期的斑马鱼胚胎中,放入温箱(30±2)℃保存,待胚胎发育至24和72 h进行实验。
1.2.2 流式细胞计量术检测凋亡:每组收集胚胎50枚,用1×PBS清洗3次,冰上研磨,加入500 μL 0.25%的胰蛋白酶,38 ℃水浴30 min,每隔10 min吹吸1次;加入1 mL FBS,将组织液放入BD膜中过滤后移至新离心管中;800 r/min离心5 min,去上清;加入0.9×PBS/FBS 500μL,800 r/min离心5 min,去上清;加入0.9×PBS/FBS 100 μL和1×PBS 300 μL轻混匀;避光加入Annexin-V PE/7AAD凋亡试剂。为保证实验数据的真实性及可靠性,需重复实验3次以上。
1.2.3 Western blot检测凋亡蛋白的表达:每组收集胚胎各50枚,用1×PBS清洗3次,加入蛋白裂解液,冰上研磨,3 537 r/min离心5 min,取上清;加入蛋白缓冲液,沸水中煮5~10 min,直至蛋白质充分变性,-80 ℃保存;配胶过程按试剂盒说明书操作,灌胶后插入梳子, 30 min后取出梳子, 上样, 电泳250 V恒压30 min,PVDF膜甲醛浸泡,300 mA恒流转膜2 h,摇床封闭1 h;剪膜;4 ℃摇床孵育一抗过夜;洗膜;常温摇床孵育二抗,再次洗膜;根据凝胶成像结果检测p-AKT、AKT及BCL-2蛋白表达量,图片数据用Image J及GraphPad Prism 5.0软件处理。
1.3 统计学分析

2 结果
2.1 流式细胞仪检测凋亡结果
lmna基因的下调可引起细胞凋亡,且细胞早期凋亡更明显(P<0.01)(图1,2)。
2.2 蛋白质免疫印迹结果
p-AKT:野生型组较显微注射后24和72 h组低,且显微注射72 h组较24 h组高(P<0.01);AKT:野生型组较显微注射后24和72 h组低,且显微注射24 h组较72 h组高(P<0.05);BCL-2:野生型组较显微注射后24和72 h组高(P<0.05)(图3~5)。

图1 野生型、注射lmna-MO后24及72 h胚胎细胞凋亡情况Fig 1 Apoptosis of wild type embryo cells, 24 and 72 hours embryo cells after microinjection of lmna-MO
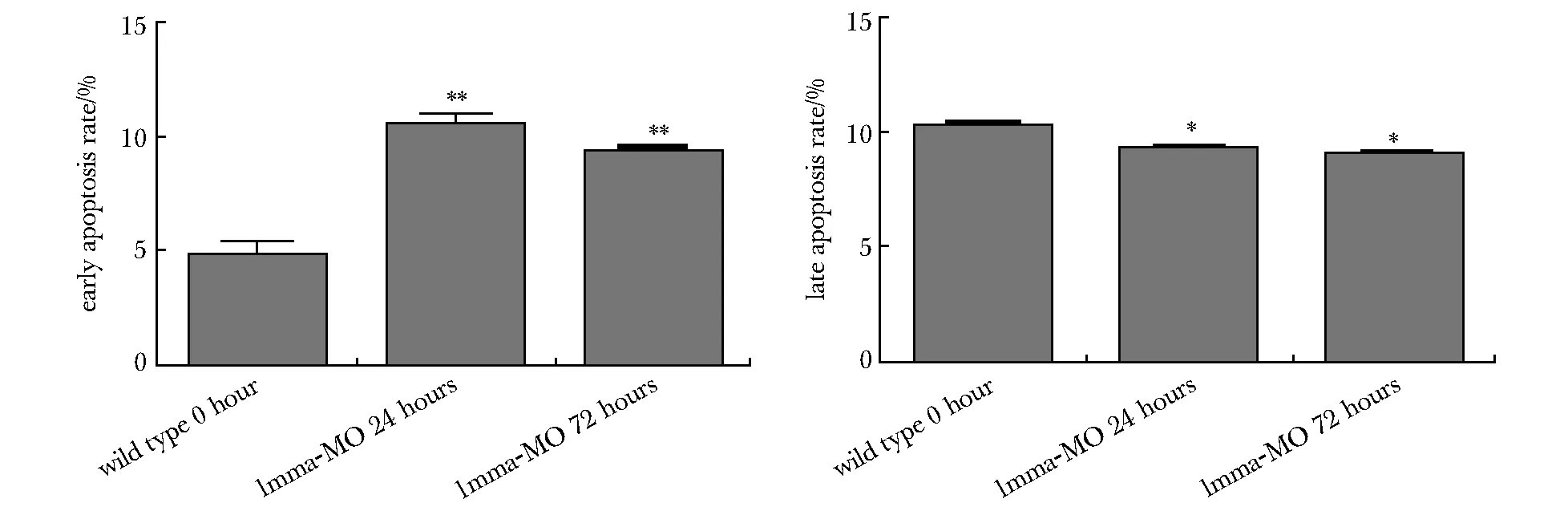
*P<0.05,**P<0.01 compared with wide type图2 斑马鱼胚胎早、晚期细胞凋亡情况统计图Fig 2 Statistical graph of apoptosis in zebrafish embryos at early and late n=3)

*P<0.01 compared with wide type图3 Western blot检测p-AKT蛋白的表达Fig 3 Expression of p-AKT protein by Western n=3)

*P<0.05 compared with wide type图4 Western blot检测AKT蛋白的表达Fig 4 Expression of AKT protein by Western n=3)

*P<0.05 compared with wide type图5 Western blot检测BCL-2蛋白的表达Fig 5 Expression of BCL-2 protein by Western n=3)
3 讨论
本实验以斑马鱼作为研究对象,其体外受精、易繁殖等优势为研究生物早期组织器官的发育提供了便利[7-8]。吗啉代寡核苷酸技术的原理是基于RNA的核糖骨架被吗啉环替代,从而抑制基因表达,但该技术存在时效短这一缺点:将lmna-MO注射入斑马鱼单细胞期胚胎中,其荧光从6 h在胚胎内广泛表达,至30 h时逐渐减少,72 h则完全消失[3]。本实验结果检测到不同时相的胚胎存在不同程度的凋亡现象,注射lmna-MO 72 h后,胚胎细胞凋亡情况仍明显,说明lmna下调引起细胞凋亡存在不可逆趋势。
lmna基因的缺失可引起细胞迁移和细胞凋亡异常[9],细胞膜中的磷酯酰丝氨酸(PS)在凋亡早期会由脂膜从内翻向外,暴露的PS与凋亡细胞膜结合的同时可被Annexin V检测到,PE作为荧光素将对Annexin V标记,通过7-AAD标记的DNA降解情况进行流式细胞学分析:LMNA基因的下调可引起细胞凋亡,且细胞早期凋亡更明显,故细胞凋亡现象可能与lmna-MO的暴露时间及胚胎发育情况有关。
Western blot检测到lmna基因下调后p-AKT(S473)表达增加,表明激活的AKT使底物蛋白特定部位的丝氨酸、苏氨酸磷酸化,p-AKT在抑制细胞凋亡促进细胞存活过程中起到了至关重要的作用。p-AKT蛋白与AKT蛋白表达量无正相关性,可能是由于药物暴露时间越长,AKT通路活化程度越高,抑制凋亡程度越明显;但是也不能排除存在其他调控机制参与AKT活化过程。
AKT位于多条重要信号通路的交叉点,能够作用于下游关键的蛋白BCL-2,BCL-2的过度表达可抑制凋亡过程的发生[10-12]。大量研究表明:AKT通路对细胞凋亡有抑制作用,AKT作为BCL-2的上游,对BCL-2蛋白有抑制作用, 从而抑制细胞凋亡。
本实验结果表明:当lmna基因突变后,lmna蛋白表达消失,BCL-2作为lmna上游,由于缺乏下游受体蛋白,故BCL-2蛋白表达减少;AKT通路抑制BCL-2蛋白表达减少,故AKT蛋白表达增加。BCL-2蛋白虽然在线粒体上表达,但是仍可以通过AKT通路和一系列信号蛋白的参与来影响核纤层蛋白的表达(图6)。
lmna可能在调控细胞的凋亡过程中起着重要的作用,p-AKT参与AKT通路激活过程,且lmna引起细胞凋亡机制可能与AKT、BCL-2蛋白的表达情况有关。迄今为止,lmna突变导致细胞凋亡的机制仍然有许多学者在进行研究,但是核纤层蛋白病的潜在分子机制仍亟待解释。
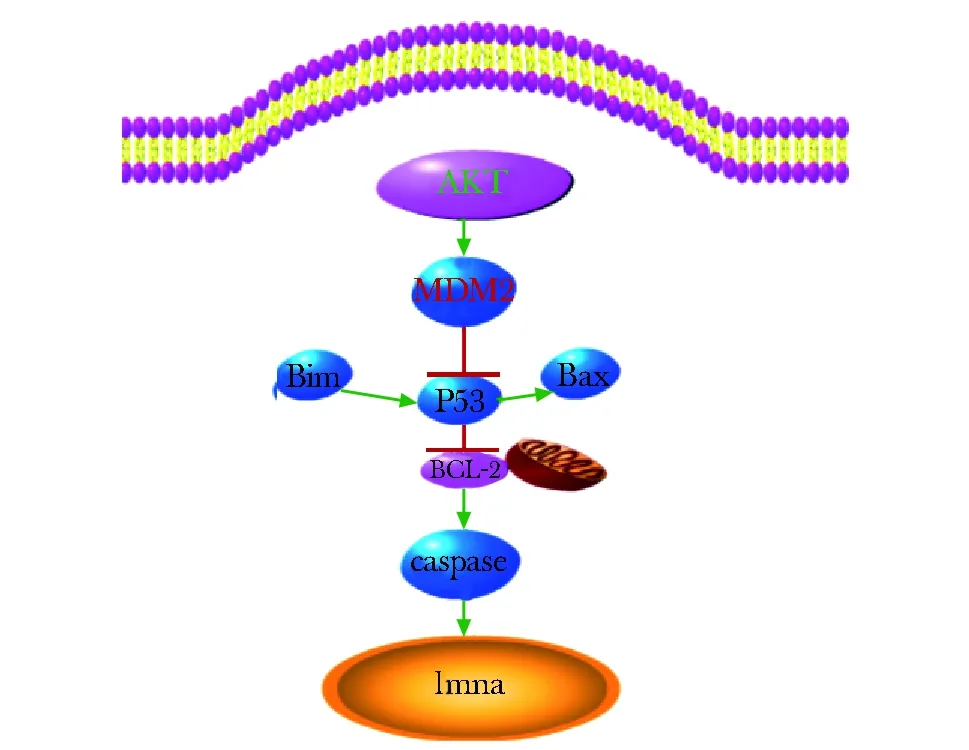
图6 与核纤层蛋白相关的AKT通路Fig 6 lmna and AKT pathway
