PFT-α与BMP- 2联合诱导大鼠BMMSCs分化为心肌样细胞
2018-08-08陈晓依王浩宇王海萍
陈晓依,王浩宇,吕 洋,王海萍*,孙 微,李 柔
(河北北方学院 1.基础医学院; 2.组织学与胚胎学教研室,河北 张家口 075000)
近年来,由动脉粥样硬化引起的缺血性心脏病的发病率逐年增高。目前主要有介入治疗和外科血运重建等治疗措施。这些措施能保护未受损的心肌细胞,但无法恢复梗死心肌细胞的功能。而干细胞移植为治疗缺血性心脏病带来了曙光。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)作为一种多能干细胞,由于取材容易,体外扩增能力强,并具有多向分化潜能而备受重视[1]。
p53 特异性抑制剂 PFT-α(p-fifty three inhibitor-alpha, PFT-α)最早应用于肿瘤药物毒不良反应的治疗。骨形态发生蛋白2(bone morphogenetic protein,BMP- 2)是在心脏的形成过程当中起重要作用的细胞因子,可以促进胚胎早期发育。本课题以PFT-α和BMP- 2联合诱导BMMSCs向心肌细胞分化为目的,比较其单独及联合诱导分化的效果,为干细胞移植治疗缺血性心脏病提供可参考性依据。
1 材料与方法
1.1 动物与试剂
清洁级3周龄SD大鼠25 g,雄性(北京华阜康生物科技股份有限公司,合格证号为:11401300053540)[2]。IMDM培养基、胎牛血清和胰蛋白酶等(Gibco公司);PFT-α和BMP- 2(Sigma公司);鼠抗CD29-PE/CD45-FITC/CD90-PE -CyTM7(BD公司);兔多克隆抗体心肌肌钙蛋白(cardiac troponin I,cTnI)、心肌连接蛋白(connexin43,Cx43)、兔单克隆抗体原肌球蛋白(tropomyosin,TPM)(Abcam公司);兔免疫细胞化学染色试剂盒(北京四正柏公司)。
1.2 方法
1.2.1 BMMSCs的分离纯化培养:麻醉后采用颈椎脱臼法处死大鼠,在无菌条件下取四肢长骨,IMDM冲出骨髓液过滤接种于无菌细胞培养瓶中,调整细胞浓度为1×1010个/L,置于细胞培养箱(37 ℃、体积分数为5% CO2)中培养。24 h后更换新的培养基,除去未贴壁的细胞,此后每72 h换液1次(计为P0代细胞),镜检当贴壁细胞汇合度达80%~90%时,进行第1次传代,胰蛋白酶消化,杂质细胞被去除。选增殖良好的P2代细胞增殖48 h后分为:1)对照组:仅加入基础培养基培养,3 d后换液;2)PFT-α组:加入5 mL终浓度为250 μg/L PFT-α的诱导培养基,3 d后将诱导培养基换为不含PFT-α的基础培养基中继续培养4周;3)BMP- 2组:加入5 mL终浓度为0.2 μg/L BMP- 2诱导培养基,3 d后将诱导培养基换为不含BMP- 2的基础培养基中继续培养4周;4)PFT-α和BMP- 2联合组:加入10 mL终浓度分别为250 μg/L PFT-α和0.2 μg/L BMP- 2诱导培养基,3 d后将诱导培养基换为不含诱导剂的基础培养基中继续培养4周。
1.2.2 表面联合标记物鉴定BMMSCs:将P4代细胞消化制备成悬液,调整细胞浓度1×1010个/L并均匀分装至5支5 mL离心管中,每管200 μL,分别加入荧光标记的CD29-PE、CD45-FITC、CD90-PE-CyTM7、CD29-PE+CD45-FITC+ CD90-PE-CyTM7抗体,4 ℃避光孵育30 min,PBS洗涤2次,用BD流式细胞仪检测。
1.2.3 免疫细胞化学检测BMMSCs:取各组培养4周后的细胞爬片,用PBS洗涤3次,4%多聚甲醛固定30 min,PBS洗涤后加体积分数3% H2O2-甲醇室温孵育10 min(避光),随后加枸橼酸盐缓冲液微波炉修复20~30 min,自然冷却,滴加适量非特异性染色阻断剂室温15 min,分别加cTnI、Cx43及TPM抗体(浓度均为1∶100),放于湿盒中4 ℃孵育过夜(阴性对照组用PBS代替)。空白对照用PBS代替,其他步骤按试剂盒说明操作,最后苏木素复染,盐酸乙醇分化,脱水透明,中性树胶封片晾干,光镜下观察。各组随机选取8张载玻片,光镜下,每张载玻片均随机选取5个不同区域视野,得到的结果用Image-Pro Plus 6.0图像分析软件进行分析。
1.2.4 免疫荧光检测BMMSCs:收集相应细胞,开始步骤同免疫组化,非特异性染色阻断后,加Cx43单克隆抗体放于湿盒中4 ℃孵育过夜(空白对照组用PBS代替)。PBS洗涤,加生物素标记的二抗室温孵育1 h;PBS洗涤,CY3标记的三抗室温孵育1 h;PBS洗涤,加cTnI单克隆抗体放于湿盒中4 ℃孵育过夜。PBS洗涤,FITC标记的二抗室温1 h,PBS洗涤,风干,用甘油封片并在激光扫描共焦显微镜下观察、拍照。
1.2.5 透射电镜观察:取各组诱导后培养至4周的细胞消化、离心,将上清液弃去,PBS冲洗1次,重复离心、冲洗2次,加入2.5%戊二醛使细胞形成团块于4 ℃条件下过夜;PBS洗涤3次,每次5 min;10%锇酸4 ℃条件下固定2 h;PBS洗涤3次,每次10 min;用50%、70%、80%、90%、100%丙酮梯度脱水, EMbed 812包埋剂进行包埋,超薄切片机切片,透射电镜下观察细胞内部结构。
1.3 统计学分析

2 结果
2.1 BMMSCs形态学变化
P0代细胞呈圆形或方形,在培养液中呈悬浮状态,折光性好(图1A)。诱导24 h后即可见细胞大部分贴壁,体积较小,形状不规则,相邻细胞伸出长短不一突起,且互连成片。诱导1周时,贴壁细胞体积增大,数量增多,大部分为长梭形,也有少量的三角形星形或多角形细胞,呈放射状向四周扩散(图1B)。诱导4周左右,细胞呈紧密排列的长梭形,形态基本一致,有“肌岛”样结构出现(图1C)。对照组细胞呈成纤维状(图1D)。
2.2 大鼠BMMSCs表面联合标记物的鉴定
CD45阳性率为0.3%, CD29阳性率为86.5%, CD90阳性率为84.7%(图2)。这一结果符合大鼠骨髓间充质干细胞特征。
2.3 免疫组织化学鉴定
诱导组细胞可见cTnI、Cx43及TPM均呈阳性表达,对照组为阴性。且PFT-α与BMP- 2联合诱导组阳性表达细胞较其他单独诱导组明显增多(图3),联合诱导组各标志物的积分吸光值(integral absorbance,IA值)均最高(P<0.05)(表1)。
2.4 免疫荧光检测结果
Cx43免疫荧光染色:胞质内表达呈红色,PFT-α组与BMP- 2组弱表达,PFT-α和BMP- 2联合组表达增强;cTn I免疫荧光染色:胞质内表达呈绿色,PFT-α组与BMP- 2组弱表达,PFT-α和BMP- 2联合组表达增强(图4)。

A.freshly isolated BMMSCs; B.BMMSCs induced by PFT-α and BMP- 2 for 7 days; C.BMMSCs induced by PFT-α and BMP- 2 for 28 days; D.the fourth generation BMMSCs
图1倒置相差显微镜观察骨髓间充质干细胞
Fig1Invertedphasecontrastmicroscopetoobservemesenchymalstemcells(×100)

图2 骨髓间充质干细胞表面联合标记物的表达Fig 2 Positive expression of surface antigen of BMMSCs

图3 骨髓间充质干细胞经诱导后的免疫细胞化学染色检测结果Fig 3 Immunocytochemical staining of BMMSCs after induction(×400)

groupTPMCx43cTnIcontrol 1 602±218 1 788±209 1 596±194PFT-α35 283±2 037△27 439±2 695△29 106±2 143△BMP-240 574±1 989△26 486±2 508△24 973±2 216△combined48 329±2 189*△32 617±2 428*△33 269±2 214*△
*P<0.05 compared with BMP- 2 group;△P<0.01 compared with the control group.
2.5 透射电镜观察
透射电镜下观察诱导组细胞呈短圆柱状,位于细胞中央的核较大,单一,呈椭圆形或圆形;胞质内可见平行排列的肌丝、线粒体和糖原等,超微结构具有类心肌细胞样的特点(图5)。
3 讨论
近年来大量的动物实验及临床研究已经证明,急性心肌梗死后移植BMMSCs对改善患者的心肌缺血状态、促进心功能的恢复有一定的疗效。且BMMSCs在体外不同的诱导条件下可以向成骨细胞、软骨细胞、星形胶质细胞和心肌细胞等不同细胞系分化[3- 4]。而5-氮胞苷作为常见诱导剂可促进BMMSCs定向诱导分化为心肌细胞,但5-氮胞苷还是一种抗肿瘤药物,它的细胞毒性作用限制了其应用。故而,寻求一种更高效和安全地诱导剂是当前亟待解决的问题。本实验观察PFT-α和BMP- 2在体外分别及联合诱导BMMSCs向心肌样细胞分化的效果,为BMMSCs的深入研究和临床应用提供思路及方法学基础。

图4 诱导组细胞常规培养4周时cTnI和Cx43免疫荧光表达
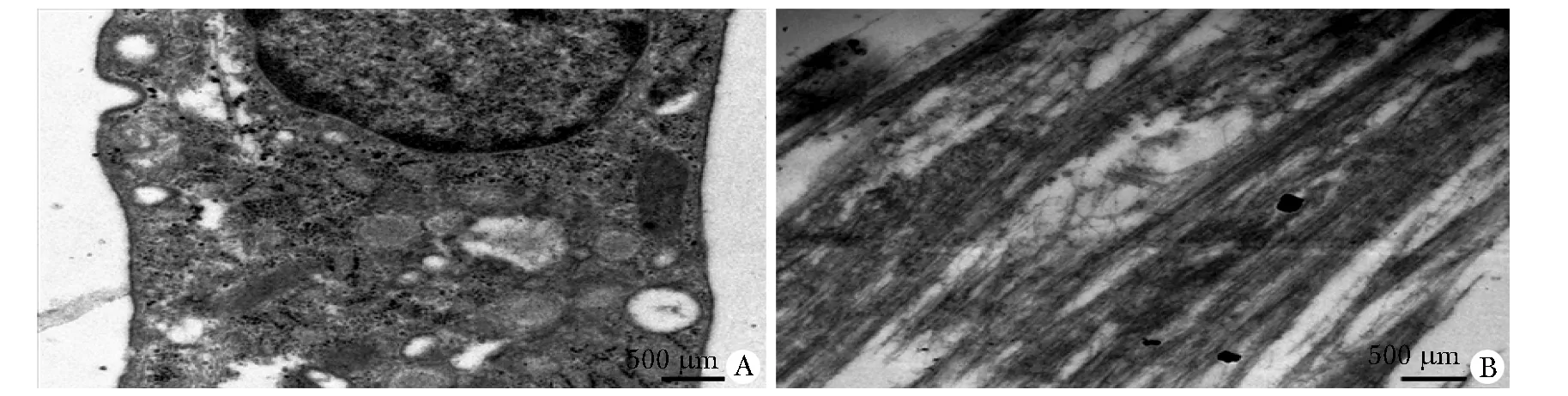
A.the cytoplasm is rich in organelles,showing mitochondria, glycogen, and a small amount of lipid droplets(×8 000); B.large number of paralleled myfilament could be seen in the plasm(×6 000)
图5骨髓间充质细胞经诱导4周后的透射电镜观察结果
Fig5ObservationofBMMSCsafter4weeksofinductionbytransmissionelectronmicroscopy
实验中免疫组化法检测cTnI、Cx43和TPM的表达,而cTnI是cTn的3个亚单位之一,仅于正常心肌中存在,在心肌收缩中调节粗、细肌丝间的相对滑行,实验中cTnI的表达意味着诱导细胞已具有心肌细胞最基本的收缩功能。Cx43是形成心肌间隙连接重要的蛋白之一,它的正常表达不仅能维持间隙连接通道电偶联正常的功能,还能保持心脏正常电活动与协调舒缩。TPM是肌肉收缩过程中重要的调节蛋白,由2条平行的多肽链扭成螺旋,与肌动蛋白结合,其主要作用是加强和稳固肌动蛋白丝,阻止肌动蛋白与肌球蛋白结合[5]。
研究人员已证实 BMMSCs 在体外经 PFT-α诱导可分化为心肌样细胞,该种细胞已初步具有心肌细胞的类似结构和功能特征。而BMP- 2作为单一诱导剂,检测了BMMSCs向心肌样细胞的平均分化率为17.9%[6]。说明作为一种天然的多功能蛋白,BMP- 2对BMMSCs的诱导分化效率较好,对细胞的毒性小,是较理想的诱导剂。本实验各组诱导培养4周后,部分细胞已分化为心肌样细胞,而正常对照组为成纤维细胞样,且联合诱导组阳性表达细胞数量及各标志物的IA值均最高,差异具有统计学意义(P<0.05),说明联合诱导效果更好,与免疫荧光检测结果一致。对诱导组透射电镜观察可见细胞胞质有散在肌丝样结构,证实了诱导的有效性。流式细胞计量术鉴定结果表明,经传代培养增殖的细胞为纯化的BMMSCs。
综上所述,PFT-α和BMP- 2均可单独诱导BMMSCs分化为心肌样细胞,且两者联合应用更加高效、安全,这为推动BMMSCs移植应用于治疗缺血性心脏病提供思路和方法学基础。
