一种N取代靛红衍生物对肝癌细胞的作用及机制
2018-08-08何静宇
何静宇,赵 翔,张 页
(北京大学 基础医学院 细胞生物学系, 北京 100191)
靛红(isatin)是一种天然产物,靛红及其衍生物具有多种生物活性,尤其在抗肿瘤方面凸显作用[1]。靛红衍生物3MCIC是本实验室之前合成的有效抗癌药物[2]。靛红衍生物 IF203 通过线粒体途径诱导人肝癌 HepG2 细胞凋亡[3]。2013年合成的邻硝基苯基靛红查尔酮不仅自身有强抗癌活性,而且与不同药物联用具有特异的协同或拮抗效果[4]。靛红衍生物 IF239对鼻咽癌细胞的增殖抑制作用显著,其作用机制独特,具有潜在应用前景[5]。因此,合成新型的靛红衍生物是开发有效抗肿瘤药物的重要途径。肝癌是中国常见的肿瘤之一,2010年以来肝癌占全国癌发病率的第3位。肝癌对已知放、化疗敏感性很低,寻找新的药物更具挑战[6]。本实验室利用靛红为基准合成1种新型的N取代靛红衍生物(3MMIS),实验显示其对肝癌细胞具有较强的杀伤作用,为这种新型药物的开发利用提供了有利的实验依据。
1 材料与方法
1.1 材料
细胞系:人肝癌HepG2、BEL-7402、小鼠乳腺癌4T1和人胎肝L02细胞系(北京大学医学部医学细胞生物学系保存);RPMI-1640培养基(Gibco公司);胎牛血清(Israel Beit Haemek公司);Anti-calnexin(BD Biosciences公司); Anti-cyclin D1、Anti-c-Myc(ZSGB-BIO公司);Anti-cyclin A、 Anti-cyclin E和Anti-E2F1(Santa Cruz Biotechnology公司); β-Tubulin、单丹磺酰戊二胺(Sigma公司);PNPP(Amresco公司)。
1.2 方法
1.2.1 酸性磷酸酶法(APA)检测药物对肿瘤细胞的增殖抑制作用:取对数增殖期的HepG2、4T1、7402和L02细胞系等,制成细胞悬液,待其贴壁。用 3MMIS配制成母液,经培养液稀释,再倍比稀释成10、5、2.5、1.25、0.625和0.313 mg/L等不同浓度的溶液。利用含不同稀释浓度3MMIS的RPMI-1640培养基,按体积比1∶1的量,分别加入预先贴壁培养24 h、处于对数增殖期的正常人肝细胞及多种人肿瘤细胞的96孔板中,混匀后于37 ℃培养。用酸性磷酸酶法(APA)检测细胞增殖率,在酶标仪测量405 nm波长的吸光度值(A)。按下式计算N取代靛红衍生物作用下的细胞百分活率:细胞百分活率=(A实验孔平均值÷A溶剂对照组平均值)×100%
1.2.2 光镜下观察细胞形态:取对数增殖期的HepG2细胞,消化重悬后接种于6孔板中,每孔加3 mL细胞悬液(2×105个细胞/孔)。接种24 h后,向各孔中加入3 mL含3MMIS的培养液,终浓度分别为0.5和1 mg/L,继续于37 ℃培养不同时间段。倒置光学显微镜下观察HepG2细胞形态的变化。
1.2.3 相关蛋白表达的检测:接种对数期增殖的细胞,待增殖约汇合70%~80%时,以终浓度分别为0.5和1 mg/L的3MMIS作用细胞12、24和48 h,回收全部细胞到1.5 mL离心管中,BCA法蛋白定量,加入上样缓冲液制作成上样样品。每个样本孔加入40 μg蛋白,行10% SDS-PAGE凝胶电泳,电转至NC膜,5%脱脂牛奶封闭 50 min,依据抗体工作浓度孵育一抗,4 ℃孵育过夜。第2天TBST洗涤3次,二抗(1∶5 000)孵育1 h,TBST避光洗涤3次,化学发光液充分和均匀地浸润硝酸纤维素膜进行发光, X射线胶片曝光1~15 min。将胶片显影和定影。
1.2.4 微管组装水平检测:取对数增殖期的细胞,用胰蛋白酶消化后,制成细胞悬液。按8×107个/L的浓度接种于大培养瓶中,培养24 h。待细胞完全贴壁后,实验组加入经二甲基亚砜溶解后再经RPMI-1640培养液稀释至不同浓度的3MMIS;以紫杉醇作为抑制微管解聚的对照;以秋水仙素作为抑制微管聚合的对照,溶剂对照组加入0.1% DMSO。培养12 h后,收集细胞加入200 μL低渗细胞裂解液,混匀后常温裂解2 min,25 ℃ 12 000 r/min,离心6 min,收集上清,加入SDS-PAGE上样缓冲液即为含游离微管蛋白的样品;沉淀加入1×SDS-PAGE上样缓冲液200 μL,于离心管中用聚乙烯研棒手动碾磨,即为含聚合微管蛋白的样品。上清与沉淀样品煮沸后,经SDS凝胶电泳,转膜,Western blot检测β-tubulin蛋白的改变。
1.2.5 细胞周期检测:接种对数增殖期的细胞,待细胞汇合70%~80%时,以终浓度0和1 mg/L的3MMIS分别作用于细胞6、12、24和48 h后,收集全部细胞,经过70%乙醇固定,细胞筛过滤,PBS清洗,PI染色后利用流式细胞仪检测并分析。
1.2.6 自噬小体荧光染色:将HepG2细胞接种于预先放有盖玻片的24孔板中,每孔1 mL细胞悬液(含有5×104个细胞)培养24 h。向各孔中分别加入终浓度为0和1 mg/L的3MMIS,继续于37 ℃培养4和24 h。终止细胞培养,吸去培养基,用预温的PBS冲洗3次,0.05 nmol/L单丹磺酰戊二胺(monodansylcadaverine)37 ℃染色10 min,PBS冲洗4次,加入防淬灭剂,荧光显微镜下观察细胞情况并拍照。
1.3 统计学分析
2 结果
2.1 药物结构
本实验室利用靛红为基础,在N位进行取代衍生合成3MMIS(图1)。

图1 3MMIS的化学结构Fig 1 Chemical structure of 3MMIS
2.2 酸性磷酸酶法(APA)测定3MMIS的体外抗肿瘤活性
药物作用48 h后,酸性磷酸酶法测定细胞的存活率,与阴性对照组比较,通过GraphPad Software Prism 6.0软件,显示在不同浓度的N代靛红衍生物作用下肿瘤细胞的存活百分率剂量反应曲线。可以看出3MMIS对人肝癌HepG2和7402细胞、小鼠乳腺癌4T1细胞都显示较好抑制活性,而对人胎肝L02细胞毒性相对较小(图2)。对L02、HepG2、4T1、7402细胞的IC50为1.5、0.43、0.56和0.36 mg/L。
2.3 镜下观察3MMIS作用下HepG2细胞的形态变化
倒置相差显微镜下显示,对照组细胞增殖状况良好,铺展均匀,呈扁平多边形,细胞连接紧密。与对照组相比,0.5 mg/L浓度的3MMIS作用下HepG2细胞在6 h出现少量细胞变圆,在12 h变圆数量进一步增多,在24 h基本全部细胞都变圆并且出现细胞碎裂伴随囊泡出现,变圆比例接近100%(图3)。

图2 药物3MMIS作用于3种肿瘤细胞系和人胎肝细胞48 h的增殖抑制剂量曲线图Fig 2 Effect of 3MMIS on the proliferation of three tumor cell lines and human fetal hepatocytes for 48 hours

图3 光学显微镜下显示3MMIS对HepG2细胞的形态影响Fig 3 Morphological changes in 3MMIS treated HepG2 cells were observed under a light microscope(×200)
2.4 3MMIS作用下细胞周期相关蛋白的变化
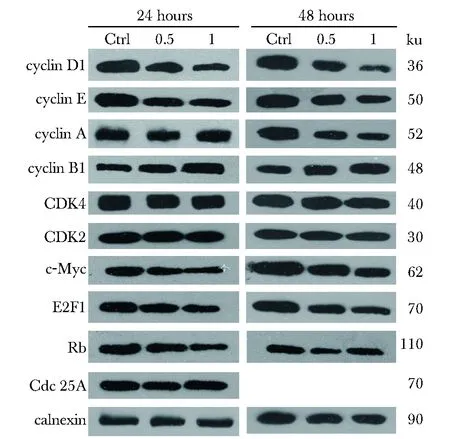
图4 3MMIS作用下细胞周期相关蛋白的变化Fig 4 Changes of cell cycle related proteins under the action of 3MMIS
分别取1和0.5 mg/L的3MMIS作用于HepG2细胞24和48 h,检测相关周期蛋白的水平(图4)。3MMIS作用下在24和48 h,cyclin B1持续增多。Cyclin D1、 cyclin E、 E2F1、 Rb、 c-Myc显著下调。Cyclin A在24 h变化不明显,在48 h显著下调。Cdc25A、CDK4、CDK2无明显改变。
2.5 微管组装水平变化
分别以3MMIS(0.5和1 mg/L)、800 nmol紫杉醇(PTX)和 100 nmol秋水仙素(Col)作用于体外培养的HepG2细胞12 h后, Western blot结果(图5)显示,与加入DMSO的对照组(Ctrl)相比,紫杉醇导致上清(S)中微管蛋白明显减少,裂解液沉淀(P)中聚合微管蛋白明显增多;秋水仙素抑制微管聚合,裂解液上清中可溶的微管蛋白增多;3MMIS作用下与对照组相比,沉淀中聚合的微管蛋白减少,上清中游离的微管蛋白相应增多,可溶性微管蛋白与聚合微管蛋白的比值增加,表明3MMIS可减少微管的聚合(图5)。
2.6 流式细胞术检测细胞周期
用3MMIS作用于体外培养的HepG2细胞6、12、24和36 h,分别收集细胞,观察对细胞周期的影响。结果显示,随着药物作用时间的延长,肿瘤细胞被阻滞在G2/M时期的比例不断增多,在药物作用12、24 h阻滞比例高达83.7%以上(图6)。
2.7 3MMIS对细胞自噬的影响
分别以0.5和1 mg/L的3MMIS作用于HepG2细胞12 h,检测3MMIS对细胞自噬相关蛋白p62的影响。与对照组相比,3MMIS作用下,p62蛋白明显减少,高浓度作用下更明显(图7A)。单丹磺酰戊二胺荧光染色法检测3MMIS对自噬的影响。与对照相比,1 μg/mL的3MMIS作用于HepG2细胞4 h自噬小体明显增多(图7B)。
3 讨论
靛红衍生物由于其低毒性的特点近年来成为研究抗肿瘤的热门方向。N-烯丙基靛红可以抑制肿瘤细胞增殖,诱导细胞周期阻滞,通过线粒体相关途径促进HepG2细胞凋亡[7]。多种N取代靛红衍生物可以通过抑制醛脱氢酶从而达到抑制肿瘤干细胞的作用,为研发抗肿瘤药物提供新的思路[8]。二溴化N-烷基靛红衍生物和母体化合物5,7-二溴靛红通过促进微管解聚,诱导肿瘤细胞凋亡而达到抑制肿瘤细胞生长的作用[9]。
以微管为靶点的抗肿瘤药物是现今抗肿瘤药物研究的重要领域,抗微管药破坏微管的动力学,促进或者抑制微管的聚合, 从而引起肿瘤细胞纺锤丝形成障碍,使肿瘤细胞产生周期阻滞诱导其死亡。有丝分裂灾难是指在细胞分裂时期,由于分裂异常,DNA损伤和纺锤体形成障碍时产生的一种细胞死亡方式,常常伴随有四倍体或者异倍体出现。有丝分裂灾难大多伴随细胞G2/M期的周期阻滞,大多数细胞体积变大,变大细胞内出现多个核和凝集的染色质[10]。抗微管药能够诱导肿瘤细胞发生有丝分裂灾难已被证实,并越来越受到人们关注。
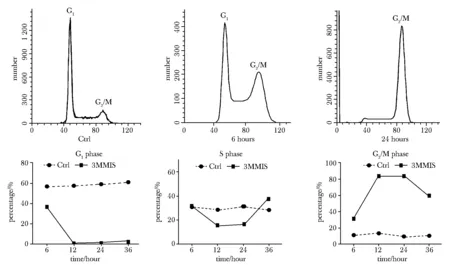
图6 3MMIS作用于HepG2细胞不同时间点的流式分析结果和相对应的时间曲线图Fig 6 3MMIS flow analysis results at different time points of HepG2 cells and corresponding time plots

A.effect of 3MMIS on autophagy-associated protein p62; B.immunofluorescence observation of changes in autophagy vesicles(×100)
图73MMIS作用下自噬蛋白p62含量变化和免疫荧光观察细胞中自噬小泡变化
Fig7Changesofautophagyproteinp62andautophagyvesiclesundertheactionof3MMIS
经典药物紫杉醇可抑制微管蛋白解聚。其作用机制可能是通过扰乱细胞有丝分裂和细胞分裂间期的微管体系,促进细胞发生有丝分裂灾难和死亡[11]。据文献报道阿霉素作用于人类白血病细胞,在体外实验中用低剂量作用后,Jurkat细胞出现G2/M期阻滞, cyclinB1、cyclinA和cyclinD1蛋白表达量升高,进而出现有丝分裂灾难并诱导细胞发生凋亡[12]。用reversine作用于K562细胞,引发肿瘤细胞发生有丝分裂灾难和凋亡[13]。自噬是一种进化上相对保守的分解代谢过程,是细胞应对胞内或胞外应激的一种重要机制[14]。本实验室合成的新型抗微管药物N取代靛红衍生物3MMIS可以减少微管聚合,将HepG2细胞阻滞在G2/M期,并诱导HepG2细胞发生自噬。
