血脂康对OX-LDL诱导巨噬细胞组织因子(TF)表达的影响及相关机制
2018-08-06杨亚兵刘梅林
杨亚兵,刘梅林
(1.北京市仁和医院心血管内科,北京 102600;2.北京大学第一医院老年科,北京 100034)
巨噬细胞吞噬氧化型低密度脂蛋白(ox-LDL)可导致氧化应激、炎症因子分泌及组织因子(TF)的表达,形成泡沫细胞,在动脉粥硬化性疾病中起着重要作用[1]。血脂康是特制红曲,含有洛伐他汀及其同系物,同时还富含有不饱和脂肪酸、黄酮类物质、麦角甾醇、生物碱等多种生物活性物质[2]。大规模的临床试验中国冠心病二级预防研究(China coronary secondary prevention study CCSPS)证实,血脂康能显著降低冠心病患者非致死性心肌梗死及冠心病死亡的发生率,减少对PCI和(或)CABG的需求,同时减少肿瘤死亡和各种原因的总死亡[3]。与4S、CARE和LIPID 等国外的冠心病二级预防试验相比,CCSPS虽然TC和LDL-C降低的幅度较小,但在降低总死亡率、冠心病事件的发生率以及减少对PCI和CABG需求方面的疗效有明显优势,提示血脂康具有独立于降脂的心血管保护作用[3]。大量的研究表明,血脂康还具有抗炎、抗氧化、保护内皮功能、改善斑块稳定性等心血管保护作用。然而血脂康是否对巨噬细胞MDA含量、SOD活性、组织因子表达及P65表达和转位的影响及相关机制尚不清楚。
1 材料与方法
1.1 主要试剂与药物
氧化型低密度脂蛋白(ox-LDL)由北京协和医科大学提供;血脂康原粉由北大维信公司提供;洛伐他汀(Sigma公司 美国);特级胎牛血清(Gibico公司 美国);MTT试剂盒(南京凯基生物有限公司);丙二醛(MDA)试剂盒(南京建成生物工程研究所);总抗氧化能力(T-AOC)试剂盒(南京建成生物工程研究所);RPMI 1640(Hyclone公司 美国);0.25%胰蛋白酶(南京凯基生物有限公司);DMSO(Sigma公司 美国);FITC标记的兔二抗(Santa Cruz公司);青霉素、链霉素双抗(南京凯基生物有限公司);山羊血清(北京中杉金桥生物技术有限公司);TF Rabbit Polyclonal Antibody(Santa Cruz,American);P65 abbit Polyclonal Antibody(Santa Cruz,American);β-actin Mouse Monoclonal Antibody(Santa Cruz,American)。
1.2 细胞株
小鼠巨噬细胞白血病细胞株(RAW264.7)由南京凯基生物有限公司提供。
1.3 仪器
CO2恒温培养箱(日本ESPEC 公司);IMT212倒置相差显微镜(日本Olympus公司); BH22型光学显微镜(日本Olympus公司);荧光显微镜(日本Olympus公司);细胞培养超净工作台(北京嘉创博远净化科技有限公司);UNICO2100UV紫外/可见光分光光度计(上海尤尼科仪器有限公司);电热恒温水浴箱(上海尤尼科仪器有限公司);电热恒温水浴箱(北京迈瑞达科技有限公司)。
Olympus FV 1000激光共聚焦显微镜(日本Olympus公司)。
1.4 方法
1.4.1 RAW264.7 P65细胞的培养
巨噬细胞在含有10%胎牛血清的RPMI1640培养基中培养,24~28 h换培养液一次,48~72 h传代。待巨噬细胞处于对数生长期且形成致密融合单层后分组处理以备实验使用。并使用MTT实验证实各实验组药物对细胞存活率没有影响。
1.4.2 实验分组
实验共分6个组,每组设6个复孔:(1)空白组(control),RPMI1640培养液(2)ox-LDL组,细胞培养液中加入50 μg/mlox-LDL;(3)洛伐他汀组(L),细胞培养液中加入50 μg/ml ox-LDL及10 μmol/ml洛伐他汀;(4)血脂康低剂量组(XZK25),细胞培养液中加入50 μg/ml ox-LDL 及25 μg/ml血脂康;(5)血脂康中剂量组(XZK50),细胞培养液中加入50 μg/ml ox-LDL 及50 μg/ml血脂康;(6)血脂康高剂量组(XZK100),细胞培养液中加入50 μg/ml ox-LDL 及100 μg/ml血脂康。各组均孵育48小时。
1.4.3 细胞培养上清MDA及SOD活性检测
各组细胞培养48小时,收集各组细胞培养上清液,-70℃保存。根据试剂盒的说明,检测各组细胞培养上清中MDA含量和SOD活性。
1.4.4 western blot 检测TF表达
各实验组实验终点时收集细胞,经PBS洗涤3次,加入悬浮细胞裂解液裂解细胞,置于冰上20 min厚,于4℃,13000 g离心20 min,小心吸出上清液,Bradford法检测蛋白浓度,100 µg蛋白/泳道加入等体积2×SDS凝胶加样缓冲液,混匀,煮沸5~10 min使蛋白变性,趁热12000 rpm离心5 min,然后按预定顺序加样。80 V积层胶,120 V分离胶,电泳分离蛋白质,200 mA 2 h转膜.5%脱脂奶粉封闭4 h,加入一抗,4℃ 8 h,PBST洗膜3次,每次15 min;加入辣根过氧化物酶标记的二抗孵育1 h,PBST洗膜3次,每次15 min。用增强化学发光剂(ECL)进行化学发光后条带放入Alpha ImagerTM 2200图像分析处理系统,利用Alpha Ease 40分析软件,电脑直接扫描测定显影条带积分光密度值,条带的积分光密度值(IDV)即表示蛋白的表达量,计算每份样本中目的蛋白的相对表达量(TF/β-actin)。
1.4.5 免疫荧光检测P65表达以及其细胞核转位情况
将细胞传至预先放入盖玻片的6孔细胞培养板中,待细胞长至80%以上。继续培养48小时,弃培养液上清,用PBS洗3次,4%多聚甲醛固定30分钟,用PBS洗3次,每次5分钟,再用3% H2O237℃孵育30分钟,PBS洗3次,每次5分钟,山羊血清37℃封闭30分钟,加入P65一抗(1:50),4℃孵育过夜,加入FITC标记的兔二抗(1:50)室温暗盒内孵育2小时,用PBS洗3次每次3分钟,然后滴加PI染料,室温孵育5分钟后再用PBS洗3次每次3 min,立即激光共聚焦显微镜下观察并采集图片。
1.5 统计学处理
使用SPSS 13.0统计软件对数据进行分析,计量资料以均数±标准差(x±SD)表示,采用Levene法进行方差齐性检验。方差齐时组间差异采用one-way ANOVA检验,采用LSD法进行组间两两比较;方差不齐时组间差异采用Kruskal-Wallis H检验,组间两两比较采用Mann-Whitney U法。P<0.05为差异有统计学意义。
2 结 果
2.1 各种药物干预组细胞培养上清MDA水平和SOD活性的影响
2.1.1 各组细胞MDA水平的影响
与空白对照组比较,o x-L D L刺激可显著增加RAW264.7培养上清中MDA水平(P<0.05)。洛伐他汀和血脂康均可降低RAW264.7培养上清中MDA水平(P<0.05)。血脂康对上清中MDA的抑制呈明显的剂量依赖性。低剂量血脂康对上清中MDA的抑制作用弱于洛伐他汀(P<0.05),中剂量和高剂量对MDA的抑制作用均强于于洛伐他汀(P<0.05)。结果见图1。

图1 各种药物干预对ox-LDL诱导的RAW264.7培养上清中MDA的影响
与对照相比,*P<0.05;与模型组相比,**P<0.05;与洛伐他汀组相比,***P<0.05。
2.1.2 各组细胞SOD活性的的影响
与空白对照组比较,ox-LDL可显著抑制RAW264.7培养上清中SOD活性(P<0.05)。洛伐他汀和血脂康均可升高RAW264.7培养上清中SOD活性(P<0.05)。血脂康增加细胞培养上清中SOD活性的的作用呈明显的剂量依赖性。低剂量和中剂量血脂康对细胞培养上清中SOD活性的增加作用与洛伐他汀组无统计学差异,高剂量血脂康对SOD活性的增加作用强于于洛伐他汀(P<0.05)。结果见图2。

图2 各种药物干预对ox-LDL诱导的RAW264.7培养上清中SOD活性的影响
与对照相比,*P<0.05;与模型组相比,**P<0.05;与洛伐他汀组相比,***P<0.05。
2.2 各组细胞TF表达的影响
与空白对照组比较,o x-L D L刺激可显著增加RAW264.7细胞TF表达(P<0.05)。低剂量和中剂量血脂康及洛伐他汀对RAW264.7细胞TF的表达无明显作用。高剂量血脂康可显著抑制ox-LDL诱导RAW264.7细胞的TF表达(P<0.05)。结果见图3。
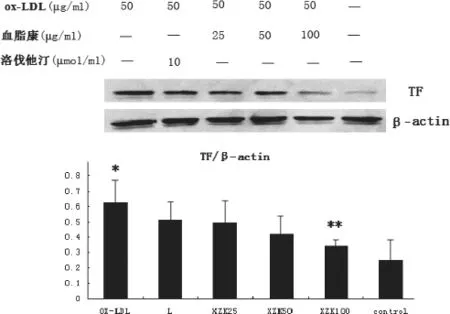
图3 各种药物干预对ox-LDL诱导的RAW264.7组织因子表达的影响
与对照相比,*P<0.05;与模型组相比,**P<0.05;与洛伐他汀组相比,***P<0.05。
2.3 免疫荧光检测各组药物对P65表达及其向细胞核转位的影响
免疫荧光检测各种药物对P65表达影响的结果并采用图像分析软件对细胞和细胞核P65表达统计分析结果见图4。与空白对照组比较,ox-LDL刺激可显著增加P65在RAW264.7细胞以及细胞核内的表达(P<0.05)。洛伐他汀和血脂康均可降低P65在RAW264.7细胞以及细胞核内的表达(P<0.05)。血脂康对P65在RAW264.7细胞以及细胞核内表达的抑制作用呈剂量依赖性。低剂量血脂康对P65在RAW264.7细胞以及细胞核内的表达抑制作用弱于洛伐他汀(P<0.05),中剂量和高剂量对P65在RAW264.7细胞以及细胞核内的表达抑制作用均强于于洛伐他汀(P<0.05)。

图4 各种药物干预对ox-LDL诱导的RAW264.7 P65表达的影响。A P65在全细胞内的表达情况;BP65在细胞核内的表达情况。
与对照相比,*P<0.05; 与模型组相比,**P<0.05;与洛伐他汀组相比,***P<0.05。
3 讨 论
动脉粥样硬化斑块中的组织因子(TF)主要来源于巨噬细胞和泡沫细胞。巨噬细胞可摄取脂蛋白,使脂质在细胞内聚集,形成泡沫细胞,释放各种生物活性物质,在动脉粥样硬化的发生、发展过程中起重要作用[4]。斑块破裂导致富含有组织因子的巨噬细胞和泡沫细胞以及其坏死凋亡形成的微粒暴露于血流,激活凝血途径,形成血管内血栓[4]。
本课题用ox-LDL刺激巨噬细胞RAW264.7,模拟体内动脉粥样硬化的进程,探讨血脂康对ox-LDL诱导TF表达的影响以及相关机制。在本研究中,通过检测细胞培养上清中MDA含量和SOD活性评价细胞的氧化状态。MDA是脂质过氧的产物,是公认的脂质过氧化损伤的标志。SOD是体内重要要的抗氧化酶,参与体内活性氧的清除。ox-LDL刺激使巨噬细胞RAW264.7培养上清中MDA含量增加,SOD活性降低,提示细胞氧化损伤增加。血脂康可明显降低巨噬细胞RAW264.7细胞培养上清中的MDA含量,增加其SOD活性,并呈剂量依赖性。血脂康对氧化损伤的改善作用强于洛伐他汀,推测与其含有不饱和脂肪酸、黄酮类物质、麦角甾醇、生物碱等活性物质有关。
ox-LDL刺激使巨噬细胞RAW264.7TF表达明显增加,血脂康下调ox-LDL诱导的TF表达增加。血脂康对TF表达的抑制作用成剂量依赖性,并强于洛伐他汀。文献报道,TF的表达与NF-κB、AP-1和Egr-1等转录因子的活性有关。NF-κB是由Rel蛋白家族中的两个成员构成的二聚体复合物,在TF表达调控中其重要作用。Rel蛋白的成员有:p65(RelA)、c-Rel、RelB、p50、p52等[5]。其中,c-Rel/P65是调控组织因子表达的主要NF-ΚB亚型。静息状态下,c-Rel/P65通常与NF-κB抑制蛋白单体(IκB)结合,以无活性状态存在于细胞质。在受到等刺激时,IκB迅速发生磷酸化,IκB与c-Rel/P65分离,c-Rel/P65移位于核内,与目的基因的启动子或增强子上特定的KB位点特异性结合,启动和调控基因的转录[6]。本课题用免疫荧光检测P65在巨噬细胞RAW264.7的表达以及其向细胞核转位的情况,探讨NF-κB在组织因子表达调控中的作用。实验结果显示,血脂康明显抑制P65的表达以及其向细胞核转位,提示血脂康具有抑制NF-κB激活的作用。活性氧(ROS)生成过多可以导致NF- κB激活,血脂康抑制NF-κB激活与其抗氧化作用密切相关。与洛伐他汀相比,血脂康抑制P65的表达以及其向细胞核转位作用更强。
小结,洛伐他汀相比,血脂康抑制巨噬细胞RAW264.7 TF表达作用更显著,与其具有更好的抗氧化,抑制P65表达及其向细胞核转位有关。
