巴马香猪诱导多能干细胞系的建立
2018-08-02孙文采汪进平李文玲
孙文采,吴 璐,汪进平,鲍 磊,李文玲*,崔 春
(1.浙江大学医学院附属第二医院,中国浙江杭州 310009;2.浙江大学动物科学学院,中国浙江杭州 310058;3.中国科学院生物化学与细胞生物学研究所,中国上海 200031;4.江南大学无锡医学院,中国江苏无锡 214122)
基于胚胎干细胞(embryonic stem cells,ES细胞)研究的反向遗传学手段对于遗传学、发育生物学有巨大的推动作用。自从1981年小鼠ES细胞建立之后[1,2],科学家们相继获得了猴子[3]、人[4]、大鼠[5~7]的ES细胞。多年来,科学界为建立猪ES细胞已付出了巨大的努力,但是到目前为止均没有成功获得猪的ES细胞[8~11]。随着2006年诱导多能干细胞(induced pluripotent stem cells,iPS cells)技术的出现[12],科研人员在体外可将已经终末分化的体细胞重编程为多能干细胞,使得建立猪的iPS细胞系成为热点。国内外多个研究组先后发表了猪iPS细胞系建立的成果[13~15],这些猪iPS细胞系在原代细胞的品系上既包括食用猪的体细胞,又包括小型猪——西藏小型猪和巴马香猪的体细胞。其中,作为近交系小型猪的巴马香猪遗传性状稳定、抗逆性和适应性强,是基础研究及临床医学研究的理想模式动物。但是Li等[16]建立的巴马香猪的iPS细胞系持续性表达外源转录因子,而持续表达的多能性外源因子会在一定程度上干扰细胞的分化,尤其是体内分化,相比之下,利用可诱导基因表达系统建立iPS细胞系可以在体内外调控外源基因的表达,具有更大的技术优势和实用性。目前,利用可诱导基因表达系统建立巴马香猪iPS细胞系的研究一直未被报道。
猪在肿瘤、心血管病、糖尿病、遗传病、营养代谢病、新药安全性评价等生物医药研究的众多领域中都是非常有用的实验动物,很大程度上促进了科学家对人类生理和病理知识的了解[17~20]。同普通食用猪相比,小型猪具有更快的生长周期和较小的体型,并且跟小鼠相比,小型猪在生理生化各项指标上更接近于人类,而跟猴子相比,小型猪的饲养成本非常低并且生长周期也短。在临床上小型猪作为模式动物研究心血管疾病及糖尿病等已经比较成熟[21~23]。对小型猪iPS细胞系进行基因定点修饰,可以克服体细胞基因打靶效率低的限制,同时可通过囊胚注射,以嵌合体的方式得到转基因动物[24,25],这样可为畜牧业发展及异种器官移植提供新的材料。为此,我们利用可诱导基因表达慢病毒系统(Tet-on系统)成功建立了巴马香猪iPS细胞系。Tet-on系统的采用不仅可以调控外源基因的表达,提高用于器官移植的转基因小型猪的安全性,也可以用于巴马香猪ES细胞培养体系的筛选,为巴马香猪ES细胞的建立提供了一种工具。
1 材料与方法
1.1 材料和试剂
1.1.1 细胞及质粒
巴马香猪原代骨髓基质细胞(bone marrow stromal cells,BMSCs)取自1月龄的巴马香猪的大腿股骨和胫骨骨髓。293T细胞为病毒包装细胞系,由同济大学裴刚教授惠赠。
携带外源因子 Oct4、Sox2、c-Myc和 Klf4的可诱导慢病毒载体由浙江大学干细胞与转基因动物实验室提供。
1.1.2 细胞培养
巴马香猪原代骨髓基质细胞的培养基组成:90%的DMEM培养液(货号12571,购自美国Invitrogen公司);10%的胎牛血清(fetal bovine serum,FBS,货号SH30396.03,购自美国HyClone公司)。
巴马香猪iPS细胞培养基组成:80%DMEM/F 12,20%knockout serum replacement,1 mmol/L谷氨酰胺,0.1 mmol/L β-巯基乙醇,1%非必需氨基酸。
细胞置于37℃、5.0%CO2饱和湿度的培养箱中培养。
1.2 实验方法
1.2.1 病毒制备
利用脂质体Fugene HD(Invitrogen公司,美国)将携带外源因子Oct4、Sox2、c-Myc和Klf4的慢病毒质粒分别和慢病毒包装质粒pVSVG、Δ8.91(美国Invitrogen公司)共同转染293T细胞,进行病毒的包装,然后分别在48 h、72 h收集病毒。取5 μL病毒感染1.5×105个293T细胞,48 h后4%多聚甲醛(paraformaldehyde,PFA)固定,进行DAPI染色,荧光显微镜下进行细胞计数,并计算病毒滴度(IU/mL),病毒滴度=荧光阳性细胞占总细胞数的百分比÷5×1.5×105×103。
1.2.2 巴马香猪BMSCs诱导生成iPS细胞
用携带 Oct4、Sox2、c-Myc、Klf4 的 4 种病毒共同感染巴马香猪原代BMSCs(8×105个),4种病毒等比例混合,MOI约10~20,同时加polybrene至终浓度10 μg/mL。感染24 h后,将巴马香猪的BMSCs用0.25%胰酶消化,传至6孔板。传代24 h后,培养基换成含1 μg/mL强力霉素(doxycycline,DOX)的iPS细胞培养基。感染12 d后挑干细胞克隆。将克隆一分为二,分别传到两个铺备小鼠滋养层细胞(上海斯丹赛生物技术有限公司)的96孔板中。取出其中一份进行碱性磷酸酶染色(Alkaline Phosphatase Substrate KitⅢ,购自美国Sigma公司)。保留AP阳性的细胞扩增,进行后续多能性的鉴定。
1.2.3 巴马香猪iPS细胞系多能性的鉴定
1)巴马香猪iPS细胞的表面标记物检测。将巴马香猪iPS细胞用4%PFA固定后进行免疫染色,所用到的一抗如下:anti-SSEA1(ascites,1︰500,Developmental Studies Hybridoma Bank,USA);anti-SSEA4(ascites,1︰400,Developmental Studies Hy-bridoma Bank,USA);anti-E-cadherin/CDH1(1︰100,美国BD公司);anti-Nanog(1︰150,美国R&D Systems公司);anti-Rex1(1︰200,美国Santa Crus公司);anti-Tra-1-81(1︰150,美国Chemicon 公司)。
2)实时荧光定量PCR(real-time PCR)检测多能干细胞基因的表达。提取巴马香猪iPS细胞的总RNA,RT-PCR(SYBR Green PCR Master Mix,购自日本Toyobo公司)检测多能干细胞特征性基因的表达。引物同Wu等[13]的报道。
3)亚硫酸氢钠测序法检测Oct4启动子区域甲基化程度。根据Chemicon公司的标准操作步骤,用Bisulphite处理基因组DNA,采用Bisulphite PCR,纯化PCR产物后,连接至T载体,随机挑选10个克隆进行测序。具体方法同已有报道[13]。
4)核型检测。巴马香猪iPS细胞送至湘潭市中心医院进行核型检测。
5)体外分化能力检测。将巴马香猪iPS细胞传入不贴壁的专用培养皿,用15%血清的DMEM培养,培养至3~4 d时,拟胚体(embryoid body,EB)开始形成。收集第8 d的EB,Trizol裂解后抽提RNA,反转录后,进行real-time PCR检测,分析各胚层标志性基因的表达。引物同Wu等[13]的报道。
6)体内分化能力检测。采用畸胎瘤形成实验检测细胞体内分化能力。将巴马香猪iPS细胞系传代培养至10代以上,消化后注射入NOD-SCID小鼠的后腿根部肌肉中,每个注射点的细胞量约为 4×106~5×106个,每个细胞系注射 3~5 只小鼠,4~6周后取出畸胎瘤,进行石蜡切片及HE染色。
2 实验结果
2.1 利用可诱导慢病毒系统建立巴马香猪iPS细胞
以慢病毒质粒Lv-EF1α-EGFP为骨架,将四环素启动子(tetO)插在EGFP的下游,并在tetO的下游分别插入人 Oct4、Sox2、c-Myc、Klf4 转录因子的cDNA,构建强力霉素(DOX)可诱导慢病毒系统(Tet-on系统)的组件之一(图1A);此外,将rtTA片段插入到慢病毒骨架EF1α下游,构成Tet-on慢病毒系统的另一组件(图1B)。
将上述质粒包装成慢病毒,混合后感染巴马香猪BMSCs,重编程过程见图1C:感染后第2 d传代至滋养层细胞上,并将成体细胞培养液(含10%FBS 的 DMEM)换成含 1 μg/mL DOX 的 iPS细胞培养液继续培养;感染后5 d出现人ES细胞样克隆;12 d挑克隆,进行后续鉴定。鉴定结果显示,成功建立了两株巴马香猪iPS细胞系,分别命名为biPS4-1和biPS4-2。
2.2 巴马香猪iPS细胞的形态学特征及多能性基因和标记物的表达
从形态上来看,巴马香猪iPS细胞类似于人类ES细胞(图2A)。克隆紧致且与周边滋养层细胞有明显边界,克隆内的细胞具有高核质比,细胞核内核仁也很大(图2B)。碱性磷酸酶染色结果显示,巴马香猪iPS细胞呈碱性磷酸酶阳性(图2C)。此外,巴马香猪iPS细胞系biPS4-1和biPS4-2可以不断传代,到目前为止,培养代数均超过30代。
免疫染色结果显示,巴马香猪iPS细胞与人类ES细胞表达相似的表面标记物,比如SSEA4、E-cadherin(CDH1)、Nanog、Rex1 和 Tra-1-81 都有表达,但不表达小鼠ES细胞的特异性表面分子SSEA1(图 2D~I)。
RT-PCR结果表明,相比巴马香猪BMSCs,巴马香猪iPS细胞系biPS4-1和biPS4-2的内源Oct4、Nanog和Sox2均有上调,且其他多能性因子,如DNMT3b、Lin28和E-cadherin的表达也发生了上调(图3A)。定量分析结果显示,biPS4-1和biPS4-2的多能性关键基因——内源性Oct4的表达上调达十多倍,而且内源性Nanog的表达也上调达 3~5 倍(图 3B)。
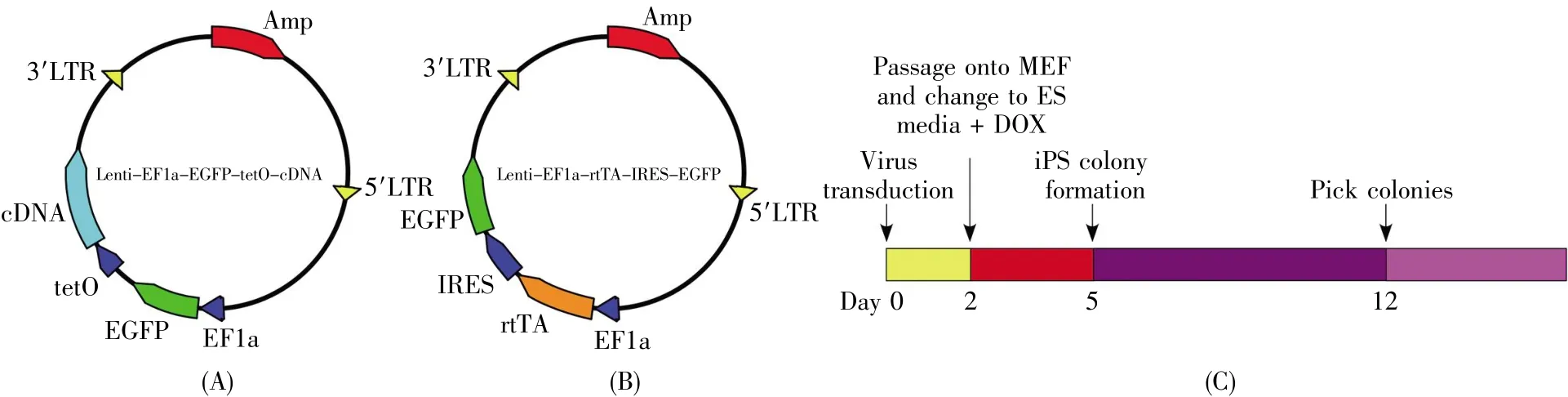
图1 巴马香猪iPS细胞系的建立过程Fig.1 The procedure of generating Bama mini-pig iPS cell lines.
巴马香猪iPS细胞系在DOX诱导外源基因表达时,能维持干细胞状态,然而撤去DOX 1 d后,外源基因的表达水平立即开始下调;撤去DOX 4 d后,外源基因的表达均显著下降,表达量仅为原来的百分之一左右(图3C,D)。从细胞的形态上来看,撤去DOX后4 d,iPS细胞分化严重,克隆边缘逐渐模糊,细胞核质比减少,克隆内细胞形态各异,不再均一。
2.3 巴马香猪iPS细胞的表观遗传学状态及核型
分析巴马香猪iPS细胞Oct4基因启动子区域的去甲基化程度发现,与BMSCs的高度甲基化相比,两株巴马香猪iPS细胞系的Oct4启动子区均高度去甲基化(图4A)。
我们还对获得的巴马香猪iPS细胞做了核型检测,结果显示其核型为38 XX(图4B),与Gustavsson[26]的研究结果一致,能用于后续的转基因研究。
2.4 巴马香猪iPS细胞的体内、外分化能力
巴马香猪iPS细胞在分化培养液中培养形成EB,收集第8 d的EB用于RT-PCR检测。结果显示,巴马香猪iPS细胞体外形成的EB表达外胚层标记基因NeuroD和GFAP,中胚层标记基因Osteonectin和Enolase,以及内胚层标记基因al-pha-anti-trypsin和AFP;而维持全能性的关键基因Oct4和Sox2的表达量急剧下降(图5A)。
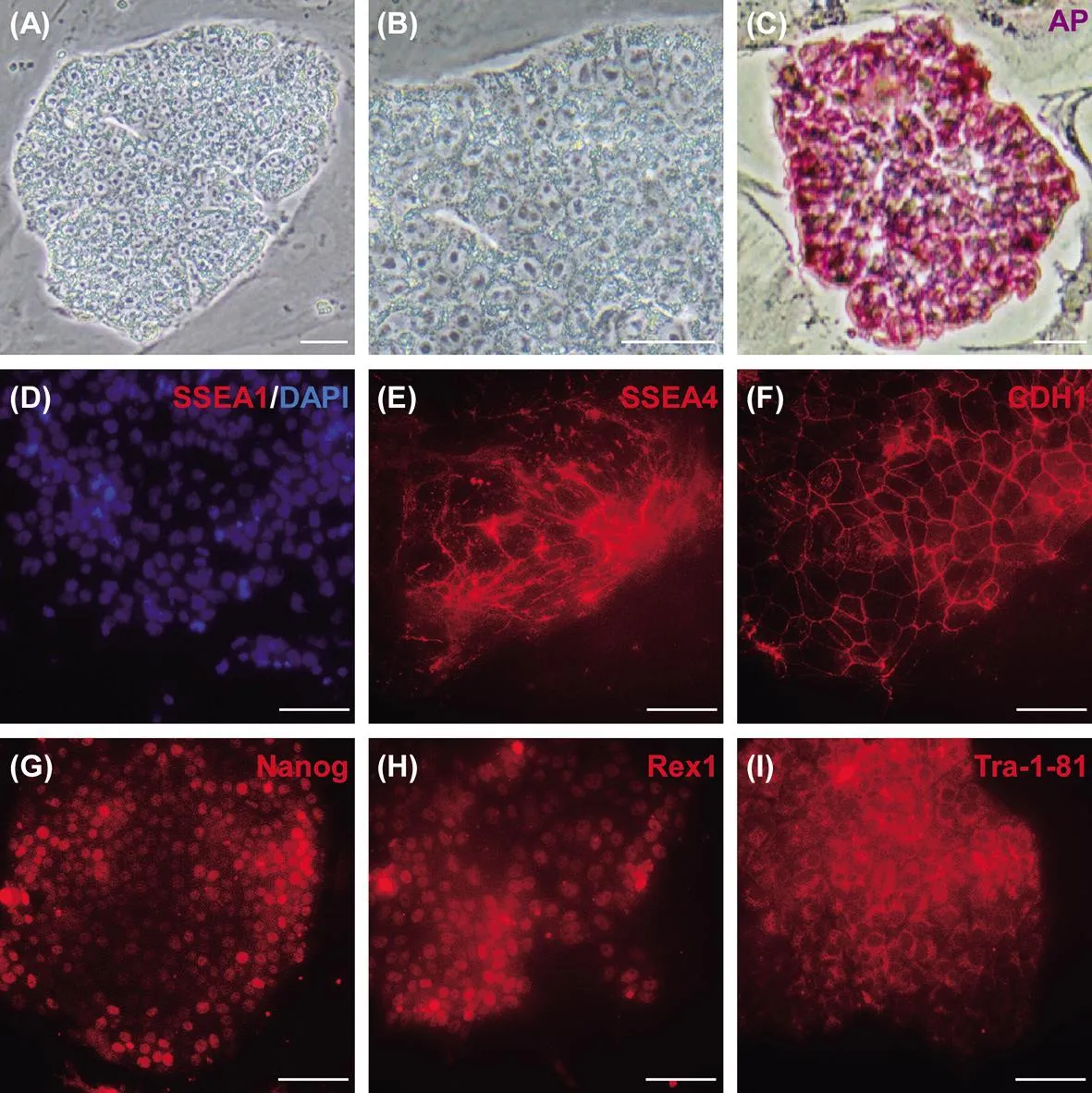
图2 巴马香猪iPS细胞形态特征及表面标记物(eScale bars:100 μm)Fig.2 The morphological characteristics and markers of Bama mini-pig iPS cells(eScale bars:100 μm)
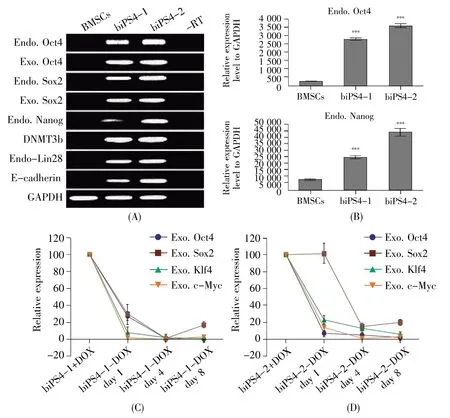
图3 巴马香猪iPS细胞内、外源多能性基因表达水平Fig.3 The expression of endogenous and exogenous pluripotent gene markers of Bama mini-pig iPS cells
两株巴马香猪iPS细胞均可在NOD-SCID小鼠体内形成畸胎瘤。石蜡切片HE染色显示,畸胎瘤中含有外、中、内三胚层的细胞或组织结构:外胚层结构可见鳞状上皮(图5B)、原始神经外胚层(图5C);内胚层结构可见肠样上皮组织(图5D);中胚层结构可见脂肪组织(图5E)。
以上结果表明巴马香猪iPS细胞在体外、体内均能分化成外、中、内3个胚层,全面验证了其具有多向分化的潜能。
3 讨论
由于猪在免疫学和生理学上与人类非常相似,其器官在解剖结构和生理生化特性方面也与人类很相近,且发生人猪共患疾病的可能性很小,所以猪是非常理想的人类疾病模型的模式动物,也是异种器官移植的首选供体动物。小型猪作为一类特殊品系的猪,其器官的大小更接近于人类,因此是目前最为理想的异种器官移植供体;其中作为近交系的贵州巴马香猪由于遗传性状稳定,其研究和开发利用更是受到生物医药界的普遍关注。但是由于猪ES细胞的长期缺乏,极大地限制了转基因猪模型的制备,使其在人类疾病模型、医药研发、药物评估及器官移植等方面的研究远落后于小鼠。
目前基因修饰猪的获得手段主要是通过体细胞基因打靶,然后采用体细胞核移植的方法获得。这个方法存在许多局限性,如体细胞在体外扩增能力的有限性及体细胞打靶困难。iPS技术的诞生为猪多能干细胞系及转基因猪的获得开拓了新的途径:首先利用iPS技术建立类似于ES细胞的iPS细胞,再通过基因打靶技术对iPS细胞进行高效基因打靶,进而通过胚胎嵌合技术,获得大批量的转基因猪。
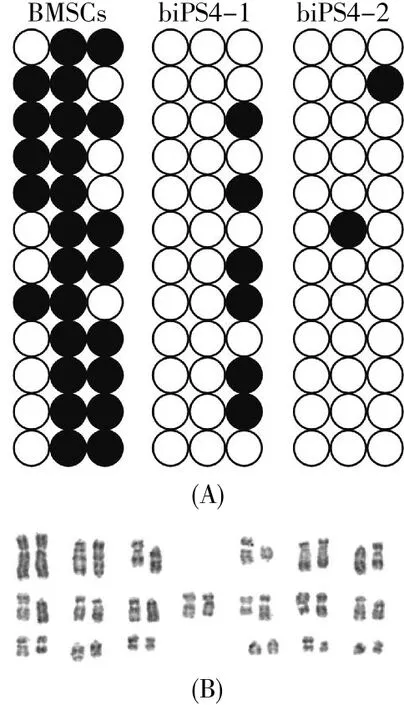
图4 巴马香猪iPS细胞系的表观遗传学状态及核型检测Fig.4 Epigenetic status and karyotype detection of Bama mini-pig iPS cells
我们基于Tet-on慢病毒系统介导Oct4、Sox2、c-Myc和Klf4四个因子在巴马香猪BMSCs内过表达,促使巴马香猪BMSCs重编程,建立了两株巴马香猪iPS细胞。所建立的巴马香猪iPS细胞能够在体外长期维持未分化状态并传代,具有类似于人ES细胞的形态特征和表面标记物。然而,我们建立的巴马香猪iPS细胞在撤去DOX后无法维持干性,会发生分化。究其原因,可能是内源的多能性因子Oct4、Nanog虽然表达上调:内源Oct4只上调十多倍,而Nanog只上调了3~5倍,上调的倍数十分有限;在巴马香猪iPS细胞目前尚无适宜培养条件的情况下,个别内源性多能因子的有限上调可能不足以维持其干性,或许还需要更为显著的表达上调或其他关键因子的同步激活。
相比于已有的Li等[16]建立的巴马香猪iPS细胞系的研究,本研究采用了不同的诱导载体——Tet-on慢病毒系统建立iPS细胞系,该系统为筛选生长因子或刺激猪多能干细胞自我更新的小分子提供了独特的平台,对于揭示猪多能干细胞维持自我更新的机制,并最终建立猪的ES细胞提供了理想的材料。此外,我们建立的巴马香猪iPS细胞系与Li等[16]报道的巴马香猪iPS细胞系表达不同的表面标记物:我们的biPS细胞不表达SSEA1,表达SSEA4;而Li等建立的巴马香猪iPS细胞则恰恰相反,表达SSEA1,可能是由于培养体系的不同或重编程程度不同,从而导致巴马香猪iPS细胞系表现出不同的特性。
综上所述,基于Tet-on系统建立的小型猪iPS细胞系有望服务于猪ES细胞系的建立,或直接用于高效建立转基因小型猪,为小型猪模型更好地服务于畜牧业及生物医药行业提供了一种较为理想的工具。
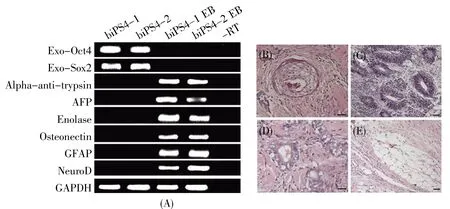
图5 巴马香猪iPS细胞体内、体外分化检测(eScale bars:50 μm)Fig.5 Bama mini-pig iPS cells can differentiate into all three germ layers both in vitro and in vivo(eScale bars:50 μm)