RNAi沉默FAK基因表达对人舌鳞癌细胞CAL-27凋亡和侵袭的影响*
2018-08-02廖晓颖吴妹娟康成容
陈 凯,廖晓颖,吴妹娟,康成容,潘 宣
(广东药科大学附属第一医院口腔科 510080)
舌鳞状细胞癌是口腔颌面部最常见的恶性肿瘤之一,同时也是最常见的口腔癌。由于其恶性程度高,浸润性强,易发生转移,所以关于舌鳞癌的基础研究和临床治疗一直以来都是口腔颌面外科及头颈外科的研究重点。黏着斑激酶(focal adhesion kinase,FAK)是一种非受体型蛋白酪氨酸激酶,已有的研究表明FAK在多种肿瘤组织中均存在着表达的上调,而且在一定程度上,其表达水平与肿瘤的恶化程度密切相关[1]。目前,有关FAK与舌鳞癌之间相关性的研究仍然较少,有必要进行更深入的研究。本实验采用RNA干扰(RNAi)技术研究FAK 基因表达水平对人舌鳞癌细胞凋亡和侵袭等细胞生物学行为的影响。
1 材料与方法
1.1材料 舌鳞癌细胞株CAL-27来自中山大学附属孙逸仙纪念医院口腔科李劲松教授的惠赠。 RNA提取试剂盒购于美国Tiangen公司;Opti-MEM 购于美国Gibco公司;LipofectamineTM2000 Transfection Reagent试剂盒购于美国Life Technologies 公司;胎牛血清购于杭州四季青公司;GoScript 反转录系统购于美国Promega公司;实时定量聚合酶链反应(qPCR)试剂盒购于美国Promega公司;兔抗人FAK单克隆抗体购于英国Abcam公司;matrigel基底胶购于美国BD公司;Annexin V-FITC/PI细胞凋亡试剂盒购于南京凯基生物有限公司。
1.2方法
1.2.1FAK SsiRNA的设计及合成 根据GenBank数据库提供的人FAK基因序列,遵从在线siRNA设计的相关原则,设计了1对siRNA-NC作为阴性对照序列和3对实验siRNA序列:siRNA-1、siRNA-2、siRNA-3(表1)。所有序列经BLAST分析确定特异性后,由广州赛哲生物科技股份有限公司合成,纯化。
1.2.2引物的设计及合成 设计FAK的引物及内参GAPDH 引物各1对(表2),由广州赛哲生物科技股份有限公司合成。
1.2.3细胞培养、转染及分组 复苏保存于液氮中的舌鳞癌细胞株,接种于10%胎牛血清的DMEM细胞培养基后。待实验细胞贴壁后,胰蛋白酶消化,接种到六孔板,继续放于培养箱培养,待细胞密度生长到65%左右时,即可开始进入转染阶段。所有细胞的转染步骤均严格遵从LipofectamineTM2000 Transfection Reagent试剂盒的说明书执行。转染时用不含P/S的完全培养基换液,转染4~8 h后换成正常培养基继续培养。实验分组设转染组、阴性对照组和空白对照组。使用FAK siRNA对转染组细胞进行转染;使用无意义序列(siRNA-NC)siRNA对阴性对照组细胞进行转染;空白对照组细胞不转染任何RNA。
1.2.4qPCR检测FAK mRNA的表达及siRNA筛选 (1)取对数生长期的细胞,PBS洗涤,加入TRIzol试剂,细胞充分裂解后,加入氯仿,充分混匀,室温放置5 min。离心后待溶液分层,吸取含RNA的上清液加入等体积的异丙醇混匀,室温放置10 min。 离心后弃上清,加入75%乙醇洗涤沉淀,离心后用吸出剩余液体,干燥2~3 min后,溶解沉淀,确定所获取的RNA的纯度及浓度。(2)通过使用GoScript 反转录系统试剂盒,进行反转录反应,从而获取cDNA;根据qPCR 试剂盒说明书,建立qPCR 反应体系。(3)选择沉默效率最佳的siRNA用于后续实验。
1.2.5Western blot法检测FAK 蛋白的表达 在细胞中加入RIPA裂解液,冰浴裂解后6 000 r/min离心5 min,收集上清液。称取100 mg的BSA制备标准蛋白溶液,Bradford法测定蛋白浓度。严格按照Wes 12~230×103Rabbit Master kit及Wes 12~230×103Master kit with split Buffer试剂盒说明书的步骤进行加样操作。一抗、二抗均孵育30 min,使用Proteinsimple Wes仪器对样品进行检测,得出实验结果。
1.2.6流式细胞仪检测细胞凋亡情况 细胞接种于6孔板,第2天进行siRNA转染;转染后6 h换新鲜培养基,37 ℃、5% CO2培养箱中继续培养;转染后48 h收集各孔内上清液,贴壁细胞胰酶消化后用相应的上清液重悬收集;离心,PBS洗涤细胞,Binding Buffer 重悬细胞,加入Annexin V-FITC 及碘化丙啶(PI)试剂,混匀,室温避光染色5~15 min,1 h内流式细胞仪检测结果。
1.2.7Transwell小室法检测细胞侵袭力 细胞经胰蛋白酶消化、离心后,重悬细胞,配制细胞悬液;预先在Transwell小室的上室上表面涂布已稀释的matrigel基底胶,冰上风干。将配置好的100 μL细胞悬液加入上室,将含有10% FBS的DMEM培养液500 μL加入下室;在培养箱中放置20 h后,结晶紫染色固定;清水冲洗,拭去上室上表面的细胞;倒置显微镜下观察、拍照和计数。
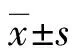
2 结 果
2.1沉默FAK基因对CAL-27细胞FAK mRNA表达的影响 qPCR检测空白对照组、阴性对照组及siRNA-1组、siRNA-2组、siRNA-3 3个转染组,FAK mRNA相对表达水平分别为1.000 0±0.037 6、1.097 4±0.022 0、0.513 6±0.034 3、0.328 6±0.016 2、0.233 2±0.001 6。3个转染组中FAK mRNA的表达水平明显下降,低于空白对照组和阴性对照组,差异有统计学意义(FsiRNA-1=286.42,PsiRNA-1<0.01;FsiRNA-2=729.99,PsiRNA-2<0.01;FsiRNA-3=1 060.91,PsiRNA-3<0.01),见图1。其中,转染siRNA-3组的沉默效率最高。

图1 各组细胞FAK mRNA表达变化
2.2沉默FAK基因对CAL-27细胞FAK 蛋白表达的影响 Western blot检测空白对照组、阴性对照组和转染组中FAK蛋白的相对表达量分别为0.010 59±0.003 18、0.008 58±0.001 67和0.004 47±0.001 25。转染组中FAK 蛋白的表达量明显低于空白对照组和阴性对照组,差异有统计学意义(F=6.04,P<0.05)(图2、3)。沉默FAK基因,舌鳞癌细胞FAK 蛋白的表达量明显降低。

图2 各组细胞FAK 蛋白表达变化

图3 各组细胞FAK 蛋白表达情况
2.3沉默FAK基因对CAL-27细胞凋亡的影响 流式细胞仪检测结果显示空白对照组、阴性对照组和转染组的凋亡率分别为(3.98±0.54)%、(3.21±0.94)%和(6.34±0.91)%,转染组细胞凋亡率明显高于阴性对照组和空白对照组,差异有统计学意义(F=11.89,P<0.01),见图4、5。FAK基因表达沉默后,舌鳞癌细胞的凋亡率显著提升。

图4 沉默FAK基因对CAL-27细胞凋亡的影响

A:空白对照组;B:阴性对照组;C:转染组
图5各组细胞凋亡情况
2.4沉默FAK基因对CAL-27细胞侵袭能力的影响 Transwell法细胞体外侵袭实验显示,空白对照组、阴性对照组、转染组中细胞穿过上室Matrigel 和聚碳酸酯膜的细胞数分别为(41.27±4.11)个、(42.60±4.06)个和(32.70±3.19)个,转染组穿膜细胞的个数明显少于阴性对照组和空白对照组,差异有统计学意义(F=5.93,P<0.05),见图6。

A:空白对照组;B:阴性对照组;C:转染组
图6沉默FAK基因对CAL-27细胞侵袭能力的影响(Transwell×200)
3 讨 论
人体内多种转录因子(如核因子κB、p53蛋白及T细胞特异性转录因子-1等)的结合位点均包含于FAK的核心启动子中, FAK受这些转录分子的调控,成为多种信号通路的“交通枢纽中心”[2]。FAK通过这些信号通路广泛参与了肿瘤发生、发展过程中的多个环节;作用涉及了肿瘤细胞的迁移、黏附、侵袭、增殖及凋亡等多种生物学行为;其既可作为单一因素对肿瘤产生影响,也可以与其他因素联合发挥作用[3-4]。在正常的舌体上皮细胞中,FAK的表达呈阴性或弱阳性[5], 这对维持舌上皮细胞正常的生理活动是必不可少的;但在舌鳞癌相关的细胞中,FAK的表达明显升高,这从侧面提示FAK可能是影响肿瘤发生、发展进程的关键因素之一。
RNA干扰技术是近年发展起来的一种可以利用双链RNA,高效、特异性地降解细胞内同源信使RNA,从而使靶基因表达沉默的新技术,现已被广泛运用于基因功能研究和肿瘤的基因治疗领域[6]。本实验采用特异性的FAK siRNA重组质粒对舌鳞癌细胞进行转染。所设计的3种FAK siRNA均能使FAK mRNA的表达水平明显降低,沉默效应在转染后48 h时达到了最高值。但本实验中的3个干扰质粒对靶基因的抑制效应不同,其中以FAK siRNA-3沉默效果最好。考虑这种现象可能与位置效应有关,3种干扰质粒分别作用于同一基因的不同靶点,从而产生了不同干扰效果。因此,有必要对干扰序列进行筛选优化,以求达到更为理想的应用效果。Western blot检测显示FAK siRNA转染舌鳞癌细胞后抑制了FAK蛋白的表达,而对照组细胞则没有上述的抑制现象,这也同时证明了FAK siRNA的特异性。
肿瘤的发生、发展与细胞的存活和凋亡失调有着密切关系。在本实验中,通过流式细胞仪技术检测发现,沉默FAK基因能诱导舌鳞癌细胞的凋亡。已有的研究表明,FAK 主要通过以下3条途径介导细胞的生存和凋亡:(1)通过PI3K-PKB信号通路,FAK可以最终灭活一系列细胞凋亡相关蛋白(如Bad、GSK3等),提供细胞生存所需的信号[7]。(2)通过Src-Ras-JNK信号通路,不需要外界提供生长因子,细胞外基质与FAK介导的细胞生存信号可以直接得到激活[8]。(3)通过FAK-p53通路,FAK能与p53结合,引起p53多聚泛素化,p53被细胞内蛋白酶降解,凋亡蛋白的信号被阻断,促使细胞周期停滞,阻止了细胞的凋亡[9]。目前有关FAK基因沉默诱导舌鳞癌细胞凋亡的确切的分子机制尚不十分清楚,仍有待进一步研究。
侵袭性是舌鳞癌恶性程度的主要指标之一,与舌鳞癌患者预后密切相关。在本实验中,通过Transwell法检测发现沉默FAK基因能有效抑制舌鳞癌细胞的侵袭能力。癌细胞侵袭能力的变化很大程度上取决于肿瘤细胞黏附性、运动能力及基质水解酶活性的改变[10]。FAK可以促使肿瘤细胞形成片状或刺状伪足,让细胞在形态学上发生改变,具备侵袭性的表型,进而调节细胞的运动[11-12]。已有的体内实验也表明,FAK的过表达可以使肿瘤细胞更易侵犯周围组织,加速转移[1]。此外,通过FAK-pl30CAS信号通路,FAK还可以活化下游分子基质金属蛋白酶(MMP)-2、MMP-9。在肿瘤侵袭和转移的过程中,构成组织学屏障的基底膜(BM)和细胞外基质(ECM),有阻止、限制肿瘤细胞侵袭和转移的功能[13]。作为基质金属蛋白酶MMPs家族成员的MMP-2和MMP-9,能有效降解细胞外基质和基底膜中各种胶原纤维和蛋白,破坏组织学屏障,促进肿瘤细胞的侵袭和转移[14-15]。
综上所述,沉默FAK基因可诱导舌鳞癌细胞CAL-27的凋亡,有效抑制其侵袭能力,提示FAK有望成为抑制舌鳞癌生长和转移的新靶点,但具体的作用机制仍需进一步地研究。
