11例t(11;22)(q23;q11) 染色体平衡易位患者的临床与遗传学分析
2018-08-02傅文婷赵文忠江惠华李铭臻周冰燚朱志勇
傅文婷,赵文忠,江惠华,李铭臻,周冰燚,顾 恒,朱志勇,刘 舒
(1.广东省计划生育科学技术研究所/广东省计划生育专科医院生殖免疫与遗传中心,广州 510700;2.广东省妇幼保健院儿童遗传代谢内分泌科,广州 510010)
染色体平衡易位是指两条非同源染色体断裂片段互相交换,未伴随遗传物质的增加或减少,携带者通常临床表型正常,但经减数分裂可形成遗传物质不平衡的配子,导致携带者出现反复流产、不孕不育、死胎,即便胎儿出生,也大多出现多发畸形、发育迟缓等。一般情况下,每个易位携带者染色体发生断裂的位点不尽相同;在不同个体中反复出现的复发性平衡易位主要为罗伯逊易位,涉及的染色体主要包括13、14、15、21、22 号端着丝粒染色体,是由于它们之间整臂互换而形成的。非罗伯逊易位的复发性平衡易位在国内少有报道。本文报道11例断裂位点均位于11号染色体长臂q23和22号染色体长臂q11区带的t(11;22)(q23;q11)易位,其中10例为平衡易位,1例为不平衡易位。通过文献复习,对此较罕见的非罗伯逊易位型复发性染色体易位的发生机制和异常核型与临床表型之间的关系进行了总结。
1 资料与方法
1.1一般资料 选择2012年7月至2015年7月因不孕不育、反复流产、出生畸形儿等不良生育史于本院就诊,并确诊为t(11;22)(q23;q11)染色体易位的11例患者的临床资料,完善遗传学、内分泌、影像学等相关检测。本研究已取得患者知情同意书,并经医院伦理委员会批准通过。
1.2方法
1.2.1外周血染色体核型分析
1.2.1.1染色体G显带核型分析 (1)接种:采用细胞增殖同步化方法,取肝素钠抗凝的脐静脉血0.5 mL,加入含20%小牛血清(美国Invitrogen,Gibco公司)的RPMI1640培养基液,每个患者培养2瓶;(2)培养:置于37 ℃培养箱培养68 h;(3)收获:收获前2 h加入40 μL浓度为100 μg/mL的秋水仙素,继续培养20 min,离心弃去上清液后,加入氯化钾溶液9 mL,混匀。 37 ℃水浴箱中温育25 min。离心去上清液后,加入固定液,混匀。离心去上清液后,加入固定液9 mL,加盖,颠倒混匀;(4)制片:室温放置30 min,离心,重复两次固定后,常规制片;(5)显带:60 ℃烤片过夜后,放入2%的胰酶消化30 s,再用吉姆萨染液染2 min,完成显带步骤。
1.2.1.2结果判读 制好的片用Metasystem全自动扫描仪(德国)扫描,在分析软件上分析,记数20个细胞,如果怀疑嵌合体,则加数到100个细胞,分析5个核型,核型描述遵循《人类细胞遗传学国际命名体制》(ISCN2015)。
1.2.2Y染色体微缺失基因检测 (1)DNA 的提取。按照QIAGEN 全血DNA提取试剂盒说明书提取DNA;(2)多重PCR和琼脂糖凝胶电泳。设计15对PCR引物扩增 AZF区域的15个STS序列标签同时设计1对PCR引物扩增SRY基因,作为内控。扩增产物用凝胶电泳进行检测分析。
1.2.3微阵列比较基因组杂交(aCGH)检测
1.2.3.1aCGH检测方法 (1)DAN提取。采用Topure试剂盒(上海Gene Tech公司),常规抽提外周血DNA;(2)酶切。使用Progema限制性内切酶,用1%琼脂糖电泳检测;(3)标记。用康为试剂微量PCR产物纯化试剂盒纯化DNA,洗脱体积30 μL;(4)杂交。应用Agilent标记试剂盒荧光标记DNA;(4)洗脱。Wash Buffer 1浓度为0.005%,将水浴锅调到42 ℃,预热Wash Buffer 2 到37 ℃后洗脱。比较基因组芯片杂交用Agilent Human Genome CGH Microarray 240K芯片(美国Agilent Technologies公司)。
1.2.3.2数据分析 荧光图像由Aglient芯片扫描仪获取,通过Agilent DNA Analytics软件(美国)进行数据分析、计算产生每个位点的基因型或信号相对强度。男女性对照DNA样本购自美国Invitrogen公司。
2 结 果
2.1临床特点 本研究对象为确诊t(11;22)(q23;q11)染色体易位患者共11例,其中女7例,男3例,产前诊断1例。7例女性中,病例1、2、3、5和6表现为反复孕早期自然流产,病例8曾孕小头、心脏异常和生殖器畸形胎儿;病例4为不孕,B超示子宫附件无异常,促卵泡成熟激素、黄体生成激素、雌二醇无异常;3例男性中,病例9表现为无精子症;病例10和11为精子数目减少和活力下降;病例7为产前诊断病例,胎儿超声检查提示多发畸形(图1),病例8为病例7的母亲,其余患者彼此之间无亲缘关系,家庭其他成员无类似疾病史。
2.2染色体G显带核型分析 染色体核型分析提示,10例成人患者均为t(11;22)(q23;q11)染色体平衡易位,1例产前诊断胎儿核型为非平衡易位。患者核型见图2。
2.3Y染色体微缺失检测 3例无精/少弱精子症男性患者(病例9、10、11)的AZF基因15个STS位点未见缺失。见图3。
2.4aCGH检测aCGH提示病例7的11号染色体q23.3-q25存在约17.1 Mb片段重复(arr11q23.3q25(116,655,121-133,715,345)×3),包含384个功能基因;22号染色体q11.1-q11.21存在约4.8 Mb片段重复(arr22q11.1q11.21(16,053,473-20,832,003)×3),包含182个功能基因。其余病例aCGH检测均未发现异常。
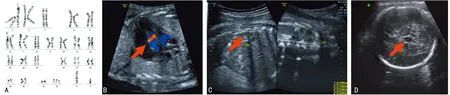
A:胎儿染色体核型分析;B、C、D:胎儿B超结果
图1病例7 G显带核型分析图、染色体拷贝数异常模式图及三维彩超图
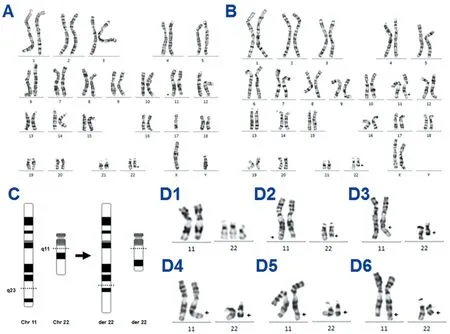
A:男性患者染色核型图;B:女性患者染色体核型图;C:染色体易位断裂点模式图;D:易位染色体核型图。D1:胎儿易位染色体核型简图(不平衡易位),D2~D6:成人易位染色体核型简图(平衡易位)
图2 t(11;22)(q23;q11)患者的G-显带核型图及模式图
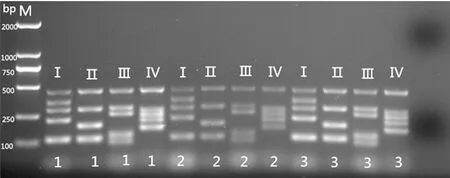
M:正常男性;1、2、3:3个患者;Ⅰ、Ⅱ、Ⅲ、Ⅳ:PCR反应体系管
图3 3例精子生成异常男性患者的SRY及Y染色体STS位点基因检测结果图
3 讨 论
t(11;22)染色体平衡易位是人类最常见的非罗伯逊易位型复发性易位,携带者通常表型正常,往往由于多次流产、不育或生育过Emanuel综合征患儿而被发现。t(11;22)(q23;q11)发生频率为1/10 000~1/4 000,国内仅有为数不多的案例报道。
染色体易位一般是随机出现的,断裂点区域的基因组成很可能是导致基因组不稳定的原因,11q23 和22q11 断裂点均为回文AT富集的重复序列(PATRRs),由一段长AT序列后接反转序列组成,这种序列容易形成发夹十字形结构,通过一系列过程导致重组发生[1-3]。本文中除病例8和病例7是母子关系外。其余10例t(11;22)(q23;q11)易位患者间无亲缘关系,但染色体断裂位点一致。
染色体平衡易位携带者由于没有遗传物质丢失,本身可无临床症状;但平衡易位携带者配子形成过程中同源染色体片段彼此配对,形成四射体,后者通过邻位-1式、2式分离及12种可能的3∶1分离,可形成至少18种配子。这些配子分别与正常配子结合后,可形成18种类型的合子,其中仅1种为正常者,1种为平衡易位携带者;其它类型均为部分单体或部分三体,因为遗传物质的不平衡,最终结局只可能是流产、死产、新生儿死亡、生育畸形儿等[3-4]。t(11;22)(q23;q11)平衡易位携带者多由于反复不良生育史,最后进行染色体核型分析才被发现。当平衡易位携带者46,XY或XX,t(11;22)(q23;q11)生殖细胞在减数分裂过程中,粗线期交叉的不对称性,导致第1次减数分裂中期四射体方向的不调和,使之在减数分裂的后期偏向于3∶1分离。这种情况下当正常配子与24,X或24,Y,+der(22)t(11;22)(q23;q11)配子结合,就有机会形成核型为47,XY或47,XX,+der(22)t(11;22)(q23;q11)的合子[5,6],即为本文其中一例胎儿出现额外der(22)t(11;22)。额外der(22)t(11;22)综合征患儿额外携带了1条衍生22号染色体,这会引起遗传物质的不平衡,导致出现临床症状。该综合征的临床特点为耳廓大而松软、耳位低、小头畸形或头颅不对称、高腭弓、小颌、心脏畸形、生殖器畸形、癫痫发作等[7]。额外der(22)t(11;22)综合征患儿常在新生儿期死亡,极少能存活至儿童早期,少数存活者,也伴发有精神运动迟缓、肌张力低下、骨关节畸形、胰腺发育不良等严重症状,生活不能自理[8-9]。
有文献报道,母亲为t(11;22)(q23;q11)平衡易位携带者产生异常后代的可能性显著高于父亲是平衡易位携带者[10]。推测这种差异与精母细胞、卵母细胞在减数分裂时的形式不同有关:精子数量远远超过卵子,精卵结合时,携带异常染色体的精子被排斥,正常精子优先受精;而女性平衡易位携带者卵子则无选择机会。病例7在母亲孕期检测到唐氏高风险,B超提示胎儿单脐动脉、脑中线囊肿,右肾发育不良,心包积液,孕25周进一步行脐带血穿刺胎儿染色体核型分析发现der(22)t(11;22)综合征胎儿,经遗传咨询,胎儿父母选择终止妊娠。复查胎儿父母外周血核型而发现母亲(病例8)为平衡易位携带者。先证者父母之一为 t(11;22)携带者,再次妊娠有以下几种可能:(1)der(22)综合征;(2)t(11;22)携带者;(3)自然流产。再发风险依赖于先证者的父亲还是母亲为平衡易位携带者。一般女性携带者再发风险5.7%~6.1%,略高于男性携带者的2.2%~5.0%[11]。因此,对于发生频率相对较高的t(11;22)(q23;q11)复发性染色体平衡易位,父母染色体的分析有助于了解标记染色体的组成,进而揭示患儿临床表现的遗传学病因,为遗传咨询和产前诊断提供依据。
