大豆异黄酮下调TLR4/MyD88介导的信号通路保护心肌肥厚的作用机制*
2018-08-02刁爱芹潘爱萍李晓洁周瑞芳陈国富
刁爱芹,王 卉,潘爱萍,李晓洁,周瑞芳,陈国富
(泰州职业技术学院,江苏泰州 225300)
心肌肥厚是心脏长期负荷过重的一种代偿性反应,各种致心肌肥厚因素通过心脏细胞内信号转导途径改变相关核转录因子的活性,导致心脏组织中大量基因/蛋白质的表达出现异常,是以心脏的形态结构和功能发生变化为特征的心室重构[1],是多种心血管系统疾病常见的一种并发症,常导致心力衰竭,如何预防和逆转心室重构已成为当今治疗的重要目标。大豆异黄酮(SI)即大豆苷元是一种异黄酮类化合物,研究发现其具有雌激素样作用、抗心肌缺血-再灌注损伤作用、抗心衰作用、对过氧化氢诱导的肝细胞损伤的保护作用等[2-4]。周茜等[5]研究表明SI对压力负荷性大鼠心肌肥厚具有保护作用。本研究采用主动脉弓缩窄(TAC)法致压力负荷性心肌肥厚模型,探讨SI对心肌肥厚的保护作用机制,旨在为SI在心肌肥厚防治中的作用提供科学依据。
1 材料与方法
1.1材料
1.1.1实验动物 清洁级雄性SD大鼠,体质量210~260 g,由扬州大学医学院实验动物中心提供。
1.1.2药品 SI(华北制药股份有限公司),异黄酮总含量大于或等于98%,Masson染色试剂盒购自福建迈新生物技术开发有限公司,TLR4抗体、MyD88抗体购自美国Santa Cruz公司。
1.2试验方法
1.2.1大鼠心肌肥厚模型建立 将大鼠分成4组:假手术组(Sham组)、主动脉弓缩窄模型组(TAC组)、溶剂对照组(TAC+placebo组)和SI治疗组(TAC+SI组)。参照文献[6]方法制备大鼠心肌肥厚模型。3.6%水合氯醛(1 mL/100 g)腹腔麻醉后,经气管插管与动物呼吸机链接。胸部左侧第三肋间隙打开胸腔,在左颈总动脉与头臂干之间穿一0号丝线,并紧贴其上置一10号针头,用丝线将动脉与针头一起扎紧并迅速抽出针头,按照统一标准造成不完全缩窄。假手术对照组除不进行缩窄外,其余手术步骤与其他组相同。TAC+SI组大鼠于造模第2天开始分别灌胃给药120 mg/(kg·d),连续4周,TAC+placebo组每天灌胃相同体积的溶剂,药物临用时溶于0.5%羧甲基纤维素钠(CMC-Na)溶剂中。
1.2.2标本收集和处理 术后4周,末次给药后禁食12 h大鼠称质量后处死,取其心脏,去除大血管、心外膜脂肪组织,用生理盐水清洗,吸干后计算全心质量指数(HW/BW)和左心室质量指数(LVW/TL)。
1.2.3组织学染色 心肌组织胶原及纤维组织的鉴定染色(Masson染色),取大鼠心脏新鲜组织置于10%甲醛溶液固定,石蜡切片,根据Masson染色试剂盒说明书,进行心肌组织染色,通过光学显微镜观察心肌组织胶原沉积情况。苏木素(HE)染色,取大鼠心脏新鲜组织置于10%甲醛固定,脱蜡脱水处理。置入HE染核3~5 min,自来水洗5 min共3次,1%盐酸乙醇分化 0.5~1 min,流水冲洗5 min共3次,氨水反蓝1 min,流水冲洗15 min。0.5%伊红水溶液(对比染色),95%乙醇、无水乙醇脱水,透明,封固,通过显微镜观察心肌细胞形态。
1.2.4免疫共沉淀(immunoprecipatation,IP) 每组取细胞质蛋白300 μg,用Lysis Buffer补足体积至150 μL,加入TLR4抗体5 μL,4 ℃持续混合过夜后再加入 Protein-A agrose 20 μL,4 ℃充分混合1 h,离心弃上清液。沉淀用Lysis Wash Buffer洗3次,同样方法离心后再用20 μL的Lysis Buffer混旋沉淀,加4 μL 6×SDS Loading Buf,煮沸3 min后收集上清液Western blot方法分析MyD88及TLR4蛋白表达水平。
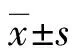
2 结 果
2.1SI对TAC术后心脏外观变化 从图1可见,雄性SD大鼠进行TAC后4周,其心脏发生明显肥大,与Sham组相比,HW/BW和LVW/TL的值显著升高(t=4.344,P=0.012 2和t=8.762,P=0.000 9,n=6);TAC+placebo组HW/BW和LVW/TL与TAC组比较差异无统计学意义(t=0.222 7,P=0.834 7和t=0.519 6,P=0.630 8,n=6),与Sham组比较明显升高(t=3.375,P=0.027 9和t=6.640,P=0.002 7,n=6);而TAC+SI组心脏大小与TAC组相比,HW/BW和LVW/TL的值显著降低(t=3.432,P=0.026 5和t=5.738,P=0.105,n=6)。

图1 TAC诱导的雄性SD大鼠的心室肥大

A:各组HW/BW比较;B:各组LVW/TL比较;*:P<0.05,与Sham组比较;#:P<0.05,与TAC组、TAC+placebo组比较
图2 TAC诱导的SD大鼠心脏质量改变

图3 TAC后4周心肌组织的形态学改变(HE×400,Masson×100)
2.2SI对TAC术后心肌形态学和心肌纤维化变化 与Sham组比较,TAC组的心肌组织细胞间隙中的纤维结缔组织明显增多。使用SI处理4周的TAC+SI组,心肌组织内纤维结缔组织与 TAC组相比则明显减少,TAC+placebo组心肌组织内胶原含量与TAC组相比则没有明显改变。对左心室心肌组织进行常规切片,Sham组心肌结构正常,TAC组心肌细胞直径增宽,肌纤维排列紊乱。使用SI治疗4周后,心肌细胞横截面积减小,而TAC+placebo组4周后的心肌细胞横截面积仍显著增加,肌纤维排列紊乱。见图3。

A:Western blot图;B:TLR4和MyD88蛋白相互结合统计分析;*:P<0.01,与Sham组比较;#:P<0.01与TAC组、TAC+placebo组比较;IP:免疫共沉淀;IB:Western blot检测
图4 SI抑制TAC引起的大鼠心脏TLR4对MyD88相互作用
2.3SI抑制 TAC引起的TLR4对MyD88招募的增加 TAC后4周,TAC组大鼠左心室心肌组织TLR4与MyD88的结合与Sham组相比明显增加(t=16.07,P=0.003 9,n=6);TAC+placebo组与TAC组比较无明显变化(t=1.761,P=0.220 2,n=6),给予SI治疗后,TAC后4周心室心肌组织TLR4与MyD88的结合与TAC+placebo组显著降低(t=13.88,P=0.005 1,n=6)。见图4。
3 讨 论
TAC可引起大鼠压力超负荷性心肌肥厚和心室重构。本实验模型组的心脏质量指标(HW/BW和LVW/TL)明显增加、Masson染色和HE染色显示的形态学指标均高于Sham组,SI治疗后可抑制心脏质量及形态学指标,说明SI可减轻TAC所致的大鼠心肌肥厚。
SI是大豆生长形成的一类次生代谢产物,它包括15种结构类似的化合物,主要包括染料木黄酮、大豆素苷元和大豆苷元等,其中燃料木黄酮的活性最高。SI的结构与雌激素相似,在体内它可以与雌激素受体结合发挥弱的雌激素样作用而不携带雌激素的不良反应,被认为是天然的雌激素替代品。流行病学研究证实SI在女性心血管疾病的发病和预防治疗中起重要作用[2,6]。也有研究表明,SI对腹TAC所致心肌肥厚大鼠心室重构有一定的保护作用,然而具体的作用机制还不是很清楚,从而限制了临床应用SI治疗或预防心血管疾病[5]。
Toll样受体是天然免疫系统内重要的模式识别受体。在这些受体中,TLR4可被内毒素、热休克蛋白60、纤维连接素等多种外源性或内源性配基激活,招募髓样分化蛋白88(MyD88),诱导MyD88下游的核转录因子κB(nuclear factor κB,NF-κB)与 NF-κB的抑制蛋白IκBα(inhibitor of NF-κB)解离,进入细胞核内,编码不同肥大基因的转录活化及炎症因子的产生,增强心肌细胞的肥大程度及凋亡。TLR4信号通路的激活源于细胞质TIR域,在LPS等配基的刺激下,TLR4通过TIR域与MyD88的TIR域相结合,MyD88被激活后,通过死亡域招募下游的IL-1受体相关激酶(IRAKs),诱导下游的两条不同的信号通路,最终分别激活c-Jun氨基末端激酶和NF-κB,其中,NF-κB进入核内参与调控基因的表达。这些改变可能诱导心肌细胞的病理性肥大及细胞色素c的缺失等细胞表型的改变。文献[7-8]研究发现TLR4/MyD88介导的NF-κB信号通路在压力负荷增加或纤维蛋白原诱导心肌肥大过程中发挥重要作用,TLR4基因缺陷小鼠与对照组相比,TAC诱导的心肌肥大的程度与野生型小鼠相比明显减轻;而心肌局部转染MyD88无效抑制因子(Ad5-dn-MyD88 )特异性抑制MyD88信号转导亦能够明显减少TAC或纤维蛋白原诱导的心肌肥大发生、发展过程中NF-κB的活化,减轻心肌肥大,改善心脏功能。
有资料表明,天然雌激素对心肌肥大具有保护作用,并且能降低LPS诱导的H9C2心肌细胞系中的TLR4 mRNA的表达[9-11]。另外有研究发现,在表皮角质细胞中,天然雌激素可以降低创伤性出血诱导的TLR4与MyD88的蛋白表达水平及下游的信号级联反应[12-13]。LOU等[14]研究表明在脱膜间质细胞中雌激素能下调LPS激活的TLR4信号通路发挥抗炎抗凋亡作用,这些研究结果提示天然雌激素可能通过影响TLR介导的信号通路发挥其免疫保护作用。SI作为天然雌激素的替代品,在本实验中发现SI能抑制TAC诱导的大鼠心肌组织内TLR4/MyD88交互作用增加,从而影响下游信号通路,抑制TAC诱导的心肌肥大的发生、发展。
综上所述,SI可抑制压力超负荷导致的心肌肥厚和心室重构,而这种作用可能与抑制TLR4/MyD88介导的心肌肥厚信号通路有关,有关作用机制还有待深入研究。
