绵羊 TGFβ2基因及其剪切体的克隆与生物信息学分析
2018-08-02倪文浩李雯雯李欣毅李文蓉
陈 磊,倪文浩,李雯雯,李欣毅,李文蓉
(1.新疆畜牧科学院 生物技术研究所,农业部草食家畜繁育生物技术重点开放实验室,自治区重点实验室,乌鲁木齐 830000;2.新疆生产建设兵团第二中学,乌鲁木齐 830000)
中国美利奴羊是中国于 1985 年育成的第一个毛用细毛绵羊品种,具有毛丛密度高、羊毛细长而弯曲和净毛量高的特点。目前,羊毛纤维产量已经占世界纤维原料的 1.9%[1],是细毛羊主要的高附加值产品,具有重要的经济价值。中国虽是世界羊毛的生产大国,但优质细毛羊的羊毛产量和品质仍远落后于养羊业发达国家,主要原因是细毛羊优良品种选育扩繁和羊毛质量控制体系滞后。传统的绵羊育种方法虽然能够改良和提升羊毛产量和品质,但周期长、进展缓慢,而运用分子育种技术在筛选获得与细毛羊毛囊发育相关功能基因的基础上,进一步阐明其对绵羊毛囊发育和毛品质形成的影响,对推动细毛羊品种选育和提高中国优质细毛羊羊毛品质具有重要意义。
可变剪接(或选择性剪接, Alternative splicing)是指基因的 mRNA 前体通过不同的剪接方式(选择不同的剪接位点)拼接产生不同的mRNA剪接异构体,是生物体内一种普遍存在的调控方式[2-3]。同时,可变剪接是调节基因表达和产生蛋白质组多样性的重要机制。可变剪接多发生在受体、信号传导通路、转录因子等参与信号转导和表达调节的基因上,对个体分化发育、凋亡和细胞兴奋等生理过程的精确调控发挥重要作用[4-6]。此外,它也是导致真核生物基因和蛋白质数量较大差异的重要原因。已有研究发现,基因可变剪接发生在动物神经系统、免疫系统、肌肉和毛囊的生长发育过程中均具有关键的生物学功能[7-11]。
TGFβ2是TGF-β超家族成员之一,在毛囊形态发生、发育和毛囊周期性调控中发挥重要的生物学功能。Chuong等[12]研究发现 TGFβ2 在毛囊基板和凝集簇中表达,能够诱导胚胎间充质中真皮凝集簇的形成,Soma等[13-14]研究发现 TGFβ2 能够抑制毛囊毛干的延长,诱导毛囊发生退行期的形态学改变,同时,免疫组化分析发现 TGFβ2 在毛囊真皮乳头、外根鞘、毛球和毛母质细胞中均表达,且在毛囊生长期—退行期过渡阶段, TGFβ2 在毛球内的表达具有特异性,调控毛囊发育和毛囊周期性生长过程[15-17]。此外, TGFβ2 基因敲除小鼠模型发现,单拷贝失活的小鼠毛囊数量下降,而 TGFβ2 双敲除小鼠毛囊的形成和生长发育受到严重影响[18]。由此可见, TGFβ2 在调控动物毛囊生长发育和周期性循环过程中发挥重要作用,但目前绵羊 TGFβ2 基因序列结构和生物学特性尚不清楚,该基因在调控毛囊发生和发育中的作用机制鲜有报道。本研究对绵羊 TGFβ2 其剪切体CDS进行克隆,利用生物信息学软件对TGFβ2及其剪切体蛋白的结构和功能进行分析,阐明其生物学特征,为深入研究 TGFβ2 在绵羊毛囊生长发育过程中的作用及其表达调控提供理论基础。
1 材料与方法
1.1 试验材料
绵羊为新疆畜牧科学院绵羊中心羊场的2~3 岁中国美利奴羊,通过同期发情和人工授精技术分别采集中国美利奴羊妊娠期毛囊发育起始阶段[第 55 天(D55)]、初级毛囊形成阶段[第 75 天(D75)]、次级毛囊形成阶段[第85天(D85)]、次级获得性毛囊形成阶段[第 105 天(D105)]和毛发生长成熟阶段[第135 天(D135)]各 3 只胎羊体侧皮肤组织样本,分别置于冻存管中,保存在液氮中,备用。随机挑选妊娠期第 85 天的 3 只中国美利奴羊体侧皮肤组织样本为模板,进行绵羊 TGFβ2基因克隆。
1.2 主要试剂
Trizol试剂,Zero Blunt○RTOPO○RPCR cloning kit购自Life Technology公司;PrimeSTAR○RHS DNA聚合酶,限制性内切酶,T4DNA连接酶购自TAKARA公司;反转录试剂盒,感受态细胞DH5α,质粒提取试剂盒,胶回收试剂盒购自全式金科技有限公司;其他试剂为分析纯产品。
1.3 皮肤组织总RNA提取及反转录产物合成
参照TRIzol Reagent操作步骤分别提取中国美利奴羊体侧皮肤组织总RNA,10 g/L非变性琼脂糖凝胶电泳检测其完整性,利用Nandrop 2000 核酸蛋白分析仪测定RNA的质量浓度,按照反转录酶试剂盒说明进行cDNA合成。
1.4 克隆引物设计
根据GenBank中的绵羊 TGFβ2基因序列(XM_004013602)设计引物。上游引物:5′-GTCCGGATCCATGCACTACTGTGTGTTGA- GCG -3′(下划线为BamHⅠ酶切位点);下游引物:5′- CCTGAAGCTTTTAGCTGCATTTGCAAGACTTGAC-3′(下划线为Hind Ⅲ酶切位点),引物由上海生工生物工程股份有限公司合成。
1.5 绵羊 TGFβ2 基因克隆
将 3 只中国美利奴羊皮肤组织总 RNA 等量混合,反转录成 cDNA,以 cDNA 为模板进行PCR扩增,反应体系:cDNA模板 1.0 μL,Premix PrimeSTAR○RHS聚合酶25.0 μL,上、下游引物(10 mol/mL)各1.0 μL,灭菌去离子水 22.0 μL。反应条件:95 ℃ 5 min;95 ℃ 10 s,58 ℃ 15 s,72 ℃ 1.0 min,35 个循环;72 ℃ 5 min。PCR 反应结束后取 6.0 μL PCR产物进行琼脂糖凝胶电泳检测。利用 DNA 胶回收试剂盒纯化回收PCR 产物,随后对 PCR 回收产物和 PCRTMBlunt Ⅱ-TOP○R克隆载体进行双酶切,利用 T4连接酶进行连接反应,并将连接产物转化至感受态细胞 DH5α 中,将细胞悬液涂于含有卡那霉素的 LB 固体培养基上,37 ℃ 培养箱中培养 16 h。挑取培养皿上的单克隆接种于含有卡那霉素的液体培养基中,培养过夜。利用质粒小型提取试剂盒提取质粒,对重组质粒进行双酶切鉴定,将鉴定的阳性质粒送上海生工生物工程股份有限公司测序。
1.6 生物信息学分析
使用DNAstar软件进行克隆序列的拼接和各物种同源性分析;利用ProtParam(http://us.expasy.org/tools/protparam.html)分析绵羊TGFβ2氨基酸的理化性质[19];利用TMHMM server 2.0 预测绵羊TGFβ2蛋白的跨膜结构域[20];利用SignalP 4.0 软件预测绵羊TGFβ2蛋白的信号肽;利用在线软件Protcale(http://web.expasy.org/protscale/)进行绵羊TGFβ2蛋白亲水性/疏水性分析;利用NetPhos分析蛋白质磷酸化位点;利用NetNGlyc分析蛋白质糖基化位点;使用Mega 6.0 软件构建 8 个物种TGFβ2的系统进化树;利用PSORT II Prediction预测蛋白质的亚细胞定位;利用SOPMA软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测绵羊TGFβ2蛋白的二级结构;采用Phyre 2.0 软件http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)进行绵羊TGFβ2蛋白的三级结构预测[21]。
2 结果与分析
2.1 绵羊 TGFβ2 基因CDS的PCR扩增
利用Trizol提取3只中国美利奴羊总RNA,非变性琼脂糖凝胶电泳检测得到28 S、18 S和5 S 3条带(图略),Nandrop分光光度计检测吸光度OD260nm/OD280nm为1.9~2.0,表明总RNA完整性较好,无蛋白质或DNA污染。利用设计的特异性引物进行PCR扩增,扩增产物经10 g/L琼脂糖凝胶电泳检测,获得1 200 bp左右清晰且特异性好的DNA片段(图1),可以进行后续试验。
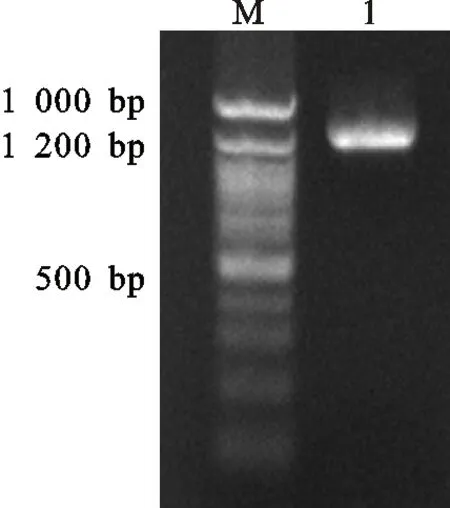
M.DNA marker 100 bp;1.PCR 产物 Product of PCR
图1绵羊TGFβ2基因PCR扩增结果
Fig.1PCRamplificationresultofsheepTGFβ2gene
2.2 绵羊 TGFβ2基因及其剪切体CDS的克隆及重组子鉴定
将纯化回收获得的 PCR 产物转化至 DH5α感受态细胞,挑取单菌落培养后提取质粒,利用 TGFβ2 基因 CDS 特异性引物鉴定重组质粒,获得约 1 200 bp 的插入片段(图2),与预期结果相符,测序后获得绵羊 TGFβ2 基因 CDS序列全长1 329 bp,编码 442 个氨基酸;另发现 2 个可变剪切体TGFβ2-AS1和TGFβ2-AS2,与主转录本TGFβ2相比,可变剪切体TGFβ2-AS1和 TGFβ2-AS2分别编码 331 和 414 个氨基酸, TGFβ2-AS1 缺失全部的第二外显子序列和第六外显子的 115 个碱基, TGFβ2-AS2 仅缺失第二外显子(图3)。此外,物种间的核苷酸序列相似性分析发现,克隆获得的 TGFβ2 基因 CDS 与人类、小鼠、大鼠、牛、鸡、狗、猪和斑马鱼的相似性分别为 94.28%、83.37%、88.71%、92.85%、79.53%、94.51%、94.81%和 67.80%,表明 TGFβ2 基因在各物种间具有较高的相似性。

M.DNA marker 100 bp;1~8.菌落PCR 产物 Product of colony PCR
图2绵羊TGFβ2基因菌落PCR扩增结果
Fig.2ColonyPCRamplificationresultofsheepTGFβ2gene
2.3 绵羊TGFβ2及其剪切体蛋白的生物信息学分析
2.3.1 理化性质分析 利用Protparam软件对绵羊TGFβ2及其剪切体 TGFβ2-AS1和 TGFβ2-AS2的理化性质进行分析,结果发现:绵羊TGFβ2蛋白分子质量为50 550.99 ku,理论等电点为8.74,TGFβ2-AS1蛋白分子质量为37 672.38 ku,理论等电点为 7.60,TGFβ2-AS2蛋白分子质量为 47 691.71 ku,理论等电点为 8.82,绵羊TGFβ2及其剪切体TGFβ2-AS1和 TGFβ2-AS2蛋白均由 20 种基本氨基酸组成(图3),其中:主转录本TGFβ2的氨基酸组成中丝氨酸(10.2%)含量最高,色氨酸(1.1%)最低,带正电荷的残基 59个,带负电荷的残基 49个,蛋白的平均亲水系数为 -0.406; TGFβ2-AS1蛋白氨基酸组成中亮氨酸(9.7%)含量最高,色氨酸(0.9%)最低,带正电荷的残基 39个,带负电荷的残基 38个,蛋白的平均亲水系数为-0.217;TGFβ2-AS2蛋白的氨基酸组成中亮氨酸(9.9%)含量最高,色氨酸(1.2%)最低,带正电荷的残基 58个,带负电荷的残基 48个,蛋白的平均亲水系数为 -0.471 。
2.3.2 亲水性/疏水性分析 如图4所示,绵羊TGFβ2及其剪切体 TGFβ2-AS1和 TGFβ2-AS2第8位丙氨酸疏水性最强(最高分值2.856);绵羊TGFβ2第 326 位精氨酸亲水性最强(最低分值为-3.622 ),TGFβ2-AS1第 94 位丝氨酸亲水性最强(最低分值为 -3.178 ), TGFβ2-AS2第298 位精氨酸亲水性最强(最低分值为-3.622 )。

红色下划线表示信号肽序列,绿色下划线表示跨膜区 Red underline indicates signal peptide sequence,green underline indicates TGFβ2 protein transmembrane domains
图3绵羊TGFβ2及其剪切体氨基酸序列分析
Fig.3TGFβ2anditssplicedvariantaminoacidsequencesinsheep
2.3.3 磷酸化与糖基化位点分析 利用 NetPhos 3.1 Server 软件分析发现,绵羊TGFβ2蛋白有 33 个丝氨酸, 12 个苏氨酸和 7 个酪氨酸; TGFβ2-AS1 有 22 个丝氨酸, 8 个苏氨酸和 7 个酪氨酸;TGFβ2-AS2 有 30 个丝氨酸,10 个苏氨酸和 7 个酪氨酸。根据 NetNGlyc 1.0 Server 分析表明,绵羊TGFβ2及其剪切体均有 2 个糖基化位点。
2.3.4 信号肽及蛋白跨膜区分析 运用SignalP server 4.1对绵羊TGFβ2及其剪切体 TGFβ2-AS1和 TGFβ2-AS2进行信号肽分析,结果表明,均有1 个信号肽区域,位于 1~20 位氨基酸(图3);同时,利用TMHMM server 2.0软件进行跨膜结构域分析,绵羊TGFβ2及其剪切体 TGFβ2-AS1和 TGFβ2-AS2均为单跨膜蛋白(图3),即绵羊TGFβ2 1~4位氨基酸为胞内部分,5~27 位氨基酸为跨膜螺旋部分,28~442 位氨基酸为胞外部分;绵羊 TGFβ2-AS1 1~4 位氨基酸为胞内部分, 5~27 位氨基酸为跨膜螺旋部分,28~331 位氨基酸为胞外部分;绵羊 TGFβ2-AS2 1~4 位氨基酸为胞内部分,5~27 位氨基酸为跨膜螺旋部分,28~414 位氨基酸为胞外部分。
2.3.5 亚细胞定位 根据 PSORT II Prediction 预测分析发现,绵羊TGFβ2和 TGFβ2-AS2 在细胞中的定位结果是一致的,主要在胞外(44.4%)和细胞核(44.4%)中发挥作用,其余在线粒体中(11.1%)发挥作用, TGFβ2-AS1 主要在胞外(44.4%)发挥作用,少量作用于细胞质(22.2%)、线粒体(22.2%)和细胞核(11.1% )。
2.3.6 蛋白高级结构预测 绵羊TGFβ2及其剪切体 TGFβ2-AS1和 TGFβ2-AS2蛋白均由α-螺旋、延伸、β-折叠和无规则卷曲 4 种结构组成,其中绵羊TGFβ2各种结构所占比例分别为 38.69%、 16.74%、 8.14%和 36.43%, TGFβ2-AS1为 46.22%、 16.62%、 7.25%和 29.91%, TGFβ2-AS2为 39.13%、 16.43%、 8.70%和 35.75%,其中α-螺旋主要分布在位于细胞内的氨基酸两端。此外,蛋白三级结构分析发现(图 5),绵羊TGFβ2及其剪切体均存在α-螺旋、β-折叠和disordred区域,其中绵羊TGFβ2蛋白存在 7 个α-螺旋区和 15 个β-折叠区, TGFβ2-AS1蛋白存在 5 个α-螺旋区和 13 个β-折叠区, TGFβ2-AS2蛋白存在 6 个α-螺旋区和 16 个β-折叠区。
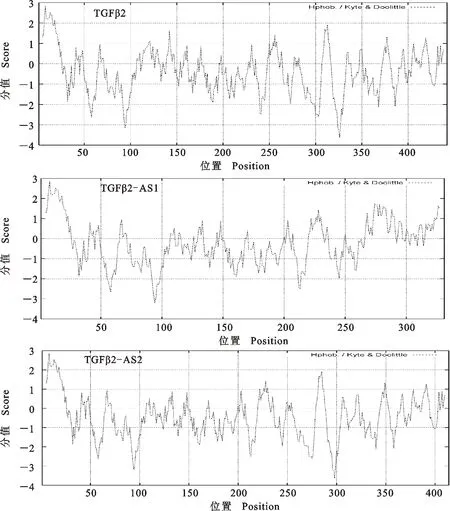
图4 绵羊TGFβ2及其剪切体蛋白亲水性分析Fig.4 Analysis of hydrophobicity sheep TGFβ2 and its spliced variant protein
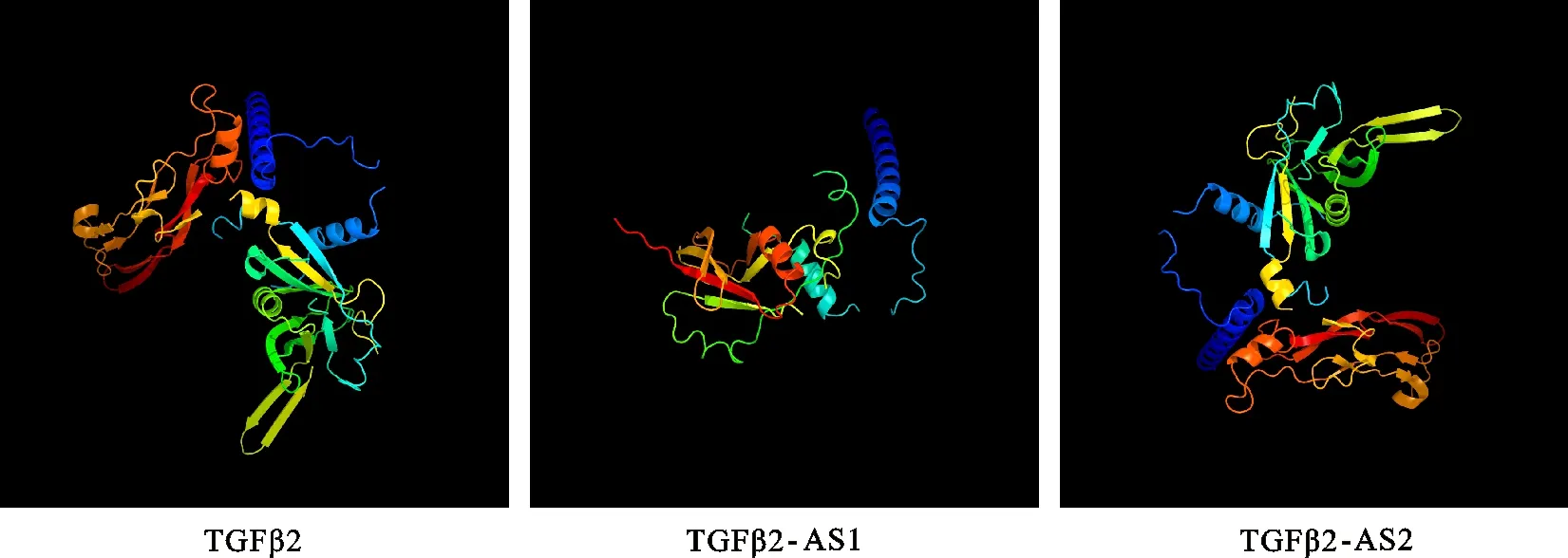
图5 绵羊TGFβ2及其剪切体蛋白三级结构预测Fig.5 Prediction of tertiary structure of sheep TGFβ2 and its spliced variant protein
2.4 绵羊TGFβ2蛋白同源性分析
从NCBI数据库下载人类、小鼠、大鼠、牛、鸡、狗、猪和斑马鱼8个物种的 TGFβ2基因编码蛋白序列,采用MegAlign 6.0软件进行蛋白同源性分析,结果发现,绵羊 TGFβ2基因编码蛋白与上述物种具有较高的同源性,绵羊TGFβ2氨基酸序列与人类、小鼠、大鼠、牛、鸡、狗、猪和斑马鱼的同源性分别为 98.42%、90.27%、 95.02%、92.85%、83.48%、94.51%、94.81%和 67.80%。同时, TGFβ2编码蛋白的系统进化树分析发现,绵羊与人类在系统进化树中的距离最近,与斑马鱼的距离最远(图6),提示绵羊 TGFβ2基因可能与人类具有相似的分子进化模式,可能具有相似的分子功能。
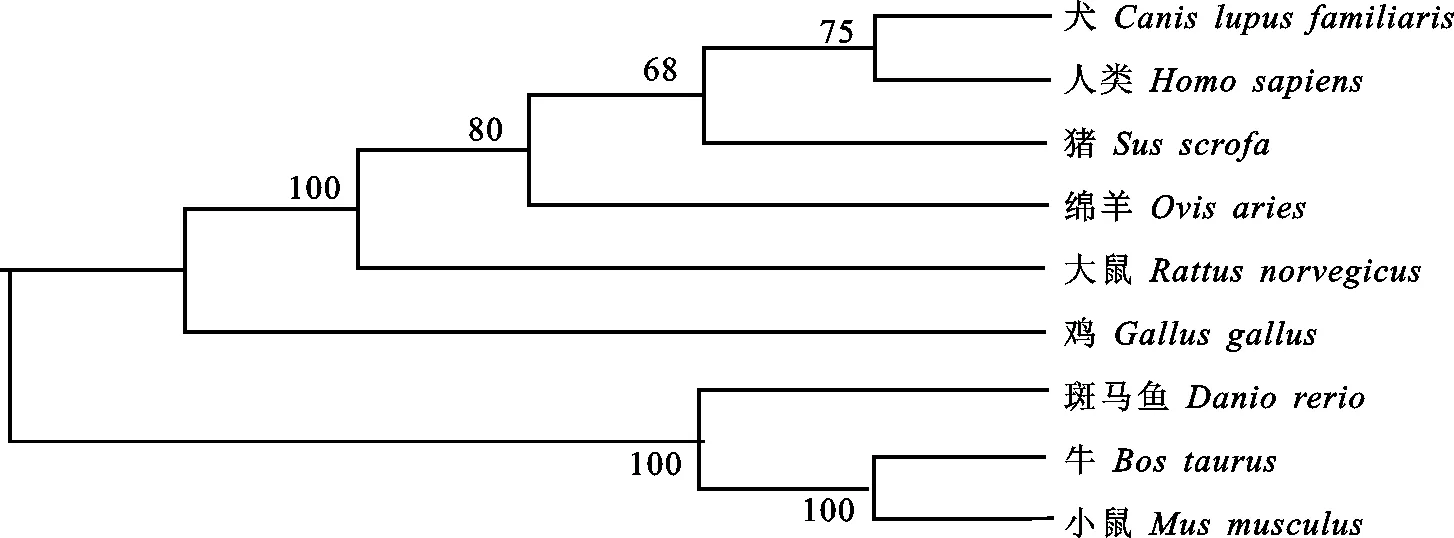
图6 9个物种TGFβ2蛋白系统进化树Fig.6 Phylogenetic tree constructed for TGFβ2 protein of 9 species
3 讨 论
绵羊毛囊的发育始于胚胎形成时期,与毛囊发育相关的功能基因调控羊毛的形态学发生和毛品质性状的形成[22-26]。 TGFβ2基因在毛囊生长发育和周期调控过程中具有重要作用,是调控毛囊形成、基板向下生长和毛品质性状的重要候选功能基因[16,27-28],然而,目前该基因对绵羊毛囊发育和周期性调控的分子功能鲜有报道,完整的绵羊 TGFβ2基因编码区全长序列目前仍尚未获得。本试验利用RT-PCR法首次克隆获得绵羊 TGFβ2基因及其剪切体 TGFβ2-AS1和 TGFβ2-AS2的全长CDS, TGFβ2基因CDS全长 1 329 bp,其剪切体 TGFβ2-AS1和 TGFβ2-AS2分别缺失 333 和 84 个核苷酸, CDS全长分别为 996和 1 245 bp。绵羊 TGFβ2基因与毛囊周期性转导和毛囊真皮乳头细胞凝集性发生的密切关系[29-30],使人们日益重视该基因在绵羊毛囊生长发育过程中的作用,但目前针对 TGFβ2基因及其可变剪切体调控绵羊毛囊发育的分子机制研究尚未开展,同时,虽然NCBI数据库中有人类和小鼠 TGFβ2基因的一个可变剪接形式,但其对生物体生长发育的作用机制尚未阐明, TGFβ2及其可变剪切体的作用机制仍有待于深入分析。
可变剪切是导致蛋白质功能多样性的重要原因,其在调控毛囊生长发育过程中具有重要作用。已有研究表明,FGF5及其剪切体在毛囊真皮乳头细胞中相互拮抗调控毛囊生长发育和周期性转导过程[31],同时,角蛋白相关蛋白及其剪切体在调控细毛羊毛品质性状形成过程中也发挥重要作用[32-33]。由此可知,基因可变剪切的发生能够直接影响基因的功能和作用方式,它们在调控毛囊的生长发育过程中发挥重要功能。本试验首次克隆获得绵羊 TGFβ2基因及其剪切体编码区全长序列,但目前 TGFβ2基因及其剪切体在绵羊毛囊生长发育和毛囊周期发生过程中的生物学功能仍知之甚少,在本研究的基础上深入开展 TGFβ2基因及其剪切体在毛囊类细胞中的表达规律、分子功能和信号网络调控等方面的研究将为阐明毛囊生长发育的分子调控机制奠定理论基础。
绵羊TGFβ2及其剪切体TGFβ2-AS1和 TGFβ2-AS2蛋白分别编码 442、331 和 414个氨基酸,均属于I型跨膜蛋白,蛋白结构预测结果表明,TGFβ2及其剪切体蛋白均含有 1 个信号肽区域和 1 个跨膜结构区域。说明TGFβ2及其剪切体 TGFβ2-AS1和 TGFβ2-AS2蛋白是分泌性蛋白,在行使信号功能过程中发挥重要作用;另一方面,该蛋白的单跨膜结构为配体特异性结合相关受体提供分子基础。蛋白二级结构预测表明,绵羊TGFβ2及其剪切体蛋白均由α-螺旋、延伸、β-折叠和无规则卷曲 4 种结构组成,但这 4 种结构所占比例各不相同,已有研究发现, TGFβ2氨基酸序列中6个高度保守的半胱氨酸(Cys)能够通过链内的二硫键连接β片层结构形成一个半胱氨酸结,其在受体与配体的识别和作用方式上具有重要作用[34],由此推测TGFβ2及其剪切体β片层结构上存在的差异可能影响TGFβ2及其剪切体与受体的作用方式,从而在生物体内行使不同的生物学功能。同时,蛋白三级结构预测发现,绵羊TGFβ2及其剪切体蛋白空间结构比例亦存在差异,表明空间构想的变化可能与蛋白功能的多样性密切相关。此外,绵羊TGFβ2蛋白序列与人类、小鼠、大鼠、牛、猪和狗等哺乳动物具有较高的同源性,表明 TGFβ2基因可能是由同一个祖先基因遗传进化而来。其中,绵羊TGFβ2编码的氨基酸序列与人类的序列相似性极高(98.42%),这与系统进化树的结果相一致, 推测绵羊 TGFβ2基因可能存在与人类 TGFβ2基因相似的生物学功能。本试验对绵羊TGFβ2及其剪切体蛋白信号肽、跨膜结构和蛋白二、三级结构的预测分析为进一步阐明其在毛囊生长和毛品质形成中的分子调控机制提供研究基础。
4 结 论
本试验首次克隆获得绵羊TGFβ2及其剪切体 TGFβ2-AS1 和 TGFβ2-AS2 的 CDS,序列分析发现 TGFβ2 基因 CDS 在物种间存在高度保守性。对TGFβ2及其剪切体蛋白理化性质、跨膜结构、信号肽以及蛋白高级结构进行预测分析,为进一步研究TGFβ2在绵羊毛囊发育和毛品质性状形成中的作用机制提供理论基础。
