青稞类钙调素蛋白基因 CML19的克隆、序列分析及原核表达
2018-08-02韦泽秀原红军王玉林徐齐君曾兴权尼玛扎西
韦泽秀,原红军,扎 桑,王玉林,徐齐君,曾兴权,尼玛扎西,4
(1.西藏自治区农牧科学院 农业资源与环境研究所,拉萨 850002;2.省部共建青稞和牦牛种质资源与遗传改良国家重点实验室,拉萨 850002;3.西藏自治区农牧科学院 农业研究所,拉萨 850002;4. 西藏自治区农牧科学院,拉萨 850002)
青稞(Hordeumvulgare. L. var.nudumHK.f.)为禾本科大麦属,又名裸大麦、米大麦,含有丰富的β-葡聚糖、膳食纤维、支链淀粉,为藏族人民的主要粮食作物,其产量直接关系到藏区人民的经济和生活。青稞主要生长在海拔高、温度低、日照长、昼夜温差大的地区,对环境的抗逆性较强[1]。近年来,研究者先后对青稞的抗盐性[2]和抗旱性[3]等进行研究,以期明确青稞的抗逆机制,筛选有应用价值的基因,为选育抗逆性强的优良品种提供理论依据。
类钙调素蛋白(CaM-like protein,CML)是一类广泛存在植物中的与钙调素蛋白同源的Ca2+结合蛋白,通常含有1~6个结合Ca2+的EF手单元[1]。类钙调素与钙调素一样,具有广泛的生物学功能,如调节植物细胞的形态与分裂[4-5]、调节植物开花和自体吞噬[6-7]、调节花粉粒萌发和花粉管伸长[8-9]、参与植物生长发育过程中的光信号和激素信号[10-11],响应ABA、盐、紫外光、低温等多种逆境胁迫[12-15]及调节植物对病原菌的防卫反应[16-17]等。在拟南芥中的研究发现,CML42功能缺失突变体的表皮毛分支数增加[4]、开花延迟[7],CML9能够调节ABA介导的胁迫应答[12],CML18参与盐胁迫信号的转导[18]。鉴于CML蛋白功能的多样性,笔者采用转录组测序和抑制性差减杂交技术筛选青稞抗寒性相关基因,发现类钙调素蛋白基因 CML19(GeneBank登录号:XM_020329835),为进一步了解该基因的相关信息,本研究以青稞为材料,对 CML19基因进行克隆、序列分析及原核表达。
1 材料与方法
1.1 材 料
青稞种质‘喜马拉雅8号’和‘青稞320’由西藏自治区农牧科学院提供。
1.2 方 法
1.2.1 青稞种苗转录本的提取及反转录 取适量的青稞种子播种于富含有机质的盆栽土壤中,正常浇水管理,待植株生长至4叶期时,采用Jena InnuPREP RNA Mini Kit(Thermo Fisher公司)提取新鲜叶片RNA,采用反转录试剂盒TUREscript 1st Stand cDNA SYNTHESIS Kit(Aidlab公司)进行反转录,cDNA样本-20 ℃保存。
1.2.2 CML19基因的克隆 以转录组测序分析结果为基础,利用Primer Premier 5.0 软件设计特异引物CML19-F:5′-ATTGCGGGATCC- ATGGTGCACGCTGCGAC-3′和CML19- R:5′-ATTGCCCTCGAGCTACGCATCCATCATAA-CC-3′,下划线分别为BamHⅠ和XhoⅠ酶切位点。RT-PCR反应在S-1000 Thermal Cycler进行。PCR反应体系20 μL,包括TaqDNA聚合酶(TaKaRa,5 U/μL) 0.2 μL,10×PCR反应缓冲液(Takara) 2 μL,dNTP(10 mmol/L)1.6 μL,上、下游引物(10 μmol/L)各0.8 μL,cDNA 2 μL,灭菌水12.6 μL。扩增反应条件:94 ℃预变性4 min;94 ℃变性50 s,56 ℃退火45 s,72 ℃延伸1 min,34 个循环;72 ℃延伸10 min。用凝胶回收试剂盒回收目的片段,采用TaRaKa公司的DNA A-Tailing Kit加A后,连接于pMD18-T载体上,转化后挑阳性克隆测序。
1.2.3 CML19基因的序列分析 利用NCBI(http://ncbi.nlm.nih.gov/)的ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)和Conserved domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)、ProtParam(http://web.expasy.org/protparam/)、DISPHOS(http://www.dabi.temple.edu/disphos/)、InterProScan(http://www.ebi.ac.uk/interpro/search/sequence-search)、TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)、Signal IP(http://www.cbs.dtu.dk/services/SignalP/)、PredictProtein(https://ppopen.rostlab.org/)、NPS(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopm.html)和SWISS-MODEL(https://swissmodel.expasy.org/interactive)等在线工具对 CML19进行序列分析。根据推测的氨基酸序列,利用MEGA5.1软件进行氨基酸序列的同源性比对和进化树分析。
1.2.4 原核表达载体的构建及转化 将测序正确的阳性重组质粒pMD18- CML19与表达质粒PET28a(+)分别用BamHⅠ和XhoⅠ双酶切,凝胶回收目标片段,使用T4DNA连接酶于16 ℃连接过夜,转化后挑单克隆振荡培养,酶切鉴定阳性重组质粒。将鉴定正确的阳性质粒pET28a-CML19转化表达宿主菌BL21(DE3)感受态细胞,同时将空载体pET-28a(+)转化表达宿主菌BL21(DE3)作为阳性对照,BL21(DE3)感受态细胞不转化组作为阴性对照。
1.2.5 蛋白的诱导及检测 分别挑单克隆接种于5 mL LB液体培养基(含卡那霉素100 μg/mL),37 ℃振荡培养至OD600约为0.5时,取1 mL按体积比1∶100接种于含Kan(卡那霉素)的LB液体培养基中;将100 mL培养液分为2份,其中1份加IPTG诱导表达,另1份不加IPTG作为对照,加入IPTG至终浓度为1 mmol/L,继续振荡培养8 h。取IPTG诱导后菌液1 mL,离心,弃上清,沉淀用生理盐水洗涤后,采用超声波破菌法分别制备总蛋白、上清和沉淀样品,对取得的蛋白进行SDS-PAGE检测,观察蛋白条带[19]。对未诱导菌液做同样处理,观察表达情况,同时将转化pET-28a(+)的BL21作为对照。
2 结果与分析
2.1 CML19基因的克隆
以电子克隆延伸得到的序列(GeneBank登录号:XM_020329835)为基础设计特异引物,以青稞苗期叶片的cDNA为模板进行扩增,获得1个447 bp的cDNA片段(图1),测序分析显示该片段为预期的 CML19基因CDS全长(图2)。
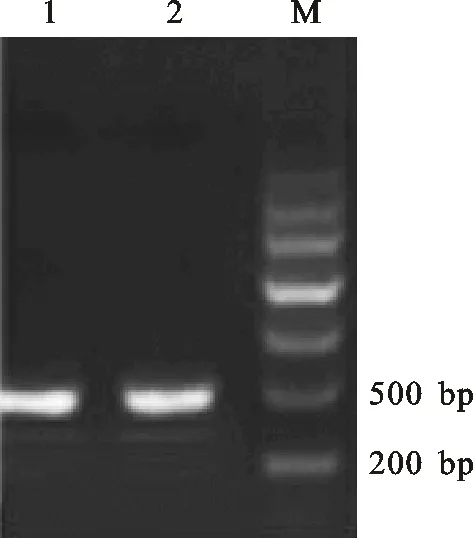
1~2.青稞 CML19扩增结果 Gene amplification results of Tibetan Hulless Barley CML19;M. DNA markerⅢ
图1青稞CML19基因凝胶电泳图
Fig.1DNAgelblotanalysisofCML19fromTibetanHullessbarley

图2 CML19基因测序结果Fig.2 Sequencing results of CML19 from Tibetan Hulless barley
2.2 CML19基因的序列分析
ORFfinder在线分析显示, CML19基因CDS全长447 bp,编码1个含148个氨基酸的多肽(图3)。ProtParam分析表明, CML19基因编码的多肽分子质量为16.46 ku,理论等电点(pI)为4.40,分子式为C702H1114N194O232S15,总平均亲水性(GRAVY)为-0.176,不稳定系数为49.59,编码的148个氨基酸中,包括31个带负电荷的氨基酸残基(天冬氨酸和谷氨酸),15个带正电荷的氨基酸残基(精氨酸和赖氨酸),其余氨基酸为非极性、疏水性氨基酸和极性、中性氨基酸,表明该蛋白为不稳定的亲水性蛋白。Disphos预测结果表明, CML19存在6个磷酸化位点(包括4个丝氨酸磷酸化位点,1个苏氨酸磷酸化位点和1个酪氨酸磷酸化位点),其中,只有1个丝氨酸磷酸化位点有功能(第26个氨基酸)。应用InterProScan和NCBI网站的Conserved domains分析显示,CML19蛋白存在典型的EF结构域。TMHMM预测该蛋白不含跨膜转移功能区。Signal IP 4.1预测该蛋白没有信号肽,不属于分泌蛋白。PredictProtein将该基因所编码蛋白亚细胞定位于细胞质。
Blastn分析发现, CML19基因序列与山羊草、乌拉尔图小麦、小米和短花药野生稻等植物的CML基因全长cDNA序列的相似度分别为88%、84%、68%和68%,推导的氨基酸序列同源比对分析结果表明,该基因编码蛋白与山羊草、乌拉尔图小麦、小米、短花药野生稻的CML蛋白的相似度分别为88%、84%、68%、67%。基于氨基酸序列的系统进化树表明,青稞CML19蛋白与山羊草具有较近的亲缘关系(图4)。
NPS二级结构预测结果显示,98个氨基酸属于α-螺旋,占66.22%;9个氨基酸为延伸链,占6.08%;9个氨基酸属于β-折叠,占6.08%;32个氨基酸属于无规则卷曲,占35.02%。应用SWISS-MODEL建立该蛋白的三级结构,如图5所示。

图3 CML19基因的CDS序列和推测氨基酸序列Fig.3 CDS sequence and deduced amino acids of CML19

图4 青稞CML19的系统进化分析Fig.4 Phylogenetic analysis of CML19 from Tibetan Hulless barley

A:CML19蛋白的二级结构预测 The predicted secondary structure of CML19 protein; h.α-螺旋α-helix; e. 延伸链 Stretched chain; t.β-折叠β-sheet; c.无规则卷曲 Random coil
B:CML19蛋白的三级结构预测 The predicted tertiary structure of CML19 protein
图5CML19蛋白的二级结构和三级结构预测
Fig.5ThepredictedsecondaryandtertiarystructureofCML19protein
2.3 CML19基因的原核表达
利用BamHⅠ和XhoⅠ双酶切重组质粒,得到的片段与预期大小相同(图6),进一步测序分析显示,CML19插入片段完全正确,未发生任何碱基突变。将重组质粒导入BL21(DE3)后,经IPTG诱导8 h后收集菌体进行SDS-PAGE分析,结果显示融合蛋白诱导成功,与预期大小(16.46 ku)相近,融合蛋白主要存在于菌体沉淀中,上清中极少(图6),表明得到的CML19诱导蛋白主要以包涵体形式存在。
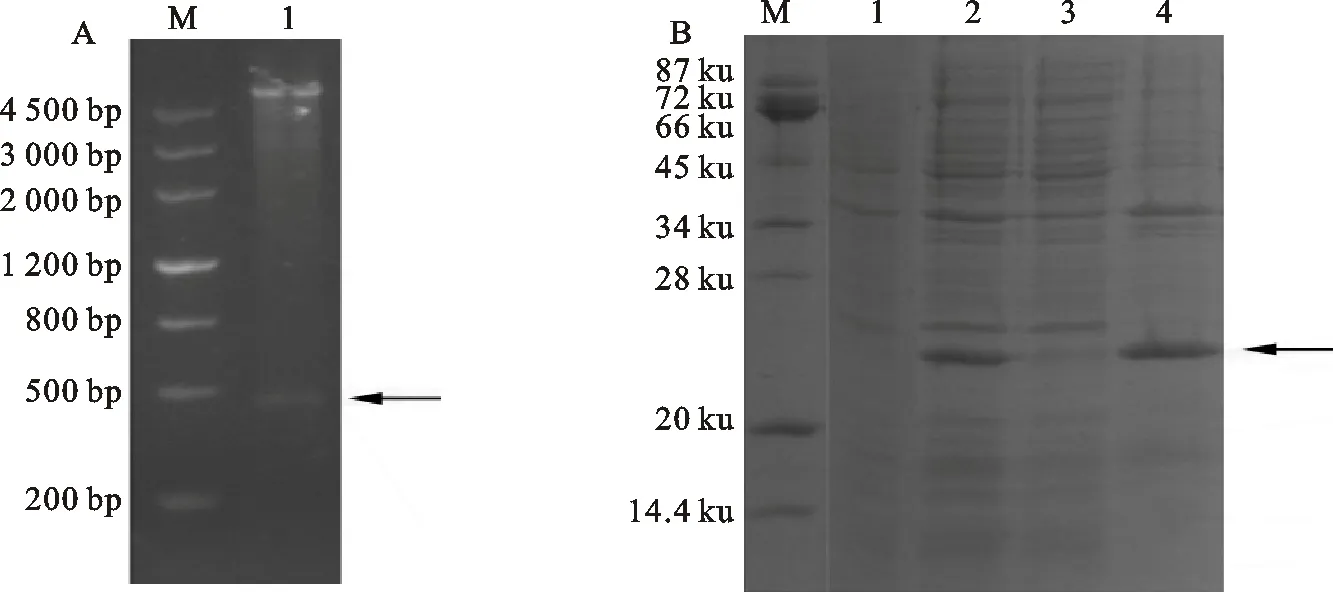
A:M. DNA maker; 1. pET28a- CML19双酶切产物 The product from pET28a- CML19 by double enzyme digestion
B:M.标准蛋白分子质量 Protein marker; 1. 未诱导 Uninduced;2. 诱导后全菌 Whole bacteria after induced; 3. 诱导后上清 Supernatant of induction; 4. 诱导后沉淀 Precipitation of induction
图6pET28a-CML19重组质粒的双酶切(A)和重组蛋白的SDS-PAGE分析(B)
Fig.6AnalysisofpET28a-CML19recombinantplasmiddigestedbydoubleenzymes(A)andSDS-PAGEoftheexpressedprotein(B)
3 讨 论
中国是大麦的起源地之一,种质资源极为丰富,尤其是裸粒类型占有特别突出的地位,裸大麦在中国西藏、青海等地常称为“青稞”。青稞具有丰富的营养价值和突出的医药保健作用。在高寒缺氧的青藏高原,不乏百岁老人,这与常食青稞及青稞突出的医疗保健功能是分不开的。和其他作物一样,现代青稞选育亦是以高产、优质和抗逆为主要目标,因此研究其遗传背景对于选育高产优产抗寒的农作物具有重要意义。
植物的生长发育和逆境响应不是相互孤立, 而是紧密联系的。不良环境条件引起植物产生的生理反应有利于植物适应环境胁迫以完成整个生命周期。其中,Ca2+信号在植物生长发育和逆境响应过程中具有重要作用,由于植物生长的环境具有动态变化和充满胁迫的特点, 钙感受器的多样性和丰富性可能对植物生长发育和生殖的顺利完成至关重要。CML 作为一类钙感受器, 对其生理功能的研究有助于明晰 Ca2+信号介导的调控网络并解答钙感受器如何解读钙信号并产生特异性反应。基因芯片等基因表达数据表明,很多CML基因对各种非生物胁迫都有不同程度的响应[1,13-15],如拟南芥 CML6、CML17、CML28、CML37、CML40、CML44和 CML50等受盐和干旱诱导, CML8、CML13、CML18和 CML25等受盐和干旱抑制[1,13,20]。水稻CML基因 OsMSR2也受多种非生物胁迫诱导,而且过量表达 OsMSR2使转基因植物对ABA 的敏感性增强,对盐和干旱的抗性也增强[1, 21]。人们发现 CML19功能敲除突变体cml19 以及 CML19沉默的突变体对UV胁迫都更敏感,并且它们在体外DNA 损伤修复的效率都降低,而过量表达 CML19使植物DNA 损伤的修复增强[1, 22]。进一步研究表明,UV 胁迫促进CML19蛋白的表达,而且UV胁迫使CML19 从细胞质快速转移至细胞核[1, 23]。本试验克隆得到的青稞CML19的功能尚不清楚,利用转录组测序和抑制性差减杂交技术筛选青稞抗寒相关基因的过程中发现, CML19包含其中,推测其与青稞的抗寒性相关。因此,需要对 CML19基因进一步克隆和序列分析,同时进行原核表达,探究其在体外的表达情况,为研究CML19蛋白与青稞的抗寒性奠定基础。
