茎尖转化法转基因小麦后代的遗传特性分析
2018-08-02董福双刘永伟吕孟雨
董福双,刘永伟,吕孟雨,周 硕,杨 帆
(河北省农林科学院 遗传生理研究所,河北省植物转基因中心,石家庄 050051)
目前大多转基因技术,都离不开组织培养,存在着受基因型限制、操作复杂、需借助抗性标记筛选、周期长、转化效率低、转化结果不稳定等突出问题。为了避免以上问题,利用植物活体直接转化也受到诸多研究者们关注,如花粉管道法、种子吸涨法、植物茎尖转化法等[1]。农杆菌转化微创芽生长点法是以植物茎尖为转化受体的一种活体转基因方法,可摆脱离体培养技术,适合于组织培养困难型的作物品种,已在向日葵[2]、棉花[3],苜蓿[4]玉米[5]、水稻[6]、小麦等[7-8]作物中有转化成功的报道,并且在一些作物中获得较高的转化效率。但以往研究大多集中在转化方法和转化技术方面,至于转化成功后对外源基因在遗传后代的遗传分析并未见报道。转基因植株的后代遗传分析鉴定,不仅是直接检验转化效率、转化技术和转化条件的最有效手段,而且是研究外源基因在转化后代中的整合、遗传分离组合、表达规律等方面的基础,更重要的是对转化品系的实际应用价值的判定和将具有优良农艺性状的其他外源基因的成功转化,以及转化后的整合、表达规律和应用提供理论和技术依据。
本试验以“农杆菌转化微创小麦芽生长点法”获得的3个世代转基因小麦后代为研究材料,通过对转基因后代的检测及遗传规律的分析,探讨外源基因在转化后代中的遗传分离规律,为其应用提供理论依据。
1 材料与方法
1.1 材 料
利用“农杆菌转化微创小麦芽生长点法”获得的小麦品种‘金禾9123’‘石4185’‘周麦18’‘济麦22’等转基因小麦后代株系为试验材料。编号为08D、10D的株系,转化所用质粒为pCAMBIA-2201含有新霉素磷酸转移酶基因(npt-Ⅱ)和β-葡萄糖苷酸酶基因(gus);其他转基因株系转化所用质粒为pCAMBIA-3301含双丙氨酰磷抗性基因(bar)、β-葡萄糖苷酸酶基因(gus)。
1.2 方 法
1.2.1 转基因材料的获得 利用“一种充分微创种子芽生长点的单子叶植物转基因方法”(专利号:2012103003229)转化小麦:用摄子掰去萌动1~2 d 小麦胚芽鞘和部分叶片暴露出生长点,利用农杆菌侵染微创后的生长点进行活体转化,转化后的小麦按单株收获T0种子,将T0种子萌发成苗进行抗性筛选及分子检测,获得T1代转基因植株。经抗性筛选及分子检测为阳性的T1、T2、T3和T4代植株也按单株播种或收获。
1.2.2 转基因后代的抗性筛选 将转入新霉素磷酸转移酶基因(npt-Ⅱ) 的后代材料,进行抗卡那霉素筛选:75 mg·L-1卡那霉素溶液浸种36 h左右至发芽,摆放到用水浸湿的蛭石培养钵中,25 ℃下每天光照 14~16 h培养, 7 d后统计结果中白化的为非抗性株[10]。
将转入双丙氨酰磷抗性基因(bar)的后代材料,进行抗除草剂(PPT)筛选:将种子胚向上摆放于蛭石中,于25 ℃、16 h/d光照条件下7 d左右,待苗长至两叶一心后,将第1片叶正面用记号笔划一横线,在横线处正反两面涂抹100 mg/L的PPT溶液,于25 ℃、16 h/d光照条件下培养7 d后统计结果,以叶片保持绿色不变黄的为抗性植株,叶片黄化失绿的为非抗植株。
1.2.2 转基因后代的分子检测 用2×CTAB法提取具有PPT抗性植株叶片的基因组DNA。新霉素磷酸转移酶基因(npt-Ⅱ)的PCR检测引物序列为:5′-CCACCATGATATTCGGCAAC-3′和5′-GTGGAGAGGCTATTCGGCTA-3′。双丙氨酰磷抗性基因(bar)的PCR检测引物为:P1:5′-GAAGTCCAGCTGCCAGAAAC-3′和P2:5′-GTCTGCACCATCGTCAACC-3′;2种基因扩增片段长度为500 bp。反应体系为20 μL包含1 UTaq酶,2种引物为0.25 μmol/L,250 μmol/L的dNTP。程序为:95 ℃预变性3 min,95 ℃45 s,58 ℃ 45 s,72 ℃ 1 min 循环35次,72 ℃。PCR产物经15 g/L的琼脂糖凝胶电泳分离并照像。取阳性植株PCR产物经10 g/L的琼脂糖凝胶80 V稳压电泳1~2 h后,按分子克隆中的方法(molecular cloning)将DNA转移至尼龙膜上,以npt-Ⅱ/bar基因做探针与之进行杂交,按照Dig High prime DNA labeling and Detection Starter KitⅡ(罗氏公司)试剂盒进行。
2 结果与分析
2.1 转基因后代材料的抗性筛选和分子检测
将转基因小麦后代材料,每个世代均按单株收获,萌发种子成苗,经过抗性筛选(图1、图2)和进一步的PCR检测(图3)来确认转基因材料,并选择部分阳性株进行PCR-Southern blot检测,结果表明:经过抗性筛选的95%的抗性苗PCR分子检测为阳性,选择部分PCR阳性株进行PCR-Southern blot检测均为转基因的植株(图4)。

图1 转基因后代的卡那霉素筛选Fig.1 Kanamycin screening of transgenic plants

图2 转基因后代的除草剂筛选Fig.2 Herbicide screening of transgenic plants
2.2 转基因小麦后代检测结果与分析
通过对“农杆菌转化微创小麦芽生长法”获得的3个世代的转基因小麦后代分析,结果表明小麦转基因后代出现遗传分离,转基因株和非转基因株分离比例在大多数转基因后代株系中并不规律,一般出现3种遗传分离情况:①转基因后代外源基因完全丢失,检测不到外源基因;②转基因后代能够检测到外源基因,但转基因株和非转基因株分离比例分散,偏离孟德尔遗传分离规律;③转基因后代能够检测到外源基因,并且转基因株和非转基因株分离比例符合孟德尔遗传规律。
利用“农杆菌转化微创小麦芽生长点法”获得的T1代转基因小麦,为外源基因插入整合世代,不存在遗传分离现象,因此T1代转基因植株检测是用来统计转化率的,未做遗传分离统计分析。
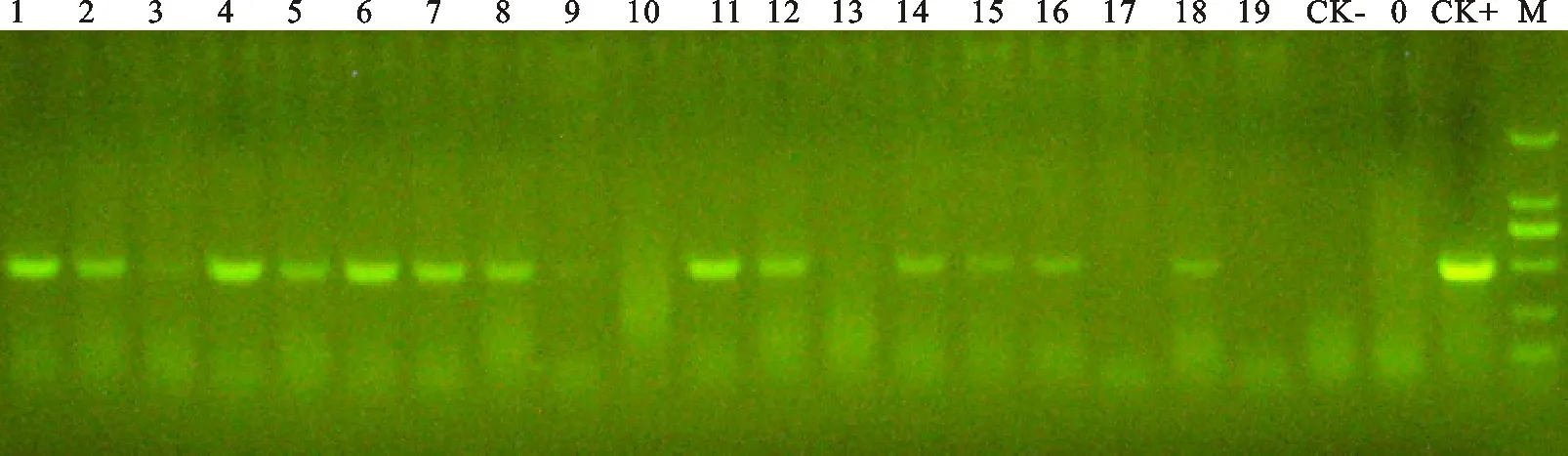
1~19.检测样品 Samples; 0.空白对照 Blank;CK-.阴性对照 Negative CK;CK+.阳性对照 Positive CK;M.DL 2000 marker
T2代33个株系的677个转基因单株分析检

CK.阳性对照 Positive CK;1.空白对照 Blank CK;2.阴性对照 Negative CK;3~11.检测样品 Samples
图4PCR-Southern检测
Fig.4PCR-Southernanalysisoftransformants
测的结果表明,转基因株与非转基因株分离比例在T2代中出现2种遗传分离情况:20个株系(占总株系的61%)中检测不到外源基因,外源基因完全丢失;其余13个株系(39%)中检测到了外源基因,但转基因株与非转基因株分离比例偏离孟德尔遗传分离规律(表1)。
T3代42个株系的922单株检测分析结果表明,转基因株与非转基因株分离比例在T3代转基因后代出现3种遗传分离情况:①有22个株系(55%)检测不到外源基因,属于完全丢失;②有19个株系(43%)能检测到外源基因,但转基因株和非转基因株分离比例复杂;③有1个株系(2%)转基因株和非转基因株分离比例符合孟德尔分离(表2)。
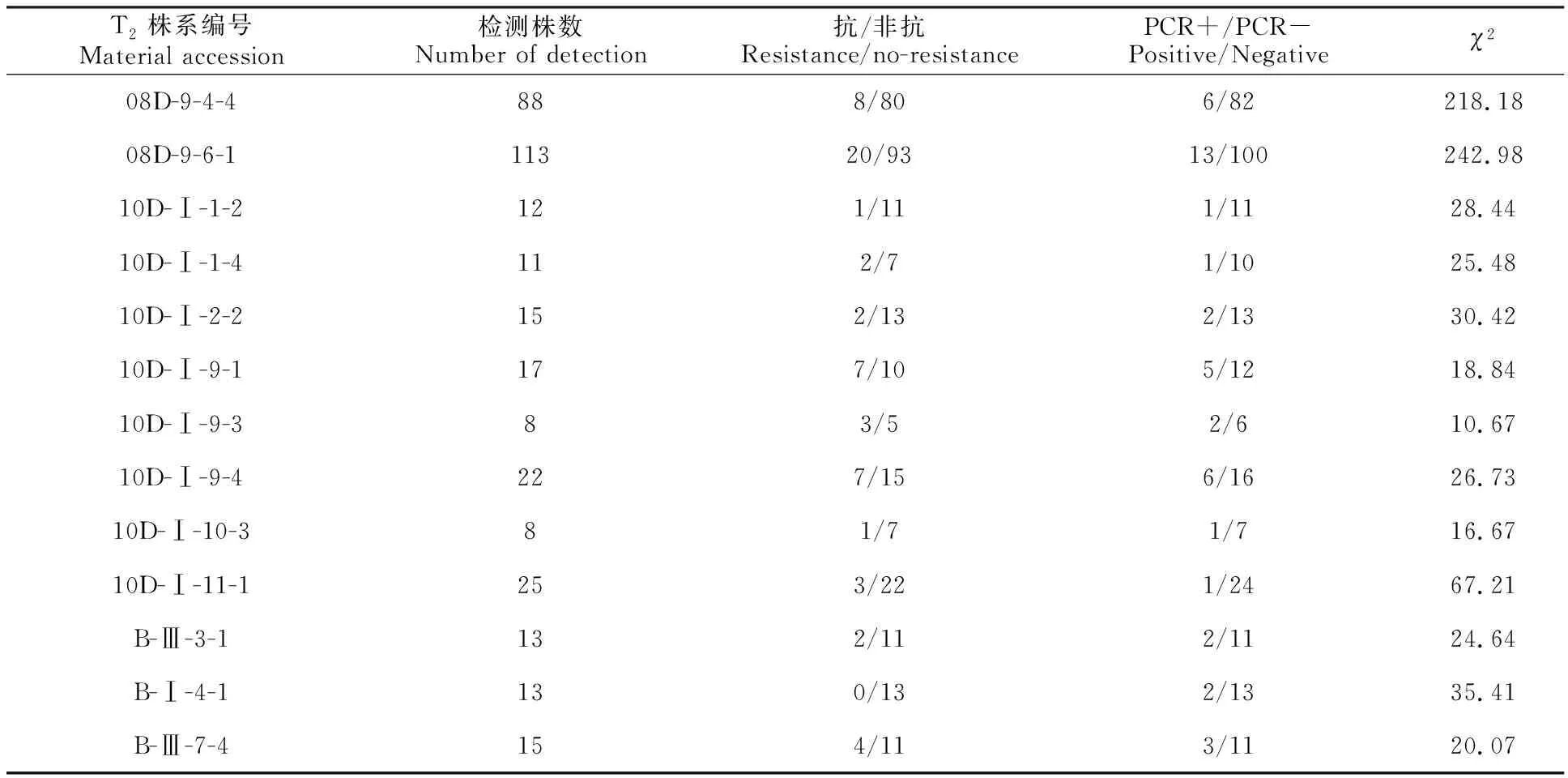
表1 T2代检测到外源基因株系的分离情况Table 1 Statistical table of transgenic T2 generation


T4代8个株系的160单株检测分析结果表明,T4代株系的转基因株与非转基因株分离比例出现3种遗传分离情况①检测不到外源基因,属于完全丢失占25%;在能检测到外源基因但分离比例复杂的占50%,符合孟德尔分离定律占25%(表3)。
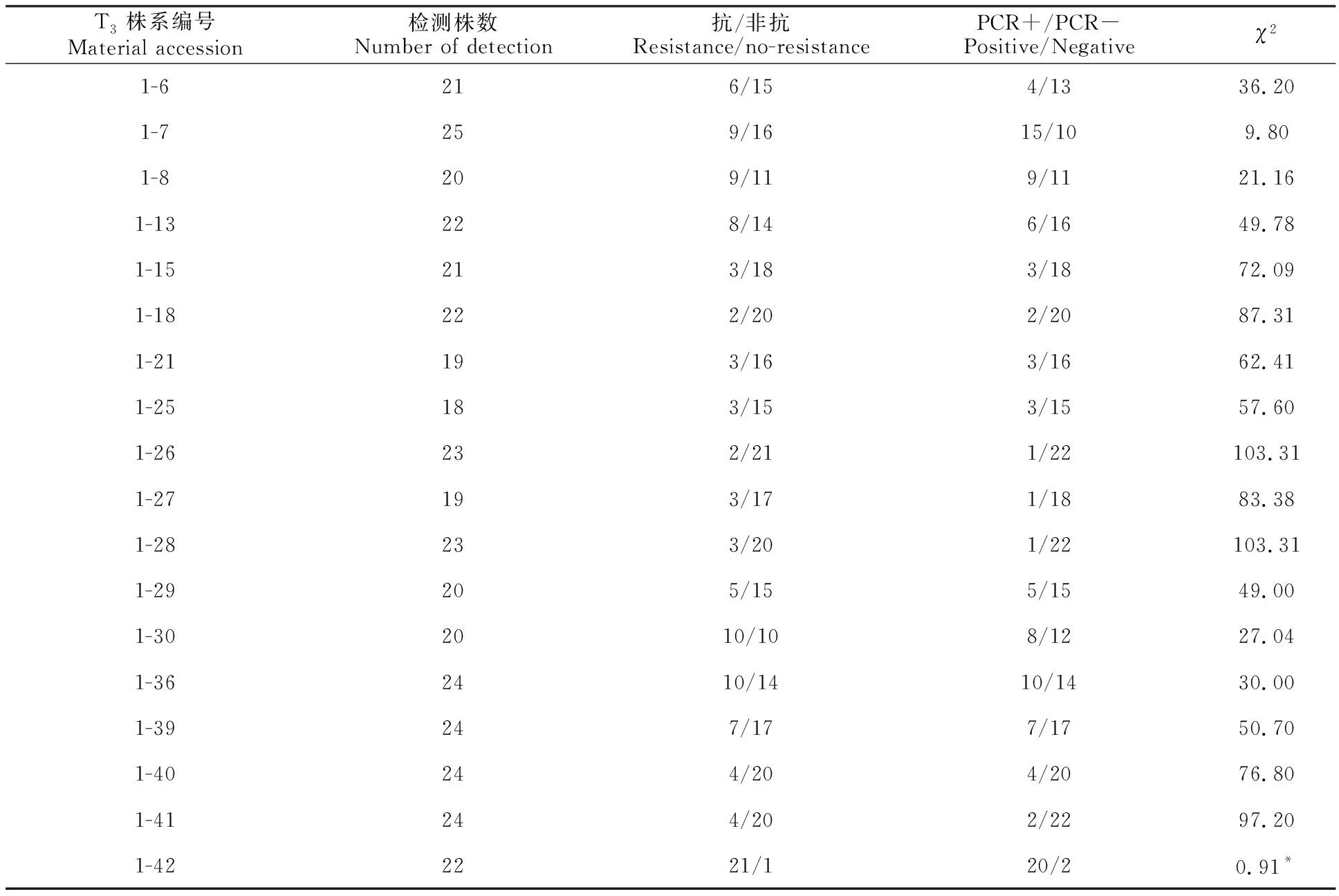
表2 T3代检测到外源基因株系的分离情况Table 2 Statistical table of analysis of the transgenic T3 generation
注:“*”,χ2测验分离比率符合孟德尔遗传分离比例,下同。
Note: “ *”,χ2test separation ratio meets Mengdeer genetic separation ratio,the same below.

表3 T4代小麦转基因植株的检测结果Table 3 Statistical table of the transgenic T4 generation
3 讨 论
采用“农杆菌转化微创小麦芽生长点法”获得转基因小麦后代,外源基因遗传表现不稳定,其株系之间遗传分离比例呈现多样性,并存在大量外源基因丢失情况,随着世代的增加,外源基因遗传稳定性有升高的趋势。此结果与马盾等[10]报到的花粉管道法获得的转基因后代外源DNA遗传表现不稳定,遗传分离呈多样性的结论相似。而通过传统方法(转化技术中包括组织培养过程)获得的转基因后代多数符合孟德尔遗传规律[11-15]。分析其原因可能如下:通过组织培养的方法获得的转基因植物,其中抗性筛选参与在愈伤组织诱导、不定芽分化、不定根形成等无性繁殖过程中,将未转化或外源基因插入表达不稳定的细胞淘汰掉,留下表达稳定的细胞分化成植株,因此利用此途径获得转基因后代更容易稳定遗传。而利用芽生长点等活体转化方法获得转基因植株,转化技术中没有抗性筛选无性繁殖培养的过程,那些插入不稳定的外源基因容易被保留下来,而在再一次的有性繁殖过程中更容易丢失,所以转基因后代T2代丢失严重,随着世代的增加外源基因遗传稳定性有升高,也是必然趋势。因此在活体转化技术体系中如何提高转基因后代的遗传稳定性是改进转化技术体系的关键因素之一。
