参一胶囊对晚期非小细胞肺癌临床化疗效果及免疫功能的影响分析
2018-08-01于同月崔昊震张松男马丽霞
于同月 崔昊震 张松男 马丽霞
(延边大学中医学院,延吉 133000)
无论发病率还是死亡率,肺癌均居恶性肿瘤之首,其中80%左右为NSCLC[1]。NSCLC一般确诊已为晚期,因此五年生存率小于5%。虽然放化疗能够在短时间内控制病情,但其对消化、血液系统的毒副作用也不容忽视。随着中医引入化疗后维持治疗,中西医结合治疗晚期NSCLC的临床重要性也日益突出。作为一种肿瘤新生血管抑制剂,临床报道参一胶囊对有效提升晚期NSCLC患者的临床疗效和生活质量有积极作用,为此,本研究对这一临床结论进行了进一步验证。
1 资料与方法
1.1资料 研究对象 为我院肿瘤科于2013年2月至2017年2月间收治的102例晚期NSCLC患者。其中,男性患者54例,女性患者48例,年龄46~79岁,平均(63.85±1.56)岁。所有患者均经细胞学检查或病理组织学检查确诊,按照TNM分期法[2],Ⅲb期患者33例,Ⅳ期患者69例。可测病灶数≥1,经CT扫描,最大病灶直径≥20 mm,经MRI或者螺旋CT扫描,最大病灶直径≥10 mm。KPS评分为50~80分,平均为(67±11)分。按照中医症候分类[3],阴虚内热证37例,脾虚痰湿证35例,气阴两虚证30例。所有患者均为初次放化疗,预计生存期大于3个月。患者血常规,肝肾功能以及心电图等指标正常,排除自身免疫系统、心血管系统疾病,精神病,过敏体质,严重感染及糖尿病等并发症。所有患者均知情同意。结合患者治疗意愿,将102例患者分为两组,观察组57例,对照组45例,两组一般资料相比差异无统计学意义(P>0.05)。
1.2方法
1.2.1治疗方法 两组患者均进行常规的止吐、护肝、护胃、护心等预防性治疗。对照组单纯使用GP方案:吉西他滨静脉滴注:第1天和第8天使用30 min,剂量为1 000 mg/m2;顺铂静脉滴注:第1~3天使用,剂量为25 mg/(d·m2)。21 d为一个周期,根据情况进行适当水化。观察组在对照组基础上从化疗开始使用参一胶囊口服,具体方法为:饭前0.5 h 温水送服,20 mg/次,2次/d,最少连续使用8周。在治疗过程中,严禁其他抗肿瘤或影响免疫功能之治疗方案或药物,如患者出现骨髓抑制,酌情使用升血球药物或相应对症措施。如果病情出现明显进展则立即中止试验,转用其他治疗方案。观察并记录两组患者的消化道反应和骨髓抑制等不良反应发生情况。
1.2.2疗效评价标准 采用RECIST标准:病灶完全消失为完全缓解,基线病灶最长径之和减少≥30%为部分缓解,基线病灶最长径之和减少<30%或增加<20%为稳定,基线病灶最长径之和增加≥20%或出现新病灶为进展[3]。总有效率=(完全缓解+部分缓解)/总病例数×100%,有效控制率=(完全缓解+部分缓解+稳定)/总病例数×100%。
1.2.3生活质量评价标准 治疗前后KPS评分增加≥10为升高,KPS评分增加或减少<10为稳定,KPS评分减少≥10为下降[4]。生活质量改善率=(升高+稳定)/总病例数×100%。
1.2.4免疫功能指标检测 于治疗前和治疗2个周期后使用流式细胞仪检测患者的血清CD3+、CD4+和CD8+等T细胞亚群,评估患者的免疫功能变化。
1.2.5体重变化评判标准 治疗前后体重增加≥1 kg 为增加,体重增加或减少<1 kg为稳定,体重减少≥1 kg 为下降[5]。体重改善率=(增加+稳定)/总病例数×100%。
1.2.6不良反应评价标准 使用抗癌药物WHO急性与压急性毒性评价标准,毒副作用分为0度,Ⅰ度,Ⅱ度,Ⅲ度和Ⅳ度[6]。
1.2.7总生存期和疾病无进展生存期评价标准 总生存期为临床试验开始到死亡之时间,疾病无进展生存期为试验开始到疾病出现进展或死亡之时间。
2 结果
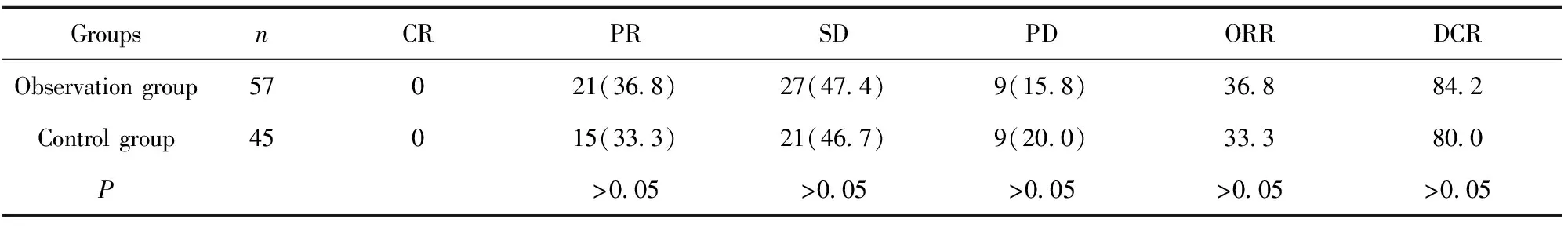
2.1近期临床疗效 两组患者均无完全缓解病例,观察组患者部分缓解为21例,稳定为27例,只有9例出现进展,分别占36.8%、47.4%和15.8%;对照组患者部分缓解为15例,稳定为21例,进展为9例,分别占33.3%、46.7%和20.0%。从总有效率和有效控制率来看,观察组的近期临床疗效优于对照组,但两组相比差异无统计学意义(P>0.05),详见表1。
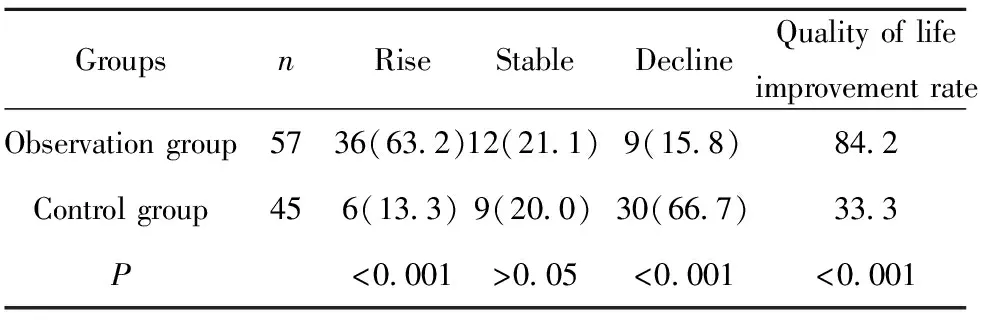
2.2生活质量评分 化疗2周后,观察组患者的KPS评分升高为36例,稳定为12例,下降为39例,分别占63.2%、21.1%和15.8%;对照组患者的KPS评分升高为6例,稳定为9例,下降为30例,分别占13.3%、20.0%和66.7%。从生活质量改善率来看,观察组显著高于对照组,差异具有显著统计学意义(P<0.001),详见表2。
表1两组近期临床疗效对比[n(%)]
Tab.1Comparisonofshort-termclinicalefficacybetweentwogroups[n(%)]
GroupsnCRPRSDPDORRDCRObservationgroup57021(36 8)27(47 4)9(15 8)36 884 2Controlgroup45015(33 3)21(46 7)9(20 0)33 380 0P>0 05>0 05>0 05>0 05>0 05
表2两组患者治疗两周后的生活质量对比[n(%)]
Tab.2Comparisonofqualityoflifeaftertwoweeksoftreatmentbetweentwogroups[n(%)]
GroupsnRiseStableDeclineQualityoflifeimprovementrateObservationgroup5736(63 2)12(21 1)9(15 8)84 2Controlgroup456(13 3)9(20 0)30(66 7)33 3P<0 001>0 05<0 001<0 001
表3两组患者治疗后体重变化对比[n(%)]
Tab.3Comparisonofweightchangeaftertreatmentbetweentwogroups[n(%)]
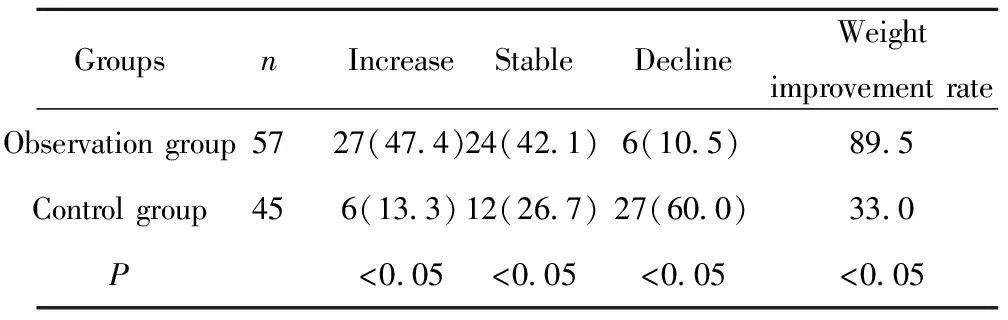
GroupsnIncreaseStableDeclineWeightimprovementrateObservationgroup5727(47 4)24(42 1)6(10 5)89 5Controlgroup456(13 3)12(26 7)27(60 0)33 0P<0 05<0 05<0 05<0 05
表4两组不良反应发生率对比[n(%)]
Tab.4Comparisonofadverseeffectsratebetweentwogroups[n(%)]
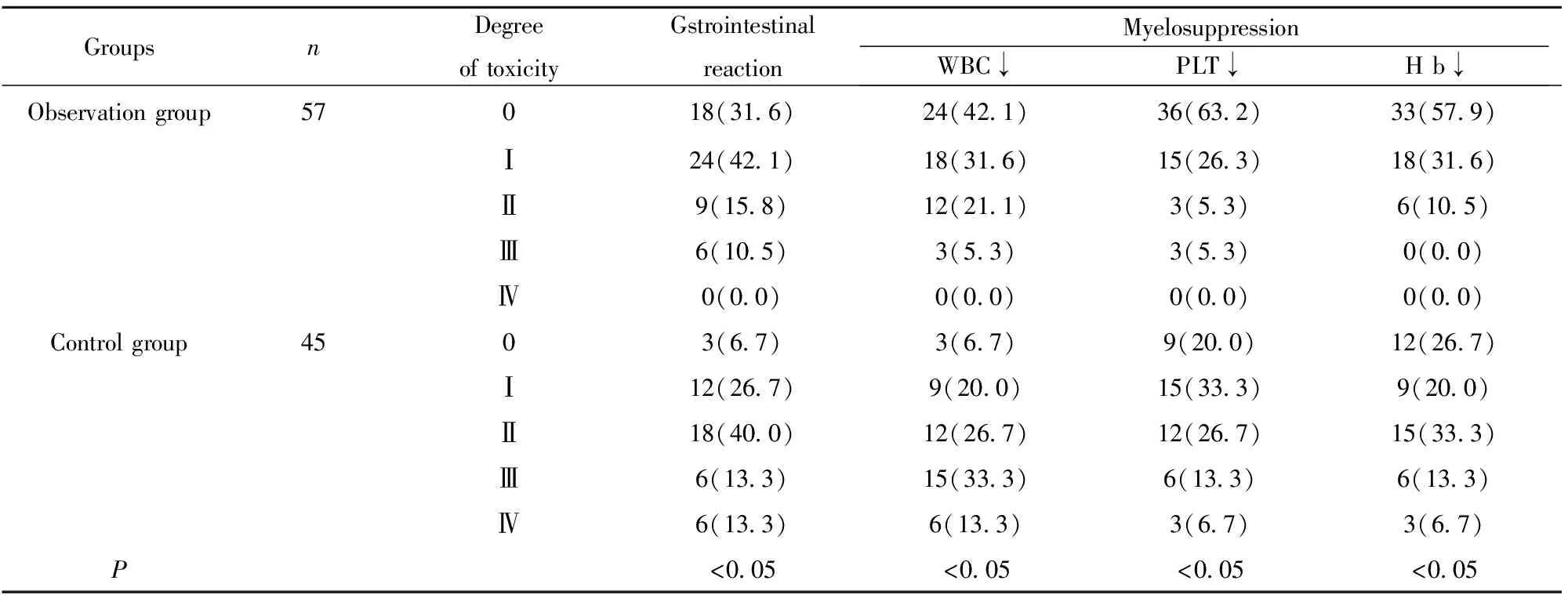
GroupsnDegreeoftoxicityGstrointestinalreactionMyelosuppressionWBC↓PLT↓Hb↓Observationgroup57018(31 6)24(42 1)36(63 2)33(57 9)Ⅰ24(42 1)18(31 6)15(26 3)18(31 6)Ⅱ9(15 8)12(21 1)3(5 3)6(10 5)Ⅲ6(10 5)3(5 3)3(5 3)0(0 0)Ⅳ0(0 0)0(0 0)0(0 0)0(0 0)Controlgroup4503(6 7)3(6 7)9(20 0)12(26 7)Ⅰ12(26 7)9(20 0)15(33 3)9(20 0)Ⅱ18(40 0)12(26 7)12(26 7)15(33 3)Ⅲ6(13 3)15(33 3)6(13 3)6(13 3)Ⅳ6(13 3)6(13 3)3(6 7)3(6 7)P<0 05<0 05<0 05<0 05
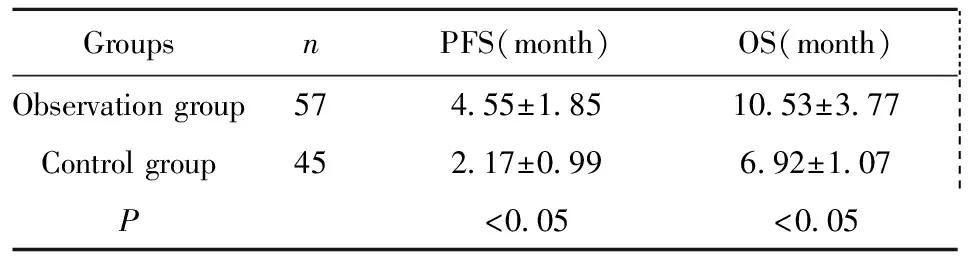
GroupsnPFS(month)OS(month) Observationgroup574 55±1 8510 53±3 77 Controlgroup452 17±0 996 92±1 07 P<0 05<0 05
2.3治疗前后患者体重变化 化疗2周后,观察组患者体重增加为27例,稳定为24例,下降为6例,分别占47.4%、42.1%和10.5%;对照组患者体重增加为6例,稳定为12例,下降为27例,分别占13.3%、26.7%和60.0%。从体重改善率来看,观察组明显优于对照组,差异具有显著统计学意义(P<0.05),详见表3。
2.4不良反应 观察组消化道反应和骨髓抑制(白细胞,血小板和血红蛋白下降)显著少于对照组。观察组患者的Ⅳ度毒副作用发生率为0、Ⅱ度、Ⅲ度毒副作用的发生率也比较低,患者主要集中于0度和Ⅰ度,毒副作用比较低。而对照组则集中于Ⅰ~Ⅲ度,Ⅳ度毒副作用也比较明显,与观察组相比差异具有显著统计学意义(P<0.05),详见表4。
2.5总生存期和疾病无进展生存期 截止2017年2月,通过随访,观察组患者平均疾病无进展生存期为(4.55±1.85)月,平均总生存期为(10.53±3.77)月;对照组患者平均疾病无进展生存期为(2.17±0.99)月, 平均总生存期为(6.92±1.07)月, 差异具有显著统计学意义(P<0.05),具体见表5。
2.6免疫功能指标变化 两组患者治疗前的CD3+、CD4+、CD8+、CD4+/CD8+相比没有显著统计意义(P>0.05),治疗前后两组患者的CD3+、CD4+、CD8+、CD4+/CD8+相比具有显著统计意义(P<0.05),而且治疗后两组患者CD3+、CD4+、CD8+相比具有显著统计意义(P<0.05),但CD4+/CD8+相比没有显著统计意义(P>0.05),见表6。
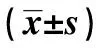
GroupsnTimeCD3+CD4+CD8+CD4+/CD8+ Observationgroup57Priortreatment59 25±2 6837 88±2 2527 44±3 221 38±0 54 Posttreatment7 42±3 186 74±2 247 05±1 160 96±0 58 Controlgroup45Priortreatment58 38±3 1038 11±3 5227 55±3 181 38±0 86 Posttreatment1 31±0 271 45±2 291 51±0 220 96±0 33 P<0 05<0 05<0 05>0 05
3 讨论
化疗是晚期非小细胞肺癌治疗的主选方案,铂类联合制剂是其临床主打药物。但从临床研究结果来看,联合铂类的化疗效果发展已经近于瓶颈期,不仅对患者生存期的改善作用有限,而且毒副作用还比较严重。严重的毒副作用会弱化患者的免疫系统,进而从客观上影响临床化疗效果[6]。关键在于,严重的毒副作用所造成的恶心、呕吐等消化道反应和体重锐减,在严重影响患者生存质量的同时,还动摇患者对抗病魔的信心,使得患者的治疗依从性大幅下降,从而从主观上影响临床化疗效果。因此,对于晚期非小细胞肺癌治疗的研究,至少可以从两个方向进行。一是基于分子生物学精准直击肿瘤细胞的毒副作用小的靶向药物研发;二是基于化疗药物与中药制剂联用的旨在兼顾减轻毒副作用,提高患者生存质量以促进临床放化疗效果的中西医结合维持疗法探索[7]。参一胶囊是我国基于肿瘤抗血管生成治疗理论的自主研发的口服中成药,主要成分为人参皂苷Rg3。有实验表明,人参皂苷Rg3能够抑制肿瘤生长,而且可于G2/M肿瘤细胞增殖周期诱导细胞凋亡,抑制肿瘤新生血管生成,从而达到选择性的抑制肿瘤细胞浸润和黏附的效果,具有抑制肿瘤转移的作用[8]。另据报道,人参皂苷Rg3还具有调节人体免疫功能的作用[9]。临床研究表明,化疗后使用参一胶囊进行维持治疗,能够显著提高晚期非小细胞肺癌的临床化疗效果[10]。本研究的统计结果显示,虽然观察组的总有效率和有效控制率分别为36.8%和84.2%,高于对照组的33.3%和80.0%,但不存在显著统计学意义(P>0.05)。这可能与RESIST评价标准有一定的关系。RESIST评价标准以基线病灶最长径,亦即肿瘤体积,作为主要评估指标,其单一化的评价指标可能导致临床化疗效果评价的不够确切[11]。这与参一胶囊这种抗血管生成药的药理作用机制存在相关关系。参一胶囊通过抑制肿瘤新生血管的生成,阻断肿瘤细胞的营养供应,从而使得肿瘤新生血管退化,最终导致肿瘤细胞呈现空洞性坏死[12]。故而肿瘤体积变化缓慢,基线病灶最长径并不会迅速缩短。
而观察组在生活质量改善率、体重改善率、免疫功能指标变化、减轻毒副作用以及延长患者总生存期和疾病无进展生存期上,均显著优于对照组,相比具有显著统计学意义(P<0.05)。依照中医理论,晚期NSCLC患者或表现为脉数(一息过五至),舌绛红,低热,咳嗽无痰抑或少痰,口干并伴有失眠盗汗的阴虚内热证;抑或表现为脉濡滑、舌淡胖、咳嗽多痰、便溏、神疲乏力伴有自汗的脾虚痰湿证;抑或表现为脉细弱、舌偏红伴有齿印、咳嗽少痰、口干气短、神疲乏力伴有盗汗自汗的气阴两虚证。治疗虚症,自古首推人参,采其补阴中之阳,阳中之阴,舒胃健脾,益气活血之功效。参一胶囊中的主要成分是人参皂苷中活性最高的Rg3,其可以抑制肿瘤实体组织的新生血管生成过程,阻断肿瘤细胞生长,阻止肿瘤细胞有丝分裂,降低肿瘤浸润概率,进而抑制肿瘤细胞转移。同时,人参皂苷Rg3还具有促进脾淋巴细胞增殖的作用,使CD3+、CD4+、CD8+向正向免疫方向漂移,提高患者的免疫力,使患者的生存期得以增加[13-18]。
总之,参一胶囊能够提高晚期NSCLC患者生活质量,改善患者体重,优化患者免疫系统,减轻患者化疗毒副作用,延长患者总生存期和疾病无进展生存期的临床效果是确凿无疑的。其与GP方案联用,对缓解化疗过程所带来的毒副作用,增强患者免疫力,降低消化道反应和骨髓抑制等不良反应的发生具有非常显著的效果。这对提高晚期NSCLC患者的临床化疗疗效,改善患者生活质量来讲是至关重要的。