肾移植术后乳腺癌研究进展①
2018-08-01宋田利张一帆张颖超张金香徐景伟
宋田利 张一帆 张颖超 王 丹 张金香 徐景伟
(吉林大学白求恩第二医院乳腺外科,长春 130041)
随着器官移植技术的提高以及免疫抑制剂的广泛应用,很大意义上增加移植器官或受者移植物的存活率。同时免疫抑制剂的广泛应用却增加了移植术后恶性肿瘤发生的风险。目前肾移植术后乳腺癌(Posttransplant breast cancer,PTBC)的发生率逐年升高,引起了学界的广泛关注。由于其治疗需同时考虑到乳腺癌和移植肾的功能,缺乏理论基础,因此PTBC的治疗成为临床医师们的棘手问题。有关此类群体的临床研究较少,其治疗策略尚未形成共识,亟需积累针对性的大规模临床观察和研究。本文拟探讨和总结近年来肾移植术后乳腺癌的临床特点、免疫抑制剂应用、治疗等相关问题。
1 肾移植与乳腺恶性肿瘤
1.1肾移植术后恶性肿瘤 有学者提出肾移植术后患者恶性肿瘤的风险高于一般人群,肾移植患者的总体癌症风险是一般群体的2.1倍,其中实体肿瘤风险是一般群体的1.6倍[1]。有研究报道1997年至2009年间7 153例肾移植患者,随访5年发现467(6.5%)例患有癌症,最常见的癌症类型是泌尿生殖器(124例,31.5%),其次是移植后淋巴增生性疾病(n=79,20.1%),黑素瘤(n=68,17.3%),结直肠癌(n=37,9.4%),前列腺癌(n=32,8.1%),肺癌(26例,6.6%)和乳腺癌(15例,3.8%)[2]。Vegso等[3]研究报道了1973年至2007年间2 535例肾移植患者,188例(7.6%)患者发现195个恶性肿瘤,其中卡波西肉瘤、淋巴瘤、皮肤癌等肿瘤发生率较高于一般群体,肝、肾、甲状腺等部位肿瘤分别可达3.25、6.77、8.95倍。Cheung等[4]统计分析了1972年至2011年间4 895肾移植患者,移植后肿瘤的整体标化发病率为2.94%,其中非霍奇金淋巴瘤、肾癌、膀胱癌较高。由此可见肾移植术后肿瘤的发病率高于一般群体,且存在某种类型的肿瘤高发倾向性。在英国,常见的是淋巴瘤、肾细胞癌等[5]。在澳大利亚地区皮肤癌的发生率非常高[6]。我国公开报道的1974年至2014年间 30 632例肾移植患者,术后新发恶性肿瘤671例,恶性肿瘤发病率约2.19%,是一般人群的11.86倍,明显高于一般人群,以泌尿系统、消化系统肿瘤高发[7]。由表1可见,肾移植术后恶性肿瘤的发病率各地区有所差别,我国恶性肿瘤发病率明显低于西方等其他国家,这可能与我国免疫抑制剂使用剂量相对减低相关。肾移植术后恶性肿瘤的发病率及发病类型各地区报道不同,这可能与不同种族及免疫抑制剂需求量产生的差异性相关。
1.2肾移植术后乳腺癌 关于肾移植术后发生乳腺癌的临床研究鲜见报道。Kasiske等[8]研究者调查了美国35 765例肾移植患者,发现肾移植术后患者肿瘤发病率为14.9%,其中乳腺癌的发病率与一般群体相比高出2倍。Kato等[9]对750例肾移植患者进行长期随访发现9例确诊为乳腺癌,从肾移植至确诊间隔时间为148.7±37.1个月,肾移植术后确诊乳腺癌的患者与一般群体比较随着时间延长乳腺癌发生率无明显改变,与免疫抑制剂持续使用导致恶性肿瘤发病率增加相矛盾,研究者认为每年体检筛查对于乳腺癌的早期确诊至关重要,肾移植术后乳腺癌患者早期治疗可有良好预后。Buell等[10]回顾分析114例肾移植术后乳腺癌患者,认为肾移植术后乳腺癌淋巴结转移与一般群体相比无明显增高,免疫抑制剂可能没有增加乳腺癌的发生率,可能是增加了乳腺癌的生物学侵袭性。由此可见,PTBC的发病率是否升高各研究观点不一,亟需针对此类疾病的大规模临床观察和研究。
Agraharkar等[11]研究者分析了1 739例肾移植患者,发现肾移植术后乳腺癌发病风险比一般群体略低,这可能是患者在器官移植前进行了详细的医学检查导致排除高危险性患者所致。Kwak等[12]分析了2 139例肾移植患者数据,其研究资料显示:11例发展成为乳腺癌,患者5年生存率:Ⅰ期97.7%、Ⅱ期92.9%、Ⅲ期78.6%、Ⅳ期49.9%,Ⅲ期患者预期5年生存率为66.7%,与总体乳腺癌患者比较无明显统计学差异,因此研究者认为PTBC患者预后与一般群体相当,免疫抑制剂的使用并不会对乳腺癌产生不利影响。器官移植患者乳腺癌的发病率与同年龄阶段的一般群体相当,但结果一般较差[13]。
2 免疫抑制剂与乳腺恶性肿瘤
大多数人认为随着免疫抑制剂的总剂量和使用时间的增加,肾移植术后恶性肿瘤发生率增加,这可能因为免疫抑制剂引起了DNA的改变和阻止了机体免疫监测机制。Kasiske等[8]认为免疫抑制剂可能引起移植后患者DNA破坏和干扰正常DNA修复;此外,多数肿瘤的发生也与移植术后的病毒感染有关。Hibberd等[23]认为免疫抑制剂的使用增加PTBC的发病率。乳腺癌发病率的差异性确切原因尚不明确,有学者认为移植术后患者乳腺癌发病率与免疫抑制剂直接相关[24]。
2.1环孢素A (CsA) 环孢素是目前肾移植术后免疫抑制剂的基石。它通过抑制机体免疫功能降低移植肾的免疫排斥反应,增加移植肾长期存活率。然而,CsA被发现具有致癌作用。研究显示用CsA处理的动物中发生的肿瘤表现出细胞增殖增强和细胞凋亡减少,转化生长因子(TGF-β)信号通路增强,(TGF-β)的表达增加,通过细胞自主性机制导致恶性肿瘤的产生[25,26]。此外,有研究证实环孢素A以钙调磷酸酶非依赖性方式影响血管内皮细胞以通过增加线粒体活性氧产生来促进肿瘤血管生成,促进肿瘤生长[27]。CsA通过CD8(+)T细胞降低T-bet依赖性癌症免疫监视可能导致移植受体的恶性肿瘤风险增加[28]。Seo等[29]研究了33例接受环孢素治疗的女性肾移植患者,11例共发现46个乳房肿块,通过病理学检查发现肿物腺瘤或纤维囊性改变。某些研究比较分析了486例应用环孢素治疗的肾移植患者和100例正常人群中乳腺肿瘤特点,发现肾移植患者中乳房肿瘤偏大、多发、密等特点[30]。由此可见,移植后恶性肿瘤的发生可能与环孢素的应用相关,环孢素可能同样会作用于乳腺腺体导致腺瘤的危险性增加。
表1不同地区肾移植术后恶性肿瘤发病率
Tab.1Incidenceofcancerafterkidneytransplantindifferentregistries
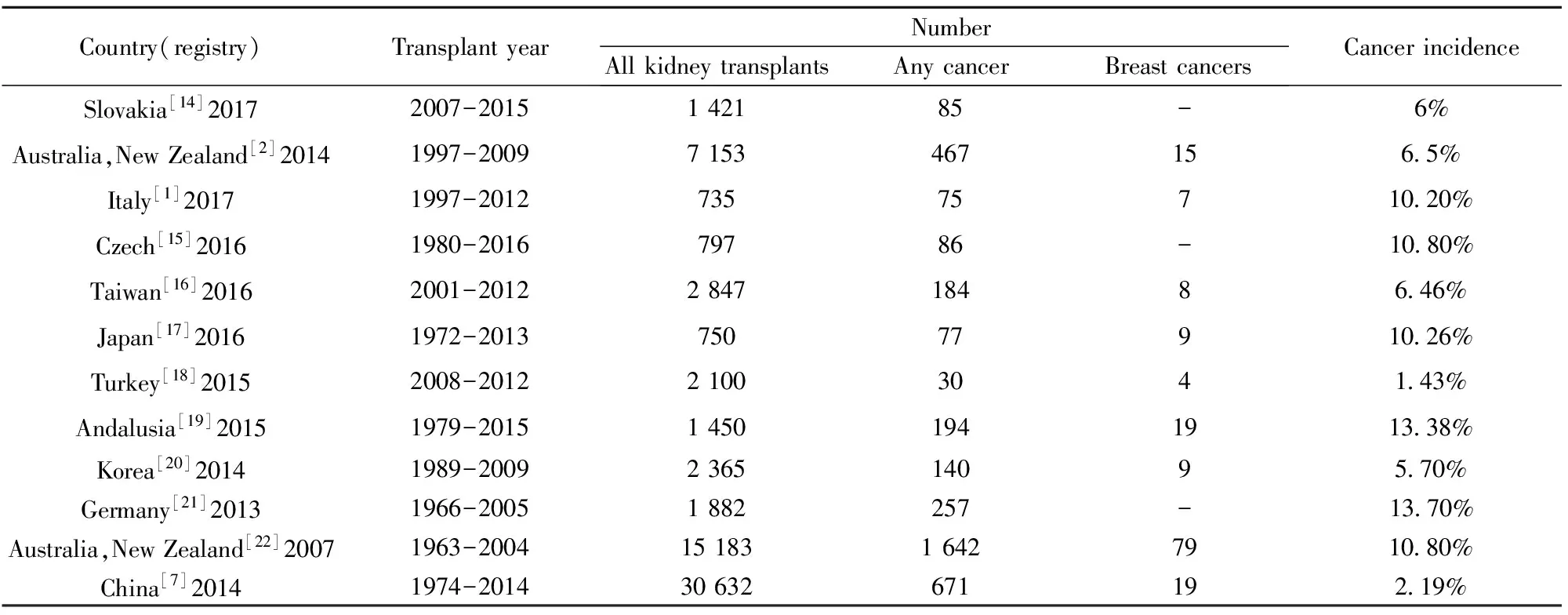
Country(registry)TransplantyearNumberAllkidneytransplantsAnycancerBreastcancersCancerincidenceSlovakia[14]20172007-2015142185-6%Australia,NewZealand[2]20141997-20097153467156 5%Italy[1]20171997-201273575710 20%Czech[15]20161980-201679786-10 80%Taiwan[16]20162001-2012284718486 46%Japan[17]20161972-201375077910 26%Turkey[18]20152008-201221003041 43%Andalusia[19]20151979-201514501941913 38%Korea[20]20141989-2009236514095 70%Germany[21]20131966-20051882257-13 70%Australia,NewZealand[22]20071963-20041518316427910 80%China[7]20141974-201430632671192 19%
2.2吗替麦考酚酯(Mycophenolate,MMF) MMF是干扰核酸生物合成的免疫制剂,同样应用于肾移植术后抗排斥反应中。Jiyad等[31]研究发现MMF有致癌作用,与其他免疫抑制剂比较,MMF对肿瘤的发生影响较小,卡波西肉瘤除外。也有研究认为MMF与肾移植术后淋巴组织增生性疾病(PTLD)发展的风险独立相关,其发生可能与移植术后的EB病毒的感染相关[32]。Robson等[33]研究者分析比较了来自两个器官移植中心13 502例平均分为接受MMF治疗(250例恶性肿瘤)和未接受MMF治疗(322例恶性肿瘤)的两组肾移植患者,发现MMF并未增加淋巴瘤或其他恶性肿瘤的发生率,甚至可能降低恶性肿瘤的发生率[33]。
2.3雷帕霉素抑制剂 (mammalian target of rapamycin inhibitor,m-TOR) 雷帕霉素抑制剂(如西罗莫司、依维莫司)是一种哺乳动物雷帕霉素靶蛋白抑制剂,通过阻断T淋巴细胞增殖发挥强有力的免疫抑制作用。雷帕霉素抑制剂在抗肿瘤方面,作用于PI3K-AKt-mTOR信号通路,抑制m-TOR的过度表达从而发挥其生物活性,调节重要的细胞代谢过程如控制细胞周期、细胞凋亡、翻译、转录,有良好的抗肿瘤作用[34]。m-TOR抑制剂可作为有效的抗血管生存剂,通过抑制m-TOR降低VEGF表达,显著抑制血管内皮细胞生长,从而达到抗肿瘤血管生成的作用[35]。Piselli等[36]统计分析了意大利1997年至2007年间7 217例肾移植患者,发现使用 m-TOR抑制剂的肾移植患者比未使用的肾移植患者肿瘤发生率降低46%。
PI3K-AKt-mTOR信号通路,可存在于多种癌和其他疾病中,其通路中某个信号失调可激活m-TOR导致细胞生长不受控制。研究发现m-TOR通路的紊乱与乳腺癌的发生发展有关,抑制m-TOR能够靶向治疗乳腺癌。Bachelot 等[37]对绝经后雌激素受体阳性、HER-2受体阴性的乳腺癌患者进行Ⅲ期临床研究,试验组54例患者采用他莫昔芬联合依维莫司治疗,对照组57例患者仅采用他莫昔芬治疗,结果显示依维莫司联合他莫昔芬治疗可提高患者的总体临床治愈率、PFS及OS。雷帕霉素靶点抑制剂作为新型免疫抑制剂,已应用于肾脏等器官移植中,作为抗肿瘤药物,在治疗乳腺癌的研究进展中同样发挥很大的应用价值。
3 肾移植术后乳腺癌死亡风险及预后
Ojo等分析美国肾移植患者的资料,1988年至1997年间死亡的肾移植患者中,36.1%死于心血管疾病,17.6%死于感染,9.2%死于肿瘤,随着时间延长恶性肿瘤相关的死亡率则逐渐上升[38]。乳腺癌是全球女性常见实体肿瘤,亦是导致女性死亡的重要原因。实体器官移植患者乳腺癌的绝对风险和相对风险与一般人群相似,提示免疫抑制剂不一定会增加移植术后乳腺癌发生的风险[22]。然而,一旦发生癌症,其预后往往较差[39]。Buell等[10]对114例肾移植术后乳腺癌患者进行长期随访,结果显示:存活率:1年92%,3年74%,5年66%。5年生存率:Ⅰ期92%、Ⅱ期42%、Ⅲ期28%、Ⅳ期16%,研究者发现3期、4期乳腺癌比一般群体有更高的死亡率。一项临床研究报告显示:女性肾移植患者乳腺癌的死亡风险与同年龄段的一般乳腺癌患者群体相比至少增加两倍[4]。肾移植患者较早出现晚期乳腺癌的可能性更大[39]。死亡风险增加及预后差等原因尚不清楚,很可能由于免疫抑制剂的使用提高癌症的生物学侵袭性所致。
目前器官移植患者乳腺癌的筛查手段与一般群体相同。Kato等[17]随访了750例肾移植术后恶性肿瘤患者发现采取适当的肿瘤学的常规筛查是发现肿瘤早期阶段的重要措施,同时采取及时的治疗手段可降低患者死亡率,可见早期诊断、早期治疗是改善预后的重要措施。
4 肾移植术后乳腺癌的处理
国内研究者主张肾移植术后实体瘤应首选手术治疗,辅以化疗或放疗[40]。KDIGO临床实践指南建议对于移植术后恶性肿瘤的治疗可给予撤减免疫抑制剂处理[41]。免疫抑制剂在移植后恶性肿瘤的治疗,应当在防止发生排斥反应的基础上积极减少免疫抑制剂的剂量,国内一般经验是减至原剂量的1/4~1/2[42]。部分研究者认为撤减免疫抑制剂可引起机体免疫力恢复,有助于机体杀灭肿瘤细胞,而且可引起对供体来源肿瘤细胞的排斥反应,从而杀灭肿瘤细胞;减量使用免疫抑制剂的治疗效果和化疗的效果无明显差异[43]。有研究显示正常剂量CsA对于低剂量CsA具有较高的致癌风险[44]。所以,适当减少环孢素的剂量可能降低移植后恶性肿瘤的发生风险。研究发现MMF在治疗组织侵袭性巨细胞感染(CMV)的肿瘤可能性大,且MMF可阻止黏附受体依赖性肿瘤的进展[45,46]。雷帕霉素抑制剂通过抑制m-TOR的过度表达有良好的抗肿瘤作用,也可通过降低VEGF表达达到抗肿瘤血管生成的作用[34,35]。Piselli等[36]认为新型免疫抑制剂m-TOR抑制剂具有良好的抗肿瘤作用,可降低肾移植术后实体肿瘤的危险性。Alberu等[47]进行一项随机多中心研究,将830名患者随机分配为更换西罗莫司(n=555)或继续CNI(n=275),2年后发现更换西罗莫司组患者恶性肿瘤总数显著低于CNI组(2.1比6.0,P<0.001)。ZEUS研究比较了环孢素和依维莫司为基础的治疗,发现使用环孢素组患者比依维莫司(1.6%)组恶性肿瘤发病率高(6.4%)[48]。因此,部分学者认为将免疫抑制剂更换为m-TOR免疫抑制剂可能降低肾移植术后患者恶性肿瘤的发生率。
仅有少数临床研究报道PTBC的治疗策略,目前肾移植术后乳腺癌患者的治疗尚无统一的标准。Kwak等[12]研究者认为对于PTBC,其治疗需要乳腺外科、器官移植中心、肾脏病科等多个学科共同参与。从表2中可见,肾移植术后乳腺癌的治疗措施仍然是以外科手术为主,同时辅以化疗、放疗、内分泌治疗等的综合治疗。对于PTBC的化疗,化疗前需考虑移植肾的功能,化疗药物可能影响移植肾的功能。Luftner等[50]研究者认为化疗药物选择中,没有肾毒性使得紫杉类药物成为肾功能不全患者的重要治疗药物。Gori等[51]研究者认为对于接受血液透析的慢性肾功能衰竭的乳腺癌患者,表柔比星可能是一种安全的辅助化疗药物的选择。有文献报道对于曾存在肾功能障碍的患者,抗HER-2的分子靶向治疗通常不具有肾毒性,并且不会干扰免疫抑制剂的代谢或清除[52]。几乎很少有文献报道关于肾移植术后乳腺癌的内分泌及放疗的治疗。
Self等[49]分析了PTBC患者14例,其中2例患者术后减少免疫抑制剂用量且未行化疗,术后随访未发现肿瘤复发。然而,有学者总结分析了16 156例肾移植患者,随机分为撤停、减量或更换m-TOR抑制剂组,发现撤停组和减量组增加了急性排斥反应发生率,撤停、减量免疫抑制剂对恶性肿瘤的发生无影响,m-TOR抑制剂使用虽然降低了感染率的发生,但也增加了急性排斥反应发生率[53]。Budde等[54]进行的一项多中心随机对照试验,实验组154例患者于移植术后使用依维莫司,对照组146例患者使用环孢素,实验发现依维莫司比环孢素更有效改善患者的肾小球滤过率,证实依维莫司有改善肾功能的作用,但移植后急性排斥反应的发生率高(10%比3%)。由此可见,撤停、减少或转换免疫抑制方案可能增加机体对移植肾的急性排斥反应。Buell等[10]认为大量免疫抑制剂的使用可能没有增加乳腺癌的发生率。部分研究者认为免疫抑制剂的使用对于乳腺癌的发生并没有影响,改变免疫抑制的剂量对于肾移植术后的乳腺癌可能不是必要的,而且对于肾移植术后实体瘤减少免疫抑制剂的治疗方案并没有对照试验[12,49]。截止目前,减少或撤停免疫抑制剂对于移植术后乳腺癌的治疗效果仍然是未知,且撤停、减少或转换免疫抑制的治疗方案可能增加机体对移植肾的急性排斥反应。如果撤停免疫抑制剂必须不断监测移植物的功能,尤其术后早期,否则一旦爆发排斥反应,易造成移植物的丧失。
表2肾移植术后乳腺癌患者的治疗
Tab.2Managementofbreastcancerinkidneytransplantrecipients
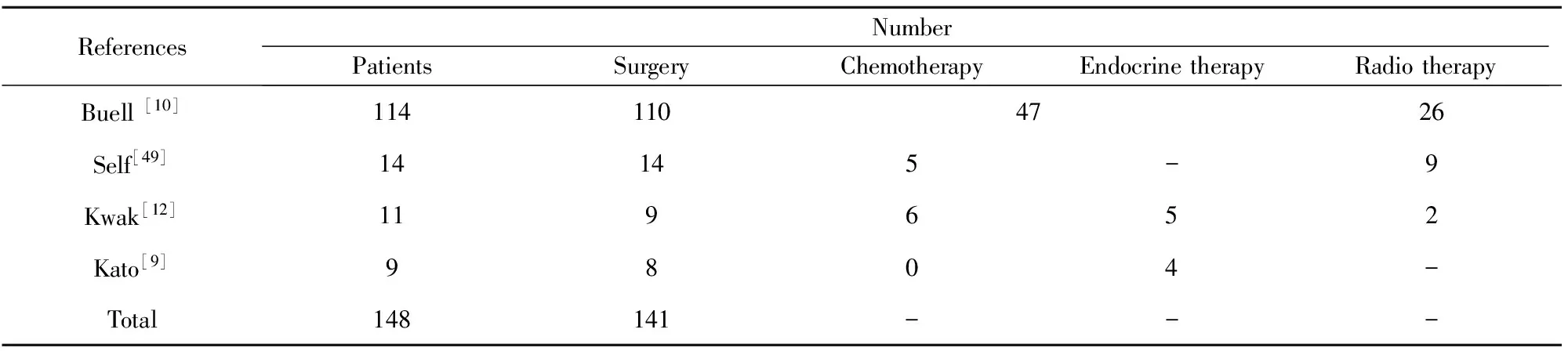
ReferencesNumberPatientsSurgeryChemotherapyEndocrinetherapyRadiotherapyBuell[10]114110 4726Self[49]14145-9Kwak[12]119652Kato[9]9804-Total148141---
综上所述,肾移植术后恶性肿瘤的发病率高于一般群体,关于PTBC的发病率是否升高仍存在争议。定期进行肿瘤筛查、早期诊断、早期治疗是改善预后的重要措施。由于针对PTBC的临床研究较少,其治疗方案尚未形成共识,亟需积累针对性的大规模临床观察和研究。PTBC的治疗需同时考虑到乳腺癌和移植肾功能,目前外科手术是主要治疗手段,根据个体化治疗辅以化疗、放疗、内分泌治疗等的综合治疗。免疫抑制剂在肾移植术后恶性肿瘤应用可根据个体化治疗适当减少免疫抑制的剂量同时兼顾预防排斥反应的发生,免疫抑制剂在PTBC中的应用结论不一,有待进一步研究。PTBC的治疗是多学科的,应有乳腺外科、器官移植中心、肾脏病科等多学科合作诊断,制定出个体化治疗方案,将可能有效提高患者的治疗效果。
