TLR4对氧化低密度脂蛋白作用巨噬细胞后凋亡和炎症因子的影响①
2018-08-01石中全李国利胡艳玲马丽华
石中全 李国利 胡艳玲 马丽华
(重庆三峡医药高等专科学校基础医学部,重庆 404120)
动脉粥样硬化是一种慢性疾病,能够诱导高血压、冠心病等心血管疾病的发生,是动脉硬化的一种类型,血管壁变厚、管腔减小等是其共同特点[1,2]。有研究显示,动脉粥样硬化的发生与巨噬细胞转变为泡沫细胞有关,机体的炎症反应导致内皮细胞对白细胞的黏附性增加,在此过程中释放的趋化因子促使单核细胞转变为巨噬细胞,吞噬氧化低密度脂蛋白形成泡沫细胞[3,4]。Toll样受体(Toll like receptors,TLRs)存在于免疫细胞表面,能够与病原体及其产物相互识别,进而激活巨噬细胞,诱导巨噬细胞分泌炎症抑制,发挥免疫作用[5]。有研究显示,Toll样受体4(Toll-like receptor-4,TLR4)参与动脉粥样硬化过程,在小鼠动脉粥样硬化组织中表达上调,能够诱导巨噬细胞凋亡[6]。本研究以小鼠巨噬细胞Ana-1为研究对象,用ox-LDL处理,体外构建泡沫细胞模型,并用TLR4特异性阻断剂抑制巨噬细胞中TLR4水平,探讨TLR4对巨噬细胞凋亡、炎症因子等影响,以期为研究动脉粥样硬化发生机制奠定基础。
1 材料与方法
1.1材料 小鼠巨噬细胞Ana-1购自中国科学院细胞库;RPMI1640培养基、胰蛋白酶、氧化低密度脂蛋白(oxidized LDL,ox-LDL)均购自美国Sigma;二喹啉甲酸(Bicinchoninic acid,BCA)蛋白浓度检测试剂盒购自上海酶联生物;细胞RNA提取试剂盒购自美国Sigma;细胞蛋白提取试剂盒购自武汉艾美捷;甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、TLR4引物由上海生工合成;TLR4单克隆抗体购自美国Abcam;活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved cysteinyl aspartate specific proteinase 3,Cleaved Caspase-3)单克隆抗体、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)单克隆抗体、GAPDH单克隆抗体均购自美国CTS;核因子-κBp65(Nuclear factor-κBp65,NF-κBp65)单克隆抗体购自武汉博士德;TNF-α水平检测试剂盒、IL-6水平检测试剂盒、IL-1β水平检测试剂盒均购自美国eBioscience;TLR4阻断剂TAK-242购自美国APExBio。
1.2方法
1.2.1细胞培养及分组 Ana-1细胞用含有50 ml胎牛血清和450 ml的RPMI1640培养,Ana-1细胞中加入5 ml的细胞培养液,700 g离心10 min后,把上清液吸除后,放在37℃,5%CO2培养箱中培养。Ana-1细胞分为Con、ox-LDL、TAK-242,其中ox-LDL细胞用含有50 pg/ml的ox-LDL培养。TAK-242细胞用含有50 pg/ml ox-LDL和20 μmol/L的TLR4阻断剂TAK-242培养。Con细胞用正常细胞培养液培养。
1.2.2qRT-PCR检测细胞中TLR4水平 Con、ox-LDL细胞培养24 h后,按照RNA提取试剂盒提取细胞中的RNA,用EDPC水溶解以后,用紫外分光光度计检测所提取的RNA纯度及浓度。反转录合成cDNA,qRT-PCR检测细胞中TLR4水平。内参基因为GAPDH,2-ΔΔCt法计算TLR4 mRNA水平。程序为:95℃,15 s;60℃,60 s;72℃,30 s;共40个循环。TLR4上游引物为5′-TGGATACGTTTCCTTATAAG-3′,下游引物5′-GAAATGGAGGCACCCCTTC-3′。GAPDH上游引物为5′-TGATGACATCAAGAAGGTGGTGAAG-3′,下游引物5′-TCCTTGGAGGCCATGTGGGCCAT-3′。取内参和目的基因的Ct值的均值,ΔCt=Ct目的-Ct内参,ΔΔCt=(实验组目的基因Ct值-实验组内参基因Ct值)-(对照组目的基因Ct值-对照组内参基因Ct值)。实验重复3次,取均值。
1.2.3Western blot检测细胞中TLR4水平 Con、ox-LDL、TAK-242细胞培养24 h后,收集细胞,用磷酸盐缓冲液(Phosphate buffered saline,PBS)将细胞洗涤3次,加入裂解液再放在冰上孵育反应30 min。4℃,12 000 g离心10 min,将蛋白上清液吸取至EP管中,保存-80℃。吸取5 μl蛋白样品,用BCA法对蛋白进行定量检测。蛋白变性:蛋白样品与5×Loading buffer按照体积比为4∶1的比例混匀后,在沸水中孵育5 min。蛋白电泳:每孔40 μg样品,10%分离胶,5%浓缩胶电泳,80 V电压电泳 30 min,120 V电压观察marker进入底部后,停止电泳。封闭:5%牛血清白蛋白,37℃孵育1.5 h。一抗结合:1∶ 800比例稀释,4℃过夜。二抗孵育:1∶2 000比例稀释,37℃孵育1.5 h。DAB显色。以GAPDH为内参,分析蛋白水平。实验重复3次,取均值。
1.2.4流式细胞术检测细胞凋亡 Con、ox-LDL、TAK-242细胞培养24 h,离心后,收集约1×106个细胞,用195 μl的结合缓冲液悬浮后,依次加入5 μl的碘化丙啶(Propidium iodide,PI)和5 μl膜联蛋白 V-FITC(Annexin V-FITC),在室温、避光环境下孵育10 min,再加入结合缓冲液190 μl,室温条件孵育10 min,在60 min内用流式细胞仪检测细胞凋亡情况。实验重复3次,取均值。
1.2.5ELISA检测炎症因子TNF-α、IL-6、IL-1β水平 Con、ox-LDL、TAK-242细胞培养24 h,收集细胞培养液上清,用ELISA法检测细胞培养液上清中 TNF-α、IL-6、IL-1β水平,步骤参照试剂盒说明书。实验重复3次,取均值。
1.2.6Western blot检测Bax、Cleaved Caspase-3、NF-κBp65、TLR4蛋白表达 Con、ox-LDL、TAK-242细胞培养24 h后,提取细胞总蛋白,Western blot检测细胞中Bax、Cleaved Caspase-3、NF-κBp65、TLR4水平。Bax、Cleaved Caspase-3、NF-κBp65、TLR4一抗分别以1∶800、1∶600、1∶600、1∶800 稀释。实验重复3次,取均值。
1.2.7DCFH-DA法检测ROS水平 Con、ox-LDL、TAK-242细胞培养24 h,按照ROS水平检测试剂盒检测细胞内的ROS水平(DCFH-DA法),用ox-LDL和TAK-242细胞的荧光强度除以 Con表示ROS水平,实验重复3次,取均值。
2 结果
2.1ox-LDL作用后巨噬细胞中TLR4表达水平升高 结果如图1所示,ox-LDL细胞中TLR4 mRNA和蛋白水平均明显高于Con,差异具有统计学意义(P<0.05)。ox-LDL作用后巨噬细胞中TLR4表达水平增加。
2.2阻断TLR4减弱ox-LDL诱导的巨噬细胞凋亡 结果如图2所示,ox-LDL和TAK-242细胞凋亡率明显高于Con,差异具有统计学意义(P<0.05)。TAK-242细胞凋亡率明显低于ox-LDL,差异具有统计学意义(P<0.05)。ox-LDL诱导巨噬细胞凋亡,而阻断TLR4能够降低ox-LDL诱导的巨噬细胞凋亡。
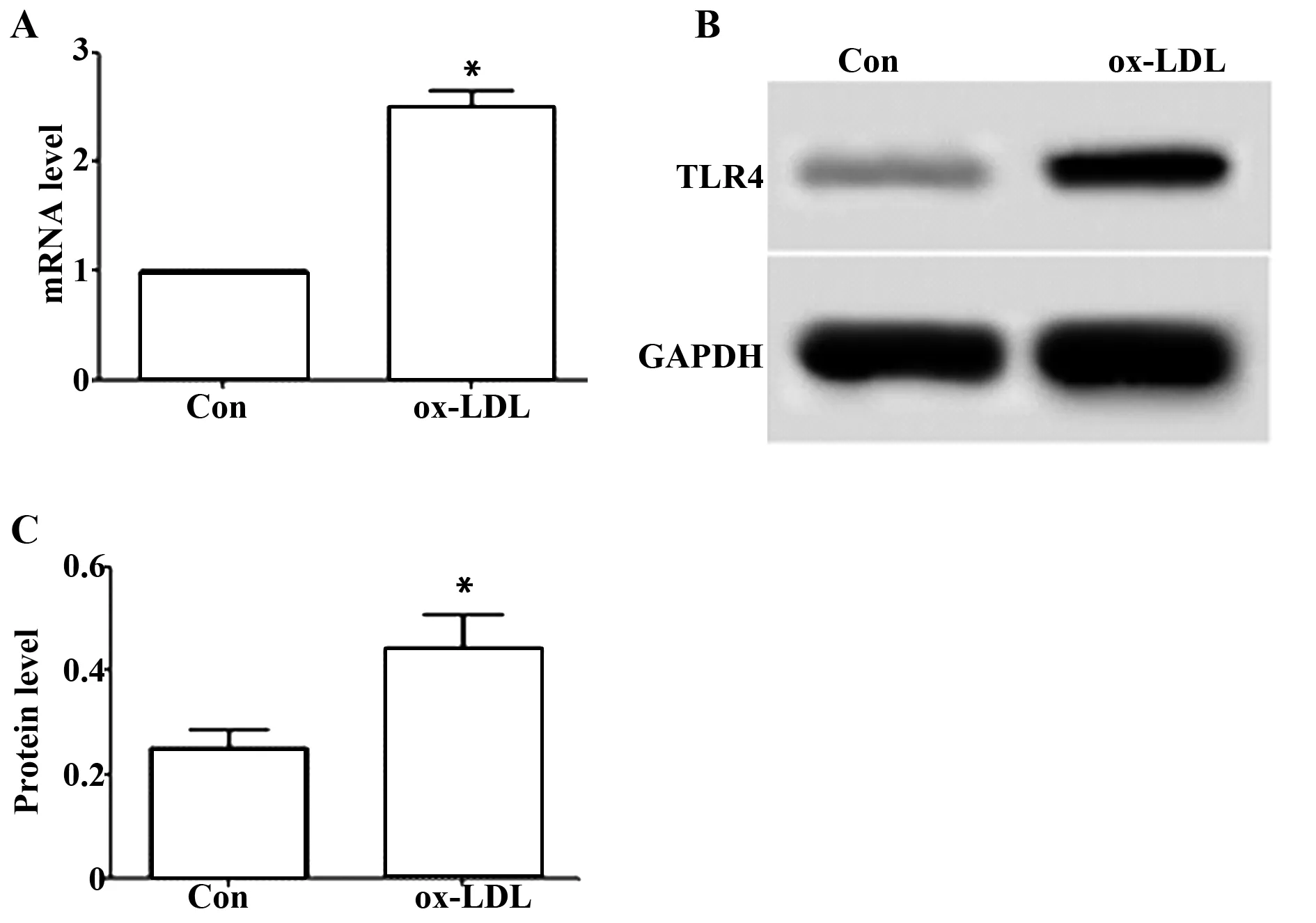
图1 ox-LDL作用后巨噬细胞中TLR4 mRNA的蛋白水平Fig.1 Protein levels of TLR4 mRNA in macrophages after ox-LDL treatmentNote:A.TLR4 mRNA level;B.Detection of TLR4 protein expression in cells by Western blot;C.TLR4 protein level.Compared with Con,t1=18.558,t2=4.082,*.P<0.05.
2.3阻断TLR4降低ox-LDL诱导的巨噬细胞分泌TNF-α、IL-6、IL-1β 结果如图3所示,ox-LDL和TAK-242细胞分泌的TNF-α、IL-6、IL-1β水平明显高于Con,差异具有统计学意义(P<0.05)。TAK-242细胞分泌的TNF-α、IL-6、IL-1β水平明显低于ox-LDL,差异具有统计学意义(P<0.05)。ox-LDL诱导巨噬细胞分泌炎症因子,而阻断TLR4能够降低ox-LDL诱导的巨噬细胞分泌炎症因子。
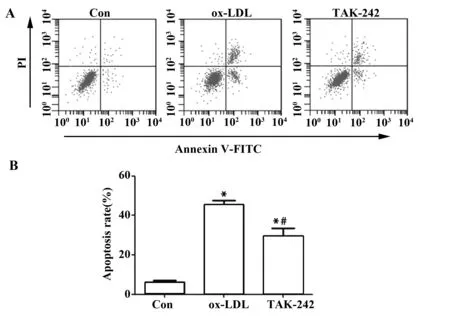
图2 阻断TLR4对ox-LDL诱导的巨噬细胞凋亡影响Fig.2 Effect of blocking TLR4 on ox-LDL induced apoptosis in macrophagesNote:A.Flow cytometry was used to detect apoptosis;B.Apoptosis rate.Compared with Con,t1=16.277,t2=9.738,*.P<0.05;compared with ox-LDL,t=6.539,#.P<0.05.
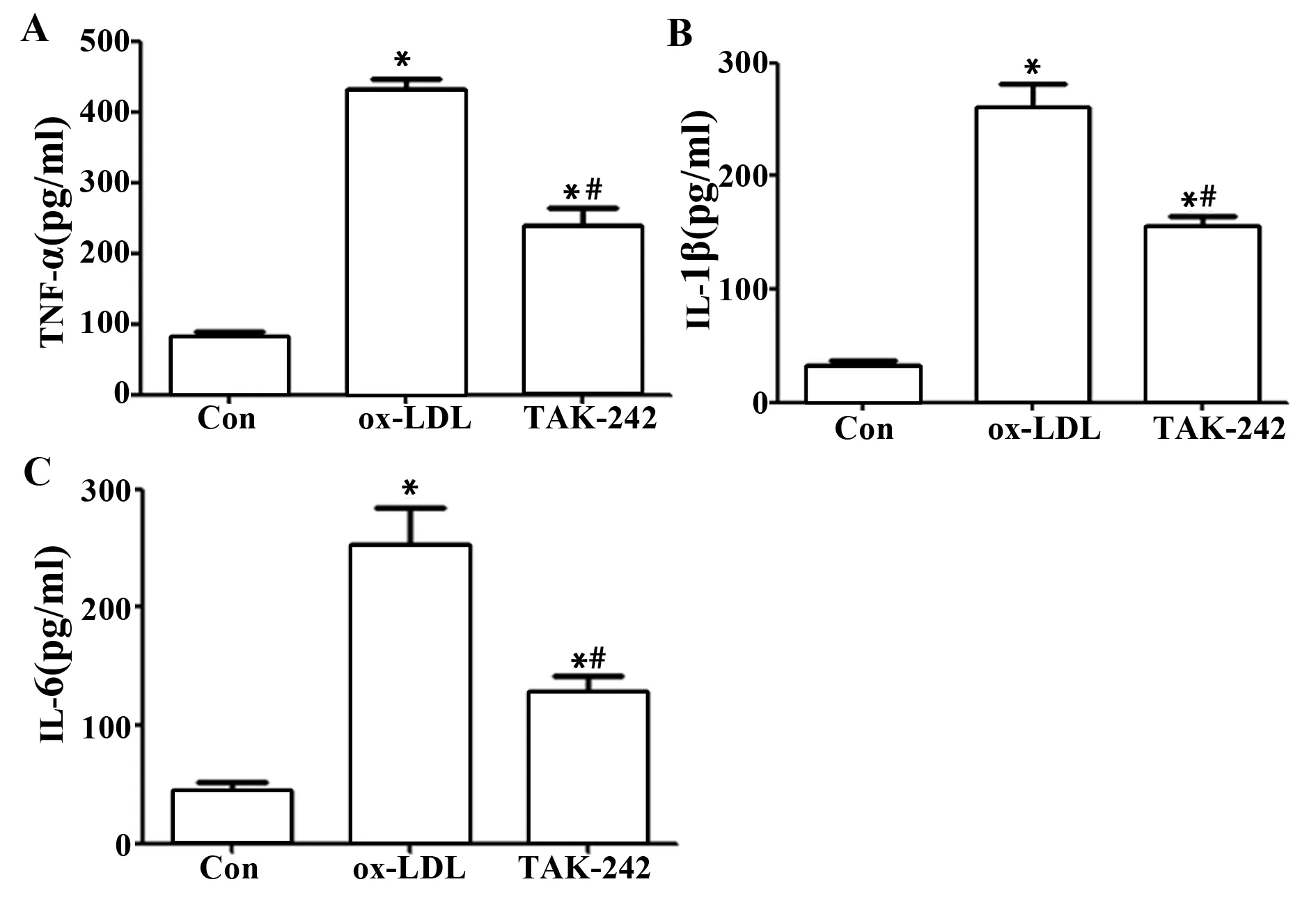
图3 阻断TLR4对ox-LDL诱导的巨噬细胞分泌的TNF-α、IL-6、IL-1β影响Fig.3 Effect of blocking TLR4 on TNF-α,IL-6 and IL-1β secreted by macrophages induced by ox-LDLNote:A.TNF-α content;B.IL-1β content;C.IL-6 content.Compared with Con,t1=24.493,t2=11.113,t3=18.817,t4=10.162,t5=13.847,t6=4.931,*.P<0.05;compared with ox-LDL,t1=13.380,t2=8.656,t3=8.917,#.P<0.05.
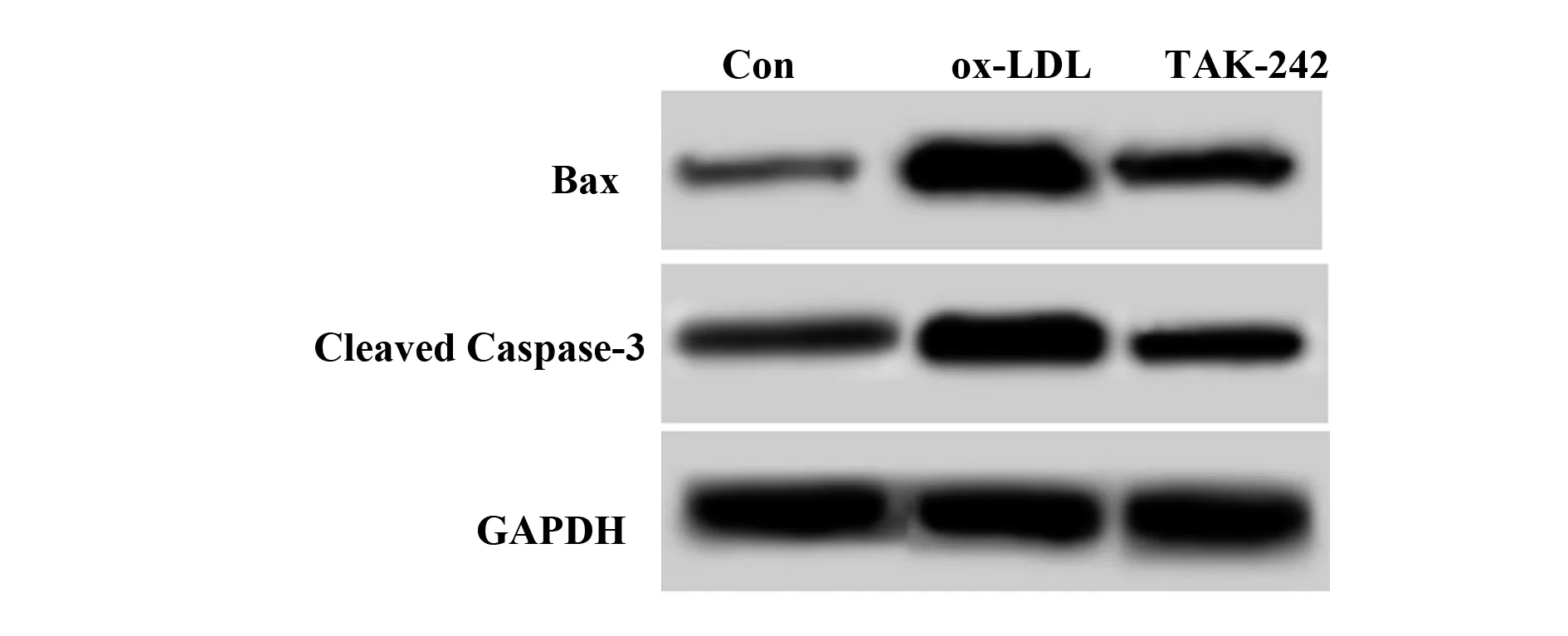
图4 Western blot检测Bax、Cleaved Caspase-3水平Fig.4 Bax,Cleaved Caspase-3 levels detected by Western blot
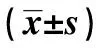
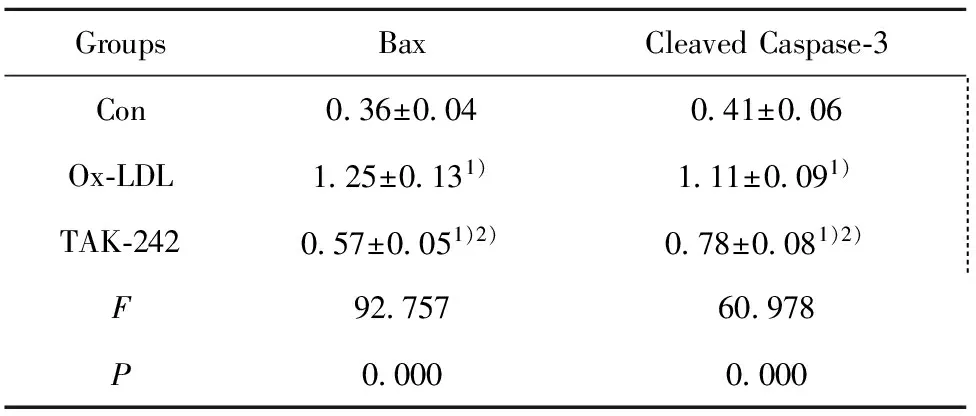
GroupsBaxCleavedCaspase⁃3Con0 36±0 040 41±0 06 Ox⁃LDL1 25±0 131)1 11±0 091) TAK⁃2420 57±0 051)2)0 78±0 081)2) F92 75760 978P0 0000 000
Note:Compared with Con,t1=13.028,t2=3.074,t3=11.037,t4=5.834,1)P<0.05;compared with ox-LDL,t1=9.954,t2=5.203,2)P<0.05.
2.4阻断TLR4对ox-LDL作用后巨噬细胞中Bax、Cleaved Caspase-3蛋白表达影响 结果如图4和表1所示,ox-LDL和TAK-242细胞Bax、Cleaved Caspase-3水平明显高于Con,差异具有统计学意义(P<0.05)。TAK-242细胞Bax、Cleaved Caspase-3水平明显低于ox-LDL,差异具有统计学意义(P<0.05)。ox-LDL诱导巨噬细胞中Bax、Cleaved Caspase-3表达,而阻断TLR4能够降低巨噬细胞中Bax、Cleaved Caspase-3水平。
2.5阻断TLR4降低ox-LDL作用后巨噬细胞中ROS水平 结果图5所示,ox-LDL和TAK-242细胞ROS水平明显高于Con,差异具有统计学意义(P<0.05)。TAK-242细胞ROS水平明显低于ox-LDL,差异具有统计学意义(P<0.05)。ox-LDL诱导巨噬细胞中ROS水平升高,而阻断TLR4能够降低巨噬细胞ROS水平。
2.6阻断TLR4降低ox-LDL后巨噬细胞中NF-κBp65、TLR4水平 结果如图6和表2所示,ox-LDL和TAK-242细胞NF-κBp65、TLR4水平明显高于Con,差异具有统计学意义(P<0.05)。TAK-242细胞NF-κBp65、TLR4水平明显低于ox-LDL,差异具有统计学意义(P<0.05)。ox-LDL诱导巨噬细胞中NF-κBp65表达,而阻断TLR4能够降低巨噬细胞中NF-κBp65水平。
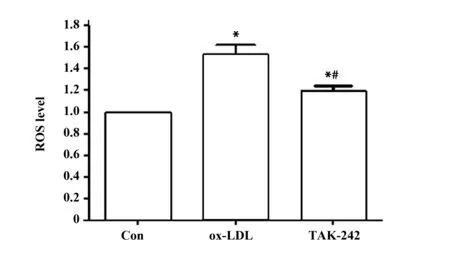
图5 细胞中ROS水平Fig.5 Level of ROS in cellsNote:Compared with Con,t1=10.394,t2=3.922,*.P<0.05;compared with ox-LDL,t=6.472,#.P<0.05.
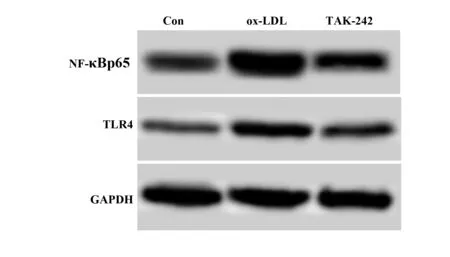
图6 Western blot检测细胞中NF-κBp65、TLR4表达水平Fig.6 Expression levels of NF-κBp65 and TLR4 in cells were detected by Western blot
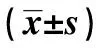
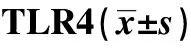

GroupsTLR4NF⁃κBp65 Con0 21±0 020 14±0 02 Ox⁃LDL0 64±0 071)1 54±0 061) TAK⁃2420 35±0 031)2)0 82±0 061)2) F 69 823 580 421P 0 000 0 000
Note:Compared with Con,t1=11.585,t2=3.772,t3=34.067,t4=16.547,1)P<0.05;compared with ox-LDL,t1=7.813,t2=17.520,2)P<0.05.
3 讨论
TLRs为跨膜蛋白,其胞内区可与白细胞介素受体的TIR结构域结合,而胞外域由多个重复的富含亮氨酸的序列组成,在免疫炎症反应中具有重要作用[7-10]。动脉粥样硬化以慢性炎症为主要病理变化,免疫细胞积聚于动脉壁为特征[11,12]。研究显示,内皮细胞、纤维原细胞、巨噬细胞等均能够表达TLRs,能够调控动脉粥样硬化发生过程[13-15]。很多报道显示,TLR4与动脉粥样硬化有关。Edfeldt等[16]研究显示,TLR4在动脉粥样硬化斑块中的表达水平明显上调,并且是通过TLR4的识别作用使动脉粥样硬化相关因子大量释放。还有研究显示,用TLR4激活剂可以诱导动脉粥样硬化斑块的形成,诱导血管重构[17]。本研究用ox-LDL处理巨噬细胞后发现,细胞中的TLR4基因转录水平升高,细胞中TLR4蛋白水平也升高,这提示,TLR4参与动脉粥样硬化发生,与上述实验报道相符合。
在动脉粥样硬化发生过程中,巨噬细胞摄取了ox-LDL携带的胆固醇,能够沉积在动脉血管上,导致脂肪条纹的形成,而活化的巨噬细胞释放的炎症因子TNF-α、IL-6、IL-1β和ROS等,增加炎症反应,介导脂蛋白的氧化,又会进一步加快动脉粥样硬化发生,此外ROS也是心血管系统中重要的致病因子[18-20]。本研究显示,ox-LDL处理后的巨噬细胞培养液上清中TNF-α、IL-6、IL-1β水平升高,细胞中ROS水平也升高,说明ox-LDL诱导巨噬细胞分泌TNF-α、IL-6、IL-1β,促进细胞中ROS表达,而用TLR4阻断剂降低巨噬细胞分泌的TNF-α、IL-6、IL-1β,降低细胞中ROS水平,阻断TLR4抑制ox-LDL作用后的巨噬细胞分泌炎症因子,降低细胞中ROS水平。
在动脉粥样硬化斑块组织中,巨噬细胞大量凋亡,而巨噬细胞凋亡增多后又会进一步引起动脉粥样硬化斑块组织不稳定[21-23]。细胞凋亡的发生受到多种基因的严格调控,是一个复杂过程,其中Caspase蛋白家族和Bcl-2蛋白家族与细胞凋亡有关[24-26]。Caspase-3属于Caspase家族成员之一,其活化后形成Cleaved Caspase-3促进细胞凋亡的发生[27,28]。Bax是Bcl-2蛋白家族中的一员,是一种促凋亡蛋白[29]。本研究结果显示,ox-LDL诱导巨噬细胞凋亡,促进细胞中Caspase-3活化,诱导细胞中Bax表达,而阻断TLR4可以减弱ox-LDL诱导的巨噬细胞凋亡。说明阻断TLR4不仅可以减少巨噬细胞炎症因子释放,还可以抑制巨噬细胞凋亡。
NF-κB在多种组织和器官中均有表达,能够调控基因的转录,是一种核转录因子[30,31]。研究显示,NF-κB参与动脉粥样硬化过程,在单核细胞、平滑肌细胞、内皮细胞中表达,正常情况下,NF-κB可以与IκB结合以二聚体的形式存在,在受到缺氧、细胞因子等的刺激后,IκB磷酸化后被降解,NF-κB活化从细胞浆内进入到核内,与基因操纵子结合,诱导基因的转录[32-35]。NF-κB对细胞中促炎因子、趋化因子等的表达具有关键调控作用,与动脉粥样硬化的炎症有关,其激活后促进动脉粥样硬化发生,NF-κBp65是NF-κB激活后存在的主要方式[36-40]。本研究结果显示,ox-LDL作用后,巨噬细胞中NF-κBp65水平升高,而阻断TLR4后可以抑制ox-LDL的这一作用。
综上,TLR4参与动脉粥样硬化发生过程,在ox-LDL作用后的巨噬细胞中表达上调。阻断TLR4后,可以降低ox-LDL作用后的巨噬细胞凋亡,抑制细胞分泌炎症因子,减弱细胞中ROS水平,降低细胞中NF-κBp65水平,TLR4在动脉粥样硬化泡沫细胞中具有重要作用,对于研究动脉粥样硬化的发生具有重要意义,其作用机制仍然需要在动物实验及多种巨噬细胞中进行验证。