抗苗勒管激素与性激素、精液质量关系研究
2018-07-30白双勇章晓梅黄琴莉曹良杰彭小薇李丽娟
白双勇 王 莉 章晓梅 孙 云 黄琴莉 曹良杰 彭小薇 李丽娟
昆明市第一人民医院甘美国际医院生殖遗传中心(云南昆明 650224)
根据夫妻有规律性生活未避孕未育1年者[1]定义为不育症,目前全球范围内大约有10%~20%夫妇为不育症,其中男性因素为50%。由于现代生活方式的改变及工作压力增加导致男性不育症发生率明显上升。在睾丸组织中少精子症、弱精子症、畸形精子症是男性不育的主要原因[2]。影响精子生成的众多因素包括遗传、内分泌、代谢、生活方式以及环境等。睾丸内精子生成的微环境对于精子生成影响最为明显,支持细胞在精子发生、发育等阶段起了重要作用。抗苗勒管激素(anti-mullerian hormone,AMH)由支持细胞合成以旁分泌发生作用于生精细胞,对生精细胞的分化及成熟有着重要作用[3]。相比较AMH在女性评估卵巢储备功能的广泛引用,AMH在男性生育的作用报道较少。本次研究,评估AMH与精液质量的关系,以及AMH与其他性激素的关系,为临床诊断男性不育提供新的参考依据。
资料与方法
一、研究对象
本研究在昆明市第一医院伦理委员会同意下进行,每个参与的患者都被告知相应的权利。研究对象为2016年12月至2017年8月在昆明市第一医院生殖中心就诊的男性不育症患者中随机抽取。男性不育症患者的标准为:有规律性生活未避孕一年而未使妻子受孕的男性。
1. 纳入标准:(1)年龄22岁至50岁的男性不育症患者,有规律的性生活;(2)可以手淫取精者,男性性功能正常;(3)能遵守实验室取样标准。
2. 排除标准:(1)有染色体异常者;(2)不能自主取精者;(3)精神因素异常紧张者;(4)接触有明显的影响生育力的毒物者,如农药厂工人,电焊、油漆等工作人群;(5)患有影响生育的疾病(如尿道下裂、严重的精索精索静脉曲张、隐睾症、肿瘤、男性绝育术和睾丸扭转);(6)患者严重附属性腺炎症。
二、方法
1. 精液分析:所有参与课题男性不育症患者禁欲2~7d后,通过手淫办法获取精液,严格按照世界卫生组织2010年第五版人类精液检验与处理实验室手册要求,由昆明市第一医院生殖遗传中心男科实验室工作人员按操作规程精液常规分析。每一份精液由两个实验人员独立完成检测。患者第一次检测结果异常者,间隔1周,再次行第二次精液检查。无精子症患者经3次精液检查,离心后未见精子者。经皮附睾穿刺后发现精子者为梗阻性无精子症,不参加本次研究。根据精液结果,将患者分为3组:(1)非梗阻性无精子症(non-obstructive azoospermia,NOA)组40人;(2)少弱精子症组65人;(3)精子正常组191人。
2. 精子形态学分析:采用Diあ-Quik将已经空气干燥的精液涂片,浸入到三芳基甲烷固定液15s,把涂片垂直竖立在吸水纸上,以去除多余的溶液。随后将涂片浸入快速染液1和2中,封片观察。
3. 血清AMH、性激素检测:患者空腹于早晨9~11时,抽取静脉血5mL,置于聚酯凝胶/二氧化硅添加剂真空采血管。静止30min,待血清析出后,取血清350μL,上机检测,使用机型为罗氏化学发光法激素检测仪COBAS E411分析仪检测血清AMH、促卵泡生成素(FSH)、促黄体生成素(LH)、雌二醇(E2)、睾酮(T)、催乳素(PRL)。
三、统计学处理
结 果
一、各组男性不育患者精液指标、性激素和AMH比较结果
各组精液指标比较,NOA组精液量低于少、弱精子组及正常精子组,差异有统计学意义(P<0.05)。少、弱精子组精液量略高于正常精子组,差异有统计学意义(P<0.05)。少、弱精子组在精子浓度、前向运动率、总活力、精子正常形态率均低于正常精子组异有统计学意义(P<0.05)。
测定血清中FSH、LH结果比较中,NOA症组均高于少弱精子症组、正常精子组,差异有统计学意义(P<0.05)。少弱精子症组高于精子正常组,差异有统计学意义(P<0.05)。E2、T、PRL在3组中均无显著性差异(P>0.05)。在血清中AMH检测结果中,NOA组及少、弱精子症组均低于精子正常组,差异有统计学意义(P<0.05),见表1。
表1 各组精液指标、性激素和AMH比较(s)

表1 各组精液指标、性激素和AMH比较(s)
注:与NOA(非梗阻性无精子症)组比较,*为P<0.05;与少弱精子症组比较,△为P<0.05
精子正常组(n=191)年龄(岁)31.30±6.3333.20±6.4435.66±7.05*精液量(mL)1.67±0.973.02±1.41*2.76±1.33*△精子浓度(106/mL)0.00±0.005.78±5.02*80.09±59.87△前向运动率(%)0.00±0.0017.17±17.67*47.01±19.96*△总活力(%)0.00±0.0026.06±23.18*66.05±21.56*△精子形态正常率(%)0.00±0.002.18±2.53*6.14±2.57*△FSH zB(mIU•mL-1)12.62±13.369.42±6.415.35±3.11*△LH zB(mIU•mL-1)9.23±7.965.69±2.68*4.40±1.93*△E2 ρB(ng•mL-1)22.24±13.4622.48±10.4426.14±11.20 AMH ρB(ng•mL-1)7.05±6.577.82±5.109.86±5.47*△T ρB(ng•mL-1)3.69±2.144.28±1.724.43±1.66 PRL ρB(ng•mL-1)11.67±8.0213.72±7.2312.18±5.46 NOA组(n=40)少弱精子症组(n=65)
二、AMH与精液分析各项指标及性激素的相关性分析
AMH与精液量呈正相关(P<0.05),与精子浓度呈正相关(P<0.01),与精子前向运动率呈正相关(P<0.05),与精子总活力呈正相关(P<0.05)。AMH与T呈正相关(P<0.05),AMH与FSH呈负相关(P<0.01),AMH与LH呈负相关(P<0.01),AMH与E2及PRL无相关性(P>0.05),见表2。
讨 论
在胚胎发育早期,Y染色体上的STY基因诱导上皮细胞索中的体腔上皮细胞分化为支持细胞,对于精子生成、发育以及睾丸激素合成有内分泌及旁分泌的控制因素。在睾丸分化初期,胚胎7~8周时支持细胞开始分泌的AMH,以旁分泌方式弥散至苗勒氏管,引起苗勒氏管细胞凋亡和退化。AMH保持高水平直至出生,出生后逐渐降低,8~10岁消失。AMH除了在睾丸分化早期抑制苗勒氏管生长和分化的作用外,还能促进睾丸早期发育,对第一阶段睾丸下降有重要作用,以及出生前肺成熟和出生后生殖细胞成熟的作用。AMH在青春期前保持较高分泌,而进入青春期后急剧下降,成人阶段血中保持较低的水平[4, 5]。AMH常常用于青春期前儿童性发育异常及睾丸功能的评估和诊断。AMH为140KD糖蛋白二聚体,属于转化生长因子β(TGF-β)超家族。AMH是有二硫键连接的糖蛋白二聚体,相对分子质量为140 000,其编码基因位于第19号染色体的短臂上,即P13.2~P13.3,具有5个外显子[4],AMH在体内的平均半衰期为(27.6±0.8)h,体内完全清除大约需要8d[6]。
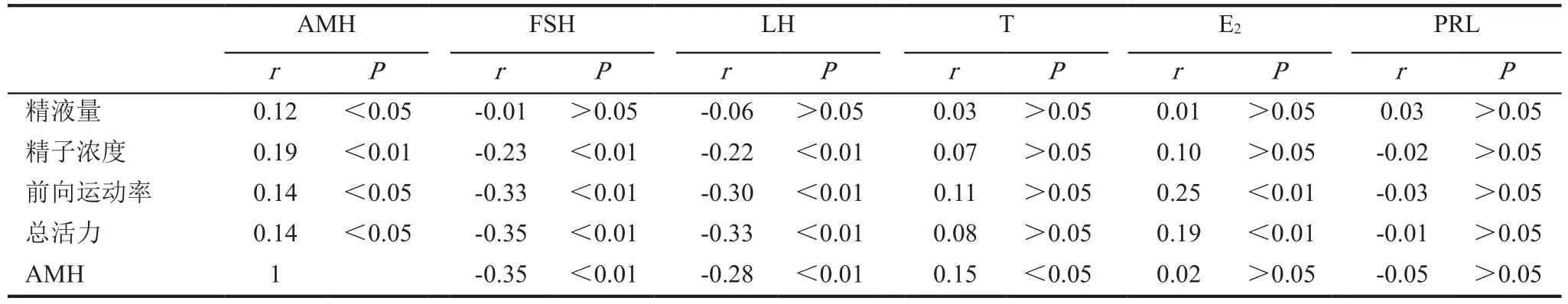
表2 AMH与精液各项指标及性激素相关性分析
精子的生成是细胞分化和成熟按照时间顺序发生的结果,精子的生成主要依赖于下丘脑-垂体-性腺轴的作用,下丘脑合成促性腺激素释放激素,垂体合成释放促卵泡生成素(follicle-stimulating hormone, FSH)和促黄体生成素(luteinizing hormone, LH),LH作用于睾丸间质细胞,促进其合成(testosterone, T)。FSH和T不是直接作用与精子发生及成熟。由于支持细胞表面具有FSH及T的受体,FSH及T与支持细胞表面受体结合后,促使支持细胞合成释放AMH至精浆中。因血睾屏障的存在,精浆中AMH远远高于血清中AMH,支持细胞表面有雄激素受体表达,而生精细胞表面没有雄激素受体表达,雄激素与支持细胞表面雄激素受体结合后,促进支持细胞合成各项激素,从而调节生精上皮细胞的发育。支持细胞与间质细胞之间的紧密连接,建立了两种细胞自助分泌及旁分泌的调节机制。支持细胞有多方面功能,在精子发生过程中发挥重要作用,供给精子发生所需的能源和营养,分泌雄激素结合蛋白、抑制素和激活素。前者使生精小管保持高浓度的雄激素支持精子发生,后两者可调节垂体远侧部合成和分泌FSH[7]。而AMH作为支持细胞分泌的重要激素,其检测值明确反映支持细胞的功能,且有调节精子生成的重要作用。AMH降低反映支持细胞数目较少或者其功能降低,则男性生精能力下降或者生精困难。
对男性NOA患者通常评估睾丸生精能力依靠FSH及睾丸体积大小,而血清中AMH是否也可以预测NOA患者中睾丸获取精子的概率呢?Goulis等[8]认为,血清中的AMH检测值对无精子症患者有预测在睾丸中获取精子的价值,但低于血FSH及睾丸大小提供的预测价值。Muttukrishna等[9]与Liu等[10]研究认为,生育力低下的男性血清AMH水平也低于正常生育男性,AMH与男性精液各项指标有明显正相关。本研究结果与之相近。本次研究发现,在NOA患者及少弱精子症患者中血清AMH值均低于正常精液组,差异有统计学意义。AMH与精液量、精子浓度、前向运动率、总活力呈正相关。Andersen等[11]研究结果显示精浆中AMH与精子浓度、精子总数、前向运动率呈正相关,而血清中AMH与精液各项指标无明显相关性。此外Nery等[12]研究认为AMH还可以作为评估弱精子症患者冷冻后复苏的精子质量指标之一。
调节支持细胞分泌AMH主要有3个因素:睾酮、FSH、精子细胞第一次减数分裂的启动。这其中睾酮最为重要,当睾酮缺乏或者由于雄激素受体突变而导致雄激素不敏感,血清中AMH则升高明显。当睾酮缺乏时,FSH刺激支持细胞合成AMH。AMH进入生精小管以及间质细胞。AMH促进精子早期成熟,AMH在男性中的作用包括:(1)帮助睾丸下降;(2)抑制支持细胞中芳香化酶的作用;(3)抑制分化的前体细胞向间质细胞转化;(4)影响间质细胞类固醇激素的合成[13]。本次研究结果显示AMH与FSH呈负相关,与LH呈负相关,与T呈正相关,当睾丸生精功能低下时,间质细胞合成睾酮水平降低,同时其支持细胞的功能也明显降低,而支持细胞功能低下则其合成雄激素结合蛋白能力降低,无法有效转运雄激素进入生精小管中,则精子生成减少。
综上所述,男性不育患者血清中AMH水平与男性基础性激素之间有着密切的相互影响关系,AMH测定与男性精液常规各项指标有明显的相关性,通过联合基础性激素结合AMH可以用于评估男性生精能力情况,这对于治疗男性不育、提高男性精液质量有明显的临床意义。此外,AMH对于精子生成及成熟的具体机制还需要进一步探索。
