高脂饮食诱导C57BL/6小鼠睾丸微血管损伤导致非感染性睾丸炎症反应*
2018-07-30张晓艳李炳蔚刘明明刘淑英盛有明李宏伟修瑞娟
张晓艳 李炳蔚 尚 飞 刘明明 刘淑英 盛有明 李宏伟 修瑞娟
中国医学科学院北京协和医学院 微循环研究所 卫生部微循环重点实验室(北京 100005)
由高脂饮食诱导的男性生精功能障碍受到广泛关注[1-5]。有文献报道,长期高脂饮食可诱导小鼠睾丸内炎症细胞因子表达增高[6],但高脂饮食对睾丸微血管的影响,以及睾丸微血管功能与高脂诱导的睾丸内炎症反应的关系,报道较少。本研究利用高脂饮食建立C57BL/6雄性肥胖小鼠模型,观察由高脂饮食诱导的小鼠睾丸微血管病理生理改变与炎症细胞在睾丸组织的浸润以及生精细胞组织结构病理变化的关系,为进一步探索高脂饮食诱导的雄性生殖功能损害机制提供依据。
材料与方法
一、仪器设备及主要试剂
罗氏血糖仪及配套血糖试纸(德国罗氏公司);激光多普勒血流灌注监测系统(Moor VMS-LDF,英国Moor公司产品);石蜡切片机(RM2245,德国Leica公司产品)。抗大鼠CD31、F4/80单克隆抗体、山羊抗小鼠肿瘤坏死因子单克隆抗体(TNFα)及TNFα和MCP-1ELISA检测试剂盒购于英国Abcam公司;TUNEL细胞原位凋亡检测试剂盒(美国Roche公司);柠檬酸缓冲液(北京康为世纪公司);高脂饲料(D12492,为国际通用高脂饲料配方)及普通繁殖饲料均购自中国医学科学院动物研究所华阜康生物科技有限公司。
二、实验动物
本研究动物实验经中国医学科学院北京协和医学院微循环研究所伦理委员会批准。SPF级7~8周雄性C57BL/6小鼠40只,质量23~25g,购自中国医学科学院动物研究所[SCXK(京)2009-0007]。经过1周适应性喂养,随机分为对照组(Control, n=20)和高脂组(High fat diet, HFD, n=20)。对照组饲料为普通繁殖饲料,高脂组为高脂饲料(D12492,其中脂肪供能60%,碳水化合物供能20%,蛋白质供能20%)。两组动物自由饮水取食,饲养于12 h明暗交替环境中,温度22~23℃,湿度40%~60%,每周监测体质量和血糖。于喂养20周末,腹腔注射1.5%戊巴比妥钠麻醉小鼠。以激光多普勒血流灌注监测系统检测睾丸血流灌注量,后留取全血样本。下腹部十字切口取两只睾丸,称量后分别于10%中性甲醛固定,置于冻存管中液氮速冻。
三、方法
(一) HE染色观察睾丸组织结构变化
睾丸固定于中性甲醛8 h后,用5号针头分别于睾丸两端刺穿白膜(以利于固定液渗透于睾丸内部,避免由于组织固定不良而导致染色信息不完整)。睾丸组织经梯度乙醇脱水、石蜡包埋后以5μm厚度切片。切片经脱蜡水化后行伊红染色、苏木素复染、梯度乙醇脱水、二甲苯透明、中性树胶封片后,显微镜下观察睾丸组织病理变化。
(二)免疫组化法分析睾丸组织CD31、F4/80及TNFα表达情况
睾丸组织石蜡切片常规脱蜡至水,3%H2O2孵育10min,双蒸水冲洗浸泡5min,柠檬酸盐微波炉抗原修复10 min,室温下自然冷却。根据免疫组化试剂盒滴加一抗孵育,加相应二抗,最后以DAB试剂盒显色。阳性表达为棕黄色染色,使用Image-Pro Plus 6.0软件进行累积吸光度分析抗原相对表达量。
(三)TUNEL染色法观察小鼠睾丸生精细胞凋亡情况
睾丸组织石蜡切片常规脱蜡至水。切片置入pH6.0柠檬酸盐抗原修复液中微波炉高温加热1min,迅速将切片移入20℃双蒸水中冷却,PBS浸洗。将适量TUNEL反应混合物滴加在切片上,湿盒内37℃孵育60min,PBS浸洗3次。切片滴加3%H2O2室温10min以阻断内源性过氧化物酶活性,加入适量辣根过氧化物酶标记的抗荧光素抗体,湿盒内30min,PBS浸洗3次。加入DAB显色液染色,凋亡生精细胞为棕色,自来水充分清洗玻片。苏木素复染、梯度乙醇脱水、二甲苯透明,以中性树胶封片。使用Image-Pro Plus 6.0软件进行累积吸光度分析抗原相对表达量。
(四)ELISA定量检测小鼠血及睾丸蛋白TNFα和MCP-1的表达水平
全血样本于室温冰块上静置1h,4℃ 3 000×g,15min离心,收集上清于-80℃保存待检测。睾丸经液氮速冻研磨粉碎。超声匀浆,600×g、5min离心,取上清-80℃保存待检测。根据ELISA检测试剂盒的操作步骤定量检测血及睾丸组织中TNFα和MCP-1细胞因子表达量。
(五)睾丸微循环血流灌注水平检测
在造模结束当日以1.5%戊巴比妥钠腹腔注射麻醉小鼠,并使其仰卧固定于扫描台。酒精消毒腹部皮肤,切开下腹部,轻提附睾周围白色脂肪暴露睾丸。应用Moor VMS - LDF VP4针式探针检测小鼠睾丸微循环血流量。LDF监测基带带宽15kHz,血流输出量5V=1000U,时间常数0.5s。单次扫描时间>1.5min,时程约5min。通过Moor VMS PC 2.1软件提取各时相的睾丸血流灌注水平(perfusion unit,PU),计算平均灌注量(PU/min)。
(六) 统计学分析
结 果
一、两组小鼠体质量及血糖比较
高脂组小鼠经高脂饮食20周后,体质量增加显著(45.00±3.00)g,与对照组(32.50±1.88)g 相比有显著性差异(P<0.01);高脂组空腹血糖(9.96±1.57)mmol/L,显著高于对照组的(5.32±1.16)mmol/L(P<0.01),见图1。同时,对照组小鼠睾丸外观饱满,白膜质地柔韧,针刺时无阻力感;高脂组睾丸外观色泽暗淡,白膜质地韧度增高,针头较难刺入。

图1 高脂组与对照组小鼠体质量及血糖的变化
二、两组小鼠睾丸形态学及生精细胞凋亡水平染色
对照组小鼠睾丸HE染色结果显示,生精上皮结构完整,各级生精细胞排列有序,睾丸间质结构紧密。高脂组小鼠睾丸生精上皮结构紊乱,生精细胞之间排列松散,成熟生精细胞减少,无可见长型精子,生精小管萎缩;睾丸间质膨大,细胞增多。TUNEL染色结果显示:对照组小鼠睾丸仅可见个别凋亡生精细胞,IA值为(0.92±0.07)×107;而高脂组可见各级生精细胞凋亡, 且凋亡显著,IA值为(1.87±0.13)×107,显著高于对照组(P<0.01),且生精上皮有不同程度破坏,见图2。

图2 睾丸组织HE染色及生精细胞TUNEL表达水平 (×400, n=5)
三、两组小鼠睾丸TNFα及F4/80表达水平
高脂组小鼠睾丸TNFα表达IA值为(5.95±0.14)×108显著高于对照组[IA值为(0.57±0.05)×108](P<0.001),生精小管、睾丸间质及微血管均有表达;高脂组睾丸间质巨噬细胞表达IA值为(3.16±0.20)×107数量也显著多于对照组IA值为(1.14 ± 0.13)×107(P<0.01),主要分布在睾丸间质微血管附近,见图3。
四、血及睾丸组织中TNFα和MCP-1的含量
ELISA检测结果显示,高脂组血中及睾丸蛋白中TNFα(血对照组:796.00±165.00 pg/mL,高脂组:3900.00±236.00 pg/mL;睾丸匀浆control:1219.00±127.00 pg/mL,高脂组:9612.00±377 pg/mL)和MCP-1(血对照组:121.00±39.00 pg/mL,高脂组:490.00±53.00 pg/mL;睾丸匀浆对照组:129.00±29.00 pg/mL,高脂组:612.00±77.00 pg/mL)表达量均显著高于对照组(P<0.001),见图4。
五、睾丸微血管内皮细胞CD31表达水平以及微血管血流灌注水平
与对照组[IA值为(2.41±0.15)×107]相比,高脂组睾丸微血管内皮细胞特异性标志物CD31免疫组化染色表达缺失[IA值为(1.24±0.13)×107](P<0.05)。激光多普勒血流灌注监测系统显示,高脂组睾丸微血管血流灌注水平降低(对照组:557.40±135.00PU/min vs 高脂组:95.48±38.35 PU/min,t =10.92, P<0.001),见图5。

图3 睾丸组织TNFα及F4/80免疫组表达 (×400, n=5)
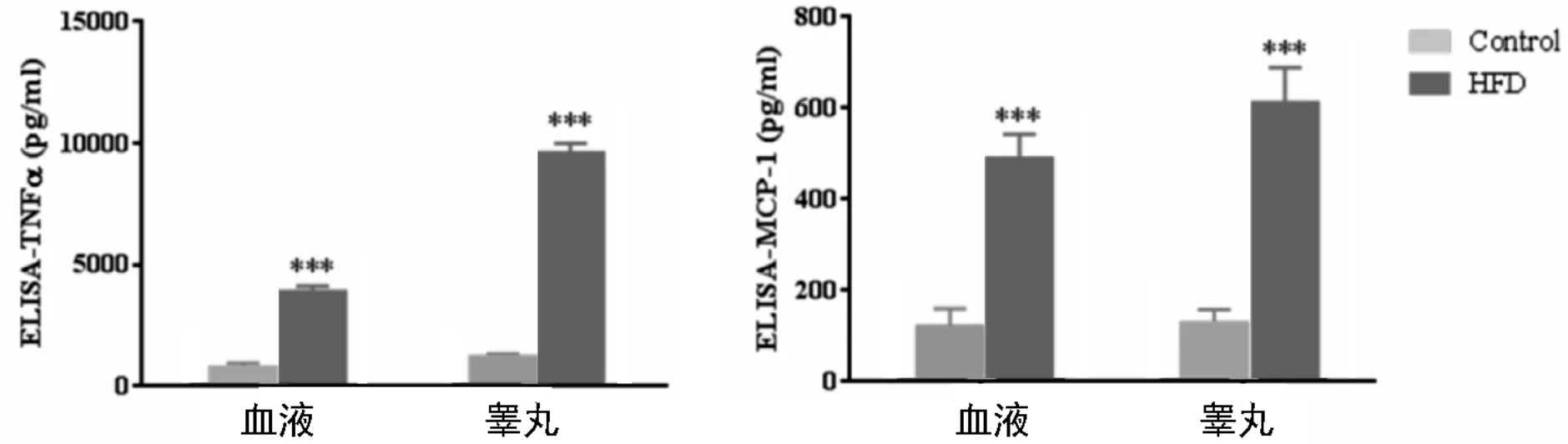
图4 TNFα及MCP-1在血及睾丸蛋白中的表达量

图5 小鼠睾丸微血管内皮细胞CD31表达变化及微血管血流灌注水平(×400, n=5)
讨 论
睾丸微循环参与维持睾丸内环境稳态,是睾丸内血液供应、物质代谢等重要生命活动的场所[7]。微血管内皮细胞是睾丸微血管的结构基础。有文献报道,高脂饮食可诱导血管内皮细胞损伤并进一步诱发血管性疾病[8],但高脂饮食对睾丸微血管的影响罕见报道。为了解高脂饮食诱导的睾丸微血管变化,本研究进行了睾丸微血管免疫组化染色及睾丸微血管激光多普勒扫描检测。结果显示,高脂组睾丸微血管内皮细胞CD31表达减少甚至缺失,睾丸微循环血流灌注水平降低,提示高脂组睾丸微血管受损。此外,本研究C57BL/6小鼠经20周高脂饲养后,空腹血糖水平显著高于对照组(P<0.01)。常规组织学染色显示,高脂组睾丸生精上皮出现空泡样改变,成熟生精细胞减少,甚至无长形精子。TUNEL染色结果发现,高脂组各级生精细胞均有凋亡,提示高脂组生精上皮受损,生精细胞生成障碍。由于高血糖可致小鼠睾丸微循环受损并可间接诱导生精功能障碍[9],因此本研究认为高脂饮食诱导小鼠血糖增高是高脂小鼠睾丸微血管损伤的促发因素之一。
以往的研究主要针对高脂饮食诱导氧化应激对男性生殖的不良影响[10]。而最近有学者提出男性肥胖阉割理论(GELDING theory of male hypogonadism)[11],其关键论点在于:高脂饮食对男性生殖的损害是由于高脂饮食产生的肠源性内毒素刺激并损伤血-肠黏膜屏障,内毒素由肠道入血,使体内相关免疫系统被激活,形成肠源性内毒素血症,可直接或间接损伤男性生精功能。另有文献报道,肠源性内毒素血症是高脂诱导的全身性炎症反应的关键因素[12]。基于以上肠源性内毒素理论,本研究推测,高脂饮食诱导小鼠血糖增高损伤睾丸微血管内皮细胞,使睾丸微血管功能受损;由于睾丸微血管是血睾屏障的重要组成部分[13],微血管损伤可能破坏血睾屏障完整性,使高脂诱导的内毒素通过受损的血睾屏障进入生精小管并损伤生精细胞。因此下一阶段,将完善高脂饮食诱导的体内内毒素表达水平测定及内毒素对睾丸微血管内皮细胞及生精细胞影响的相关研究,以进一步论证男性阉割理论中内毒素对雄性生殖的影响。
内毒素有效成分脂多糖(lipopolysaccharide,LPS)是体内特异性炎症受体(toll like receptors,TLRs)的配体[14],LPS激活TLRs后活化核转录因子NF-κB并激活下游与炎症相关的基因分泌TNFα等一系列炎症细胞因子[15-19]。最近也有文献报道,高脂饮食可诱导发育前期肥胖大鼠睾丸内炎症细胞增多[20],因此笔者检测了小鼠血中及睾丸组织匀浆中炎症因子TNFα和MCP-1 水平以及睾丸巨噬细胞特异性标志物F4/80的表达水平。结果显示高脂组血中及睾丸组织匀浆中炎症因子TNFα和MCP-1 水平均显著增高。由此我们推测,由肠道入血的肠源性内毒素进入睾丸微血管系统,激活了睾丸微血管内皮细胞上与炎症相关的TLRs受体分泌释放TNFα、MCP-1等炎症因子。由于TNFα在诱发局部炎症反应及免疫调节方面具有重要的生物活性,能刺激微血管内皮细胞等靶细胞再次合成和分泌炎症因子[21],可能进一步加剧了睾丸微血管内皮细胞损伤。此外,TNFα、MCP-1等炎症细胞因子可能通过损伤的微血管渗透或扩散进入睾丸生精小管或睾丸间质,MCP-1可募集睾丸内炎症细胞[22],使炎症细胞在睾丸聚集并发生免疫炎性反应,形成非感染性睾丸炎[23]。本研究结果显示,高脂组睾丸内F4/80表达增多;巨噬细胞免疫炎性反应可继续释放炎症细胞因子,又将加剧对生精细胞的损伤,可能最终致雄性不育[23]。
综上所述,高脂饮食诱导肥胖小鼠血糖水平升高导致睾丸微血管损伤;由高脂饮食产生的肠源性内毒素可能激活了睾丸微血管内皮细胞上与炎症相关的TLRs受体,释放炎症因子;炎症细胞因子通过损伤的微血管内皮细胞渗透进入睾丸实质,募集炎症细胞在睾丸间质聚集,致睾丸内发生非感染性炎症反应,并再次释放炎症细胞因子,后者通过受损的血睾屏障进入生精小管,损伤生精细胞,最终引发雄性生殖功能障碍。通过纠正高脂饮食诱导的血糖增高对睾丸微血管的损伤,减轻睾丸内非感染性炎症反应,可能成为临床针对高脂饮食诱导的男性生精功障碍的治疗靶点之一。
