铁皮石斛对小鼠和胰岛瘤细胞胰岛素抵抗的改善作用
2018-07-27陈瑛波景作磊刘利平姜如娇吴英杰
陈瑛波,宋 丹,吴 晋,景作磊,刘利平,姜如娇,孙 捷,吴英杰,5
(1.大连医科大学 重大疾病基因工程模式动物研究所,辽宁 大连 116044;2.大连医科大学 基因工程模式动物国际联合研究中心,辽宁 大连 116044;3.大连医科大学中西医结合研究院,辽宁 大连 116044;4.吉林大学第一医院干部病房,吉林 长春 130021; 5.西奈山医学院内分泌、糖尿病和骨疾病系, 纽约 100029)
根据国际糖尿病联盟2017年发布的第8版全球糖尿病地图统计数据,截至2017年,全球有4.25亿糖尿病患者,我国成年(20~79岁)糖尿病患病人数达到1.14亿,占世界糖尿病患者的25%,预计到2045年,全球将会有近7亿糖尿病患者[1]。2型糖尿病由胰岛素抵抗和胰岛β细胞的功能受损导致,随着糖尿病的进展,会出现严重的并发症[2],如何预防和治疗糖尿病成为我国乃至全球的重大卫生问题之一。中医将糖尿病的多饮、多食、多尿和身体消瘦的“三多一少”症状称之为“消渴症”,其病机为阴虚为本、燥热为标。中药除了使用经方作为糖尿病的治疗药物之外,部分单味的中药或中药提取物也可用于治疗糖尿病。现代药理学研究[3]表明:中药铁皮石斛的主要药理成分包括多糖、石斛碱、氨基酸和微量元素等。研究[4]表明:铁皮石斛对高糖、高脂及低剂量链脲佐菌素(STZ)诱导的糖尿病大鼠有明显的降糖作用,但其具体机制尚不明确。本研究将采用瘦型的糖尿病模型MKR小鼠(mouse over-expressing a dominant-negative human IGF-1 receptor specifically in muscle)和MIN6胰岛瘤细胞,探讨中药铁皮石斛(Dendrobiumcandidum,DC)对小鼠胰岛素抵抗的影响及其机制。
1 材料与方法
1.1 实验动物、细胞、主要试剂和仪器 12只SPF级FVBN小鼠和12只同背景SPF级MKR小鼠,购自大连医科大学基因工程模式动物研究所SPF动物中心;饲养条件:温度21℃~23℃,相对湿度30%~60%,12 h照明/黑暗交替的环境。小鼠胰岛瘤MIN6细胞由上海第二军医大学章卫平教授赠送。
铁皮石斛干品,广东省东莞市睿绅生物技术有限公司;二甲双胍(metformin , Met),TCI(上海)化成工业发展有限公司;葡萄糖,美国Sigma Aldrich公司;胰岛素,万邦生化医药股份有限公司;反转录试剂盒和qPCR检测试剂盒,北京全式金生物技术有限公司;Trizol,宝生物有限公司;DMEM培养基和3种抗生素(青霉素/链霉素/两性霉素B)混合液,美国Gibco公司;胎牛血清, 美国GEMINI公司;胰岛素ELISA试剂盒,武汉优尔生科技股份有限公司;兔抗鼠蛋白激酶B(AKT)、磷酸化蛋白激酶B(p-AKT)和磷酸肌醇3激酶(PI3K)单克隆抗体,美国CST公司;兔抗鼠磷酸化磷酸肌醇3激酶(p-PI3K)、胰岛素受体底物1(IRS1)、磷酸化胰岛素受体底物1(p-IRS1)、磷酸化糖原合成酶激酶3β(p-GSK3β)和糖原合成酶激酶(GSK3β)单克隆抗体,美国Abcam公司;凋亡检测试剂盒,美国Thermo-Fisher Scientific公司。血糖试纸和血糖仪,瑞士Roche公司。
1.2 纯合子MKR小鼠的获得 利用F0代杂合子小鼠杂交获得F1代,F1代小鼠与WT小鼠进行杂交产生F2代,通过F2代的基因型鉴定确定F1代小鼠纯合与否,选择纯合的雄性并伴有明显糖尿病症状的MKR小鼠作为实验用鼠。
1.3 DC的制备 称取200 g铁皮石斛,粉碎至1~2 cm的小段,加入1 L水浸泡1 h。煎煮2次,合并2次水煎液,用纱布过滤,浓缩至50 mL,最终取得的DC浓度按照生药量计算为4 g·mL-1。
1.4 小鼠葡萄糖耐量实验(glucose tolerance test,GTT)和胰岛素耐量实验(insulin tolerance test,ITT) GTT:小鼠禁食12~14 h后,腹腔注射20 %葡萄糖溶液,注射体积为小鼠体质量(g)×10 μL,检测0、15 、30、60和120 min时小鼠血糖水平。ITT:小鼠禁食4~6 h后,腹腔注射0.1 U·mL-1胰岛素溶液,注射体积为小鼠体质量(g)×10 μL,检测0、15、30 和60 min时小鼠血糖水平。
1.5 DC降糖作用最佳浓度筛选实验及各组小鼠血糖水平检测 9周龄MKR小鼠随机分为空白对照组和10 、20 及40 g·kg-1·d-1DC组,每组3只,分别灌胃给予生理盐水和相应剂量DC,连续灌胃4周。通过GTT和ITT筛选DC降糖作用最佳浓度。另选取8周龄的MKR雄性小鼠随机分为对照组、DC组、二甲双胍(Met)组和联合用药(Met+DC)组,每组3只,连续给药8周,通过GTT和ITT检测各组小鼠血糖水平。其中,DC浓度为上述实验筛选出的DC降糖作用最佳浓度,Met浓度为300 mg·kg-1·d-1。实验结束后,处死各组小鼠,留取肝脏和皮下脂肪组织,-80℃保存备用。
1.6 qPCR法检测小鼠肝脏组织中磷酸烯醇式丙酮酸羧激酶(Pepck)、葡萄糖激酶(Gck)和皮下脂肪组织中氧化物酶增殖物激活受体γ( Ppar-γ )mRNA表达水平 利用Trizol 法提取各组小鼠肝脏和皮下脂肪组织RNA,将其反转录为cDNA。引物序列:GAPDH,上游引物GGAGAAACCTGCCAAGTATG, 下游引物GGAGTTGCTGTTGAAGTCGC;Pepck,上游引物GAGAGCCTGCCTCCACAA,下游引物CGACCCAGCTGGCTACTT; Gck,上游引物AGGAGGCCAGTGTAAAGATGT,下游引物 CTCCCAGGTCTAAGGAGAGAAA; Ppar-γ,上游引物TGTGGACCTCTCCGTGATGG,下游引物GGTTCTACTGCACTTTGG。采用7900H T Fast Real-Time PCR System进行 qPCR检测和分析。以GAPDH为内参,通过2-ΔΔCt法计算各基因的mRNA表达水平。
1.7 细胞培养 小鼠胰岛瘤MIN6细胞常规培养于含13% 胎牛血清、三抗(100 U·mL-1青霉素、100 U·mL-1链霉素及100 U·mL-1两性霉素B)的DMEM培养液中,置于5%CO2恒温培养箱中培养。
1.8 MTT法检测细胞增殖活性[5]取对数生长期细胞,消化制备单细胞悬液,调整细胞密度为3 000个/孔,接种于96孔板,不同药物处理48 h后,每孔加入MTT(5 g·L-1)10 μL,37℃孵育4 h,吸去培养基,每孔加入DMSO溶液150 μL,振荡10 min,用酶标仪于490 nm波长处检测吸光度(A)值,以A值代表细胞增殖活性,实验重复3次。
1.9 葡萄糖刺激下的胰岛素分泌能力实验(GSIS) 为进一步探索DC对胰岛细胞增殖和胰岛素分泌的影响,采用高浓度棕榈酸(H-PA)和高浓度葡萄糖(H-Glu)诱导MIN6细胞胰岛素抵抗,MIN6细胞分别置于不同浓度H-PA( 5、10、20 、40、80、160和320 μmol·L-1)、H-Glu(5、30 和60 mmol·L-1)和DC(0、0.48、0.96、1.44、1.92、2.40、2.88、3.37和3.80 g·L-1)中培养48 h,最终选定H-PA和H-Glu 最佳诱导浓度和DC作用浓度。
MIN6细胞分为对照组、H-PA组、H-Glu组、H-PA+H-Glu组 、H-PA+DC组、H-Glu+DC组和H-PA+H-Glu+DC组。将各组MIN6细胞置于不同条件处理的培养基中培养48 h,去除培养基,改用无糖KRBB液中培养2 h,弃去培养基,在含2.8和16.7 mmol·L-1葡萄糖的KRBB液中分别培养1 h,收集上清,ELISA试剂盒检测各组细胞中胰岛素水平。
1.10 Annexin Ⅴ/PI 双染试剂盒检测MIN6细胞凋亡率 选取对数生长期MIN6细胞,分组方法同1.9,分别采用不同药物处理后,用Annexin Ⅴ/PI Kit溶液与细胞混悬液按比例混匀后室温放置20 min,按照试剂盒说明采用流式细胞术检测各组细胞凋亡率[6]。
1.11 Western blotting法检测MIN6细胞中PI3K/AKT通路蛋白表达水平 选取对数生长期MIN6细胞,分组方法同1.9,收集各组细胞,加入裂解液提取蛋白,采用BCA法测定蛋白浓度。SDS-PAGE电泳分离蛋白样本,再将蛋白转印至NC膜上,5%脱脂奶粉封闭,加入p-IRS-1、p-PI3K、p-AKT和p-GSK3β一抗、二抗孵育,ECL显影。以各实验组与对照组灰度值之比表示蛋白表达水平[7]。

2 结 果
2.1 DC降糖作用最佳浓度筛选实验 与空白对照组比较,20 和40 g·kg-1·d-1DC组小鼠血糖水平明显降低(P<0.05)(图1A)。给药后ITT结果显示:与空白对照组比较,注射胰岛素后30和60 min时,20 g·kg-1·d-1DC组小鼠血糖水平明显降低(P<0.05),即20 g·kg-1·d-1DC对小鼠胰岛素抵抗有一定的改善作用(图1B)。小鼠给药后2 h内血糖水平检测结果显示:与空白对照组比较,20和40 g·kg-1·d-1DC组小鼠血糖水平降低(P<0.05)(图1C)。最终选择生药量20 g·kg-1·d-1作为与Met联合用药的DC最佳浓度。
2.2 各组MKR小鼠血糖水平及GTT和ITT结果 给药后各组小鼠随机血糖:与对照组比较,DC组(P>0.05)和Met组(P<0.05)小鼠随机血糖水平有所降低,联合用药组小鼠血糖水平降低更加明显(P<0.05);与Met组比较,联合用药组小鼠随机血糖水平明显降低(P<0.05)。给药8周后,GTT结果显示:与对照组比较,其余各组小鼠在注射葡萄糖60 min后血糖水平降低,联合用药组小鼠血糖水平降低更加明显;ITT结果显示:联合用药组小鼠胰岛素敏感性明显提高,胰岛素抵抗情况明显改善。见图 2。
2.3 各组MKR小鼠肝脏组织中Pepck、Gck和皮下脂肪组织中 Ppar-γ mRNA表达水平 与对照组比较,联合用药组小鼠肝脏组织中Pepck mRNA表达水平明显降低(P<0.05),Gck mRNA表达水平明显升高(P<0.05);与对照组比较,Met组和联合用药组小鼠皮下脂肪组织中Ppar-γ mRNA表达水平明显升高(P<0.05)。见表1。

*P<0.05 compared with blank control group;1:Blank control group;2:10 g·kg-1·d-1DC group;3:20 g·kg-1·d-1DC group;4:40 g·kg-1·d-1DC group.A: The fasted blood glucose levels of MKR mice after treated by DC for 8 weeks; B: The insulin tolerance test of MKR mice after treated by DC for 8 weeks; C: The blood glucose levels of MKR mice after treated by DC for 120 min.
图1 DC降糖最佳浓度筛选
Fig.1 Determination of optimum concentration of DC in reducing blood glucose levels

*P<0.05 compared with control group;△P<0.05 compared with Met group.A: The blood glucose levels of MKR mice treated by DC and (or) metformin; B:The glucose tolerance test of MKR mice treated by DC and (or) metformin; C: The insulin tolerance test of MKR mice treated by DC and (or) metformin.
图2 各组MKR小鼠血糖水平和GTT及ITT结果
Fig.2 Levels of blood glucose and results of GTT and ITT of MKR mice in various groups
表1 各组MKR小鼠肝脏组织中Pepck、Gck和皮下脂肪组织中 Ppar-γ mRNA表达水平
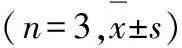
GroupPepckGckPpar-γControl1.000±0.3661.000±0.1241.000±0.104DC0.700±0.0841.000±0.0401.500±0.653Met0.600±0.1071.100±0.0591.400±0.075∗Met+DC0.600±0.043∗1.300±0.080∗1.800±0.408∗
*P<0.05 compared with control group.
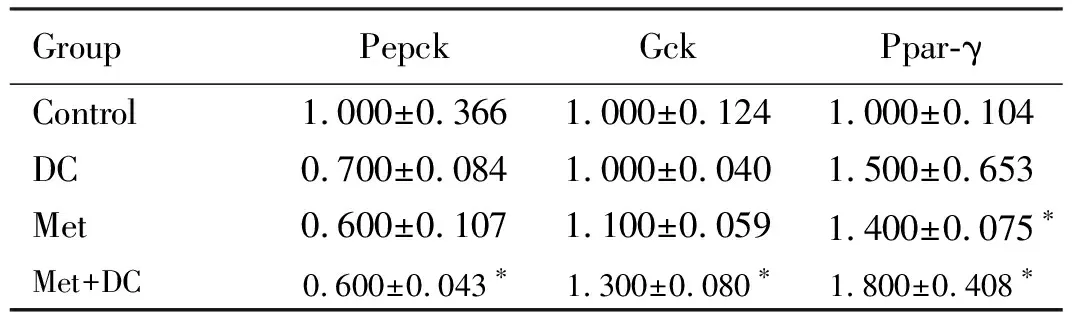
2.4 各组MIN6细胞增殖活性和GSIS实验中各组MIN6细胞胰岛素分泌水平 采用H-PA和H-Glu对MIN6细胞诱导胰岛素抵抗,结果显示:MTT法检测H-PA诱导下各组细胞增殖活性,与对照组比较,80、160和320 μmol·L-1H-PA组MIN6细胞增殖活性明显降低(P<0.05),H-PA 最适诱导浓度为160 μmol·L-1(表2);ELISA法检测H-Glu诱导下各组细胞胰岛素分泌水平,与对照组比较,30 和60 mmol·L-1H-Glu组MIN6细胞胰岛素分泌水平明显降低(P<0.05),最终确定H-Glu最适诱导浓度为30 mmol·L-1(表3);MTT法检测DC作用下各组细胞增殖活性,与对照组比较,0.96、1.44、1.92、2.40、2.88、3.37和3.80 g·L-1DC组MIN6细胞增殖活性明显降低(P<0.05), DC最适作用浓度为1.44 g·L-1(表4)。MIN6细胞在2.8 和16.7 mmol·L-1葡萄糖刺激下GSIS实验结果显示:分别与H-PA组、H-Glu组和H-PA+H-Glu组比较,加入DC后,H-PA+DC组、H-Glu+DC 组和H-PA+H-Glu+DC 组MIN6细胞胰岛素分泌水平明显升高(P<0.05),表明DC可改善H-PA或(和)H-Glu诱导的胰岛素抵抗(图3)。
2.5 流式细胞术检测各组MIN6细胞凋亡率 与对照组(0%)比较, H-PA组、H-Glu组和H-PA+H-Glu组MIN6细胞凋亡率明显升高。经DC处理后,H-PA+DC组、H-Glu+DC组和 H-PA+H-Glu+DC组细胞凋亡率分别降低了9.99%、21.51%和25.02%(图 4和表5)。
表2 MTT法检测H-PA 诱导下各组MIN6细胞增殖活性


GroupA valueControl 0.526±0.050H-PA(μmol·L-1) 5 0.504±0.052 10 0.476±0.023 20 0.433±0.056 40 0.421±0.017 80 0.334±0.020∗ 160 0.268±0.021∗ 320 0.257±0.045∗
*P<0.05 compared with control group.
表3 ELISA 法检测H-Glu诱导下各组MIN6细胞胰岛素分泌水平

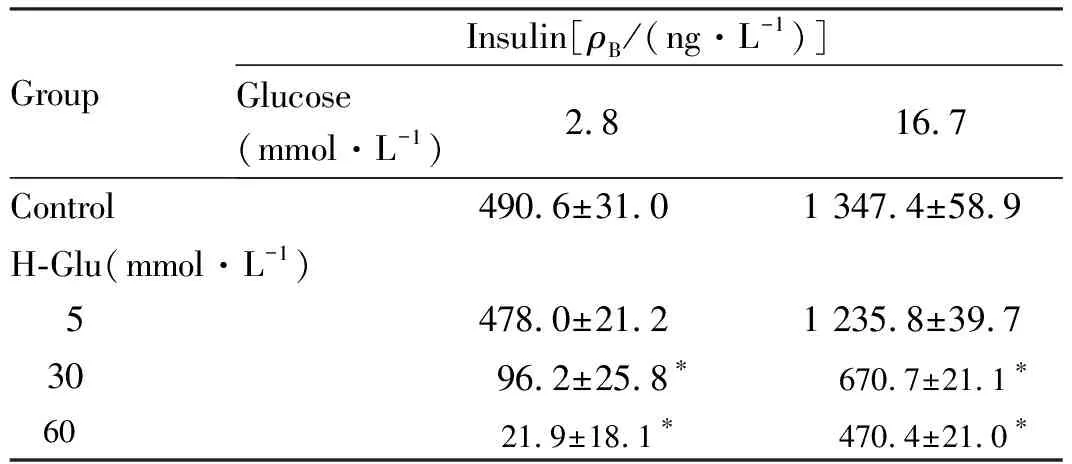
GroupInsulin[ρB/(ng·L-1)]Glucose(mmol·L-1)2.8 16.7Control490.6±31.01 347.4±58.9H-Glu(mmol·L-1) 5478.0±21.21 235.8±39.7 3096.2±25.8∗670.7±21.1∗ 6021.9±18.1∗470.4±21.0∗
*P<0.05 compared with control group.
2.6 各组MIN6细胞中PI3K/AKT通路蛋白表达水平 与对照组比较,H-Glu组、H-PA组和H-PA +H-Glu组MIN6细胞中p-IRS-1、p-PI3K和p-AKT表达水平明显降低(P<0.05),H-PA+H-Glu 组MIN6细胞中p-GSK3β表达水平明显升高(P<0.05);分别与H-Glu组、H-PA组和H-PA+H-Glu组比较,加入DC后,H-Glu+DC组、H-PA+DC 组和H-PA+H-Glu+DC 组MIN6细胞中p-IRS-1、p-PI3K和p-AKT表达水平明显升高(P<0.05), H-PA+H-Glu+DC组MIN6细胞中 p-GSK3β表达水平明显降低(P<0.05)。见图5和表6、7。
表4 MTT法检测DC作用下各组MIN6细胞增殖活性


GroupA valueControl 0.677±0.018DC(g·L-1) 0.48 0.615±0.014 0.960.561±0.018∗ 1.44 0.514±0.022∗ 1.92 0.403±0.021∗ 2.400.342±0.020∗ 2.880.264±0.071∗ 3.370.102±0.015∗ 3.800.072±0.002∗
*P<0.05 compared with control group.
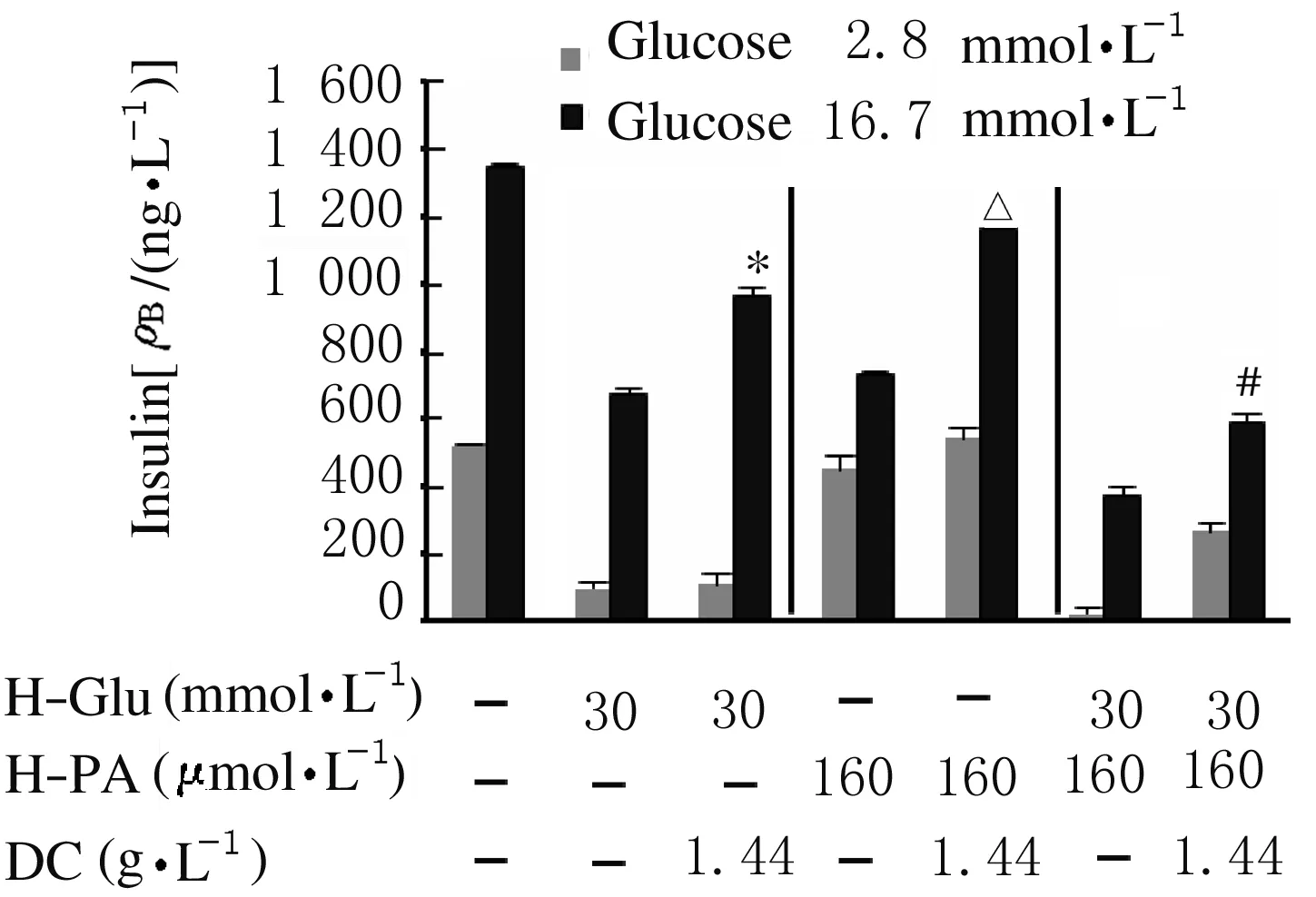
*P<0.05 compared with H-Glu(30 mmol·L-1) group;△P<0.05 compared with H-PA (160 μmol·L-1) group;#P<0.05 compared with H-PA (160 μmol·L-1)+H-Glu(30 mmol·L-1) group.
图3 ELISA法检测各组MIN6细胞胰岛素分泌水平
Fig.3 Levels of insulin secretion of MIN6 cells in various groups detected by ELISA
3 讨 论
2型糖尿病的发病原因主要为外周组织(肝脏、脂肪和肌肉)胰岛素抵抗和胰岛细胞分泌胰岛素受损。单纯西药治疗2型糖尿病的不良反应越来越受到关注。中医以整体观念为核心思想,在糖尿病的治疗方面,既能改善糖尿病的表现症状,降低血糖,又能保护外周组织,预防并发症的发生。施红等[4, 8]以石斛为君药组方配制了石斛合剂,通过临床观察和实验研究发现:石斛合剂对高血糖有明显的治疗作用。黎同明等[9]发现:石斛合剂对STZ诱导的2型糖尿病大鼠有明显的降糖作用,并且可以保护和修复受损的胰腺组织。石斛可以通过影响肝脏的糖代谢和胰岛细胞的分泌功能来改善糖尿病症状。
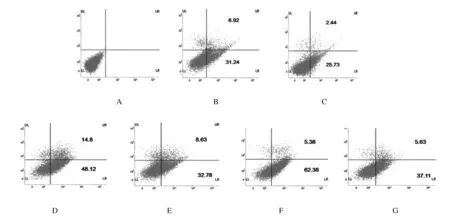
A:Control group;B:H-Glu group;C:H-Glu+DC group; D:H-PA group; E:H-PA+DC group; F:H-PA+H-Glu group; G:H-PA+H-Glu+DC group.
图4 流式细胞术检测各组MIN6细胞凋亡率
Fig.4 Apoptotic rates of MIN6 cells in various groups detected by flow cytometry
表5 各组MIN6细胞凋亡率


GroupEarly apoptotic rateLate apoptotic rateControl00H-Glu31.246.92H-Glu+DC25.732.44H-PA48.1214.80H-PA+DC32.788.63H-PA+H-Glu62.305.38H-PA+H-Glu+DC37.115.63
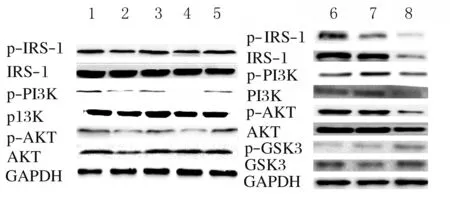
Lane 1,6:Control group;Lane 2:H-Glu group;Lane 3:H-Glu+DC group;Lane 4:H-PA group;Lane 5:H-PA+DC group;Lane 7:H-PA+H -Glu+DC group;Lane 8:H-PA+H-Glu+DC group.
图5 Western blotting 法检测各组MIN6细胞中PI3K/AKT通路蛋白表达电泳图
Fig.5 Electrophoregram of expressions of PI3K/AKT pathway proteins in MIN6 cells detected by Western blotting method
表6 各组MIN6细胞中p-IRS-1、p-PI3K和p-AKT蛋白表达水平


Groupp-IRS1p-PI3Kp-AKTControl1.000±0.0071.000±0.0061.000±0.019H-Glu0.780±0.075∗0.520±0.041∗0.320±0.017∗H-Glu+DC0.990±0.032△0.700±0.038△0.530±0.240△H-PA0.880±0.021∗0.120±0.028∗0.230±0.039∗H-PA+DC0.980±0.082#0.580±0.021#0.450±0.003#
*P<0.05 compared with control group;△P<0.05 compared with H-Glu group;#P<0.05 compared with H-PA group.
本研究首次使用瘦型MKR糖尿病小鼠模型对DC的降糖作用进行研究,并在体外利用MIN6胰岛瘤细胞研究DC对胰岛细胞分泌功能的影响。MKR小鼠是通过转基因技术在小鼠骨骼肌中特异性高表达人源性IGF-1受体显性抑制突变体。与同周龄野生型小鼠比较,MKR小鼠体质量较轻,随着小鼠生长,逐渐出现高血糖、高血脂和高胰岛素血症,是研究非肥胖2型糖尿病的最佳模型[10-11]。MIN6细胞系是从表达类人猿病毒40大T抗原(受胰岛毒启动子控制)的转基因非肥胖糖尿病小鼠胰岛瘤中建立的,其内分泌功能与胰腺组织非常接近,是研究胰岛细胞功能的理想模型[12]。
表7 各组MIN6细胞中p-IRS-1、p-PI3K、p-AKT和p-GSK3β蛋白表达水平


Groupp-IRS1p-PI3Kp-AKTp-GSK3βControl1.000±0.0371.000±0.0181.000±0.0261.000±0.031H-PA+H-Glu 0.110±0.021∗0.870±0.034∗0.210±0.039∗1.210±0.017∗H-PA+H-Glu+DC 0.310±0.043△1.220±0.036△0.710±0.021△1.110±0.025△
*P<0.05 compared with control group;△P<0.05 compared with H-PA+H-Glu group.
MKR小鼠体内的糖代谢异常和胰岛素抵抗情况与多种因素有关,其中肝脏糖异生和糖降解在血糖调节中起关键作用。Pepck是糖异生中最重要的酶之一,其表达水平直接反映糖异生的效率[13-14];Gck是糖代谢中第一个限速酶,其水平直接影响体内糖代谢过程[15- 16]。本研究结果显示:联合用药组小鼠肝脏组织中Pepck mRNA表达水平明显降低,Gck表达水平明显升高。可见,DC联合Met主要通过调节Pepck和Gck的表达来改善受损肝脏的糖代谢过程。
Ppar-γ是过氧化物酶增殖物激活受体家族中的一员,在糖脂代谢和胰岛素信号通路中发挥重要作用。Ppar-γ在脂肪组织中的表达水平最高,并通过提高外周组织对胰岛素的敏感性来调节糖脂代谢[17-19]。本研究结果显示:DC联合Met用药8周后,小鼠皮下脂肪组织中Ppar-γ mRNA表达水平明显升高,表明DC联合Met可能通过上调Ppar-γ的表达来提高胰岛素敏感性,从而缓减胰岛素抵抗症状。
为了进一步探索DC对β细胞的影响,本实验利用高脂、高糖环境所诱导的MIN6细胞胰岛素抵抗来研究DC对β细胞胰岛素分泌的影响。本研究结果显示:DC可以改善棕榈酸和葡萄糖所诱导的MIN6细胞胰岛素抵抗,降低MIN6细胞凋亡率,并可激活棕榈酸和葡萄糖损害的胰岛素信号通路(PI3K/AKT )[20-21],从而改善胰岛素抵抗。
综上所述,本研究从动物水平和细胞水平对DC治疗糖尿病的机制进行探讨,结果表明:DC对糖尿病的治疗是多靶点的,一方面DC可以通过调节糖代谢降低小鼠血糖,另一方面可以通过提高胰岛素敏感性来改善小鼠的胰岛素抵抗;与Met组比较,Met+DC组小鼠降糖效果明显提高,糖耐量和胰岛素敏感性明显改善,可能是DC扩充了Met单靶点的作用机制; 细胞实验结果也表明:DC可以增加胰腺β细胞分泌胰岛素的能力,并可激活胰岛素信号通路。本研究采用体内和体外实验探讨了DC对糖尿病的治疗作用及其作用机制,丰富了中西医结合治疗糖尿病的理论,为寻找治疗糖尿病的新药物和新方法提供了理论依据。
