饥饿对Beclin-1依赖的Ana-1细胞自噬和凋亡的影响
2018-07-27杨万霞邢爱华张晓延
杨万霞,苏 强,邢爱华,张晓延
(1.兰州大学第二医院检验科,甘肃 兰州 730000;2.山西医科大学汾阳学院医学检验系,山西 汾阳 032200;3.山西医科大学第一医院神经内科,山西 太原 030001;4.山西医科大学药学院,山西 太原 030001)
自噬是真核细胞特有的保守性细胞应激信号通路,主要将细胞内受损细胞器或蛋白等运输至溶酶体进行降解和循环利用,以此维持细胞内环境稳态[1-2]。Beclin-1是自噬启动的关键蛋白之一,参与早期自噬体膜的形成,并可通过与Bcl-2结合调控自噬和凋亡的发生[3-4]。自噬的失调与多种疾病的发生发展有关[5]。机体在饥饿、氧化应激等条件下可通过诱导自噬来维持正常免疫功能[6-7]。国内外研究大多聚焦于自噬参与肿瘤、病毒感染的发生发展,而有关自噬与免疫细胞的研究鲜有报道。本研究探讨饥饿对小鼠巨噬细胞Ana-1自噬和凋亡的影响,以及自噬相关蛋白Beclin-1在此过程中发挥的作用,为进一步了解免疫细胞发生自噬、凋亡及其相互调控机制提供参考。
1 材料与方法
1.1 细胞、材料和仪器Ana-1细胞购于中科院上海细胞生物研究所。RPMI 1640培养基、HRP标记的羊抗鼠和羊抗兔二抗及通用蛋白裂解液购自武汉博士德生物工程有限公司,胎牛血清购自杭州四季青生物工程材料有限公司,3-甲基腺嘌呤(3-MA)购自美国Selleck公司,β-actin抗体、Beclin-1抗体、LC3抗体和Caspase-3抗体购自美国Cell Signaling Technology公司,ECL化学发光剂购自美国Millipore公司。电泳仪、垂直电泳槽和转印模块购自美国Bio-Rad公司,酶标仪(Eon)购自美国BioTek公司,荧光显微镜(DM4000)购自德国Leica公司。
1.2 细胞培养和传代小鼠巨噬细胞Ana-1接种于含10%胎牛血清、1%青链霉素的RPMI 1640培养基中,在37℃、含5% CO2的培养箱中培养,每隔12~24 h更换新鲜培养液,待细胞长至80%~90%融合时,进行传代。
1.3 Ana-1细胞分组和干预方法为观察饥饿对Ana-1细胞自噬和凋亡的影响,将生长至对数生长期的细胞接种于不含血清、含1%青链霉素的RPMI 1640培养基中培养,分别饥饿0 h(对照组)和3、6、9、12、24 h(饥饿组),采用Western blotting法检测Ana-1细胞中LC3-Ⅱ/ LC3-Ⅰ比值(饥饿6、12和24 h组)和Beclin-1、Caspase-3蛋白表达水平(饥饿3、6、9、12和24 h组),倒置显微镜下观察各组细胞形态表现。为研究饥饿诱导自噬和凋亡的机制,将细胞分为空白对照组、饥饿组、3-MA(10 μmol·L-1)组和3-MA(10 μmol·L-1)联合饥饿组,各组细胞共同培养24 h,采用Western blotting法检测各组Ana-1细胞中LC3-Ⅱ/ LC3-Ⅰ比值和Beclin-1蛋白表达水平及Caspase-3蛋白水平。
1.4 Western blotting法检测各组Ana-1细胞中LC3-Ⅱ/ LC3-Ⅰ比值和Beclin-1蛋白表达水平及Caspase-3蛋白水平离心收集各组细胞,加入通用细胞裂解液,裂解提取蛋白,BCA法定量并调齐蛋白浓度,加入5×上样缓冲液经煮沸5 min,使蛋白变性。细胞总蛋白质经12% SDS-PAGE电泳分离,并用湿法转移到NC膜上;5%脱脂牛奶室温封闭2 h后,分别在对应位置孵育LC3抗体(1∶1 500)、Caspase-3抗体(1∶3 000)和β-actin抗体(1∶1 500),4℃过夜;TBST洗涤3次,每次10 min;HRP标记的羊抗兔和羊抗鼠的二抗(1∶5 000)室温孵育2.5 h,TBST洗涤3次;ECL底物显色、曝光、显影、定影后分析蛋白条带的显色结果。采用Image J软件进行灰度值分析。Beclin-1蛋白表达水平和Caspase-3蛋白水平=每个样本条带灰度值/β-actin灰度值。

2 结 果
2.1 各组Ana-1细胞中LC3-Ⅱ/ LC3-Ⅰ比值与对照组比较,饥饿6、12和24 h组Ana-1细胞中LC3-Ⅱ/ LC3-Ⅰ 比值明显升高(P<0.05或P<0.01),且呈时间依赖性。见图1和表1。
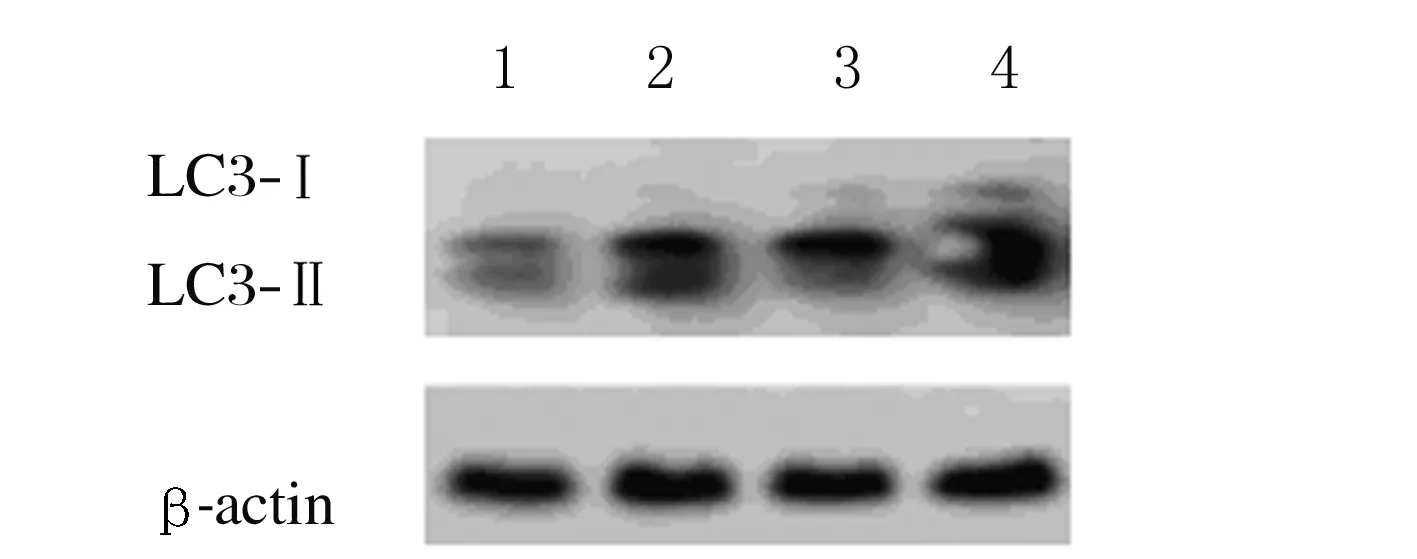
Lane 1:Control group;Lane 2-4:6,12, and 24 h starvation groups.
图1 Western blotting法检测各组Ana-1细胞中LC3蛋白电泳图
Fig.1 Electrophoregram of LC3 proteins in Ana-1 cells in various groups measured by Western blotting method
表1 各组Ana-1细胞中LC3-Ⅱ/ LC3-Ⅰ 比值
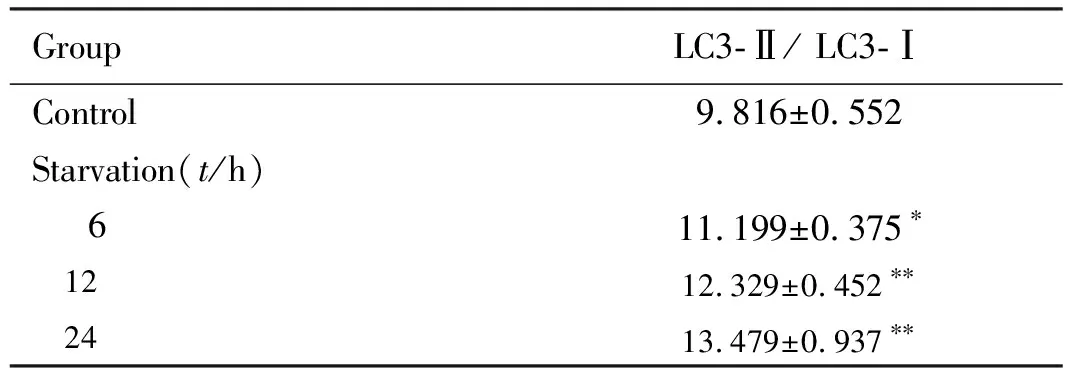
GroupLC3-Ⅱ/ LC3-ⅠControl9.816±0.552Starvation(t/h) 611.199±0.375∗ 12 12.329±0.452∗∗ 24 13.479±0.937∗∗
*P<0.05,**P<0.01 compared with control group.
2.2 各组Ana-1细胞中Beclin-1蛋白表达水平和Caspase-3蛋白水平 与对照组比较,饥饿6、9、12和24 h组Ana-1细胞中Beclin-1蛋白表达水平明显升高(P<0.01),饥饿12和24 h组Ana-1细胞中Caspase-3蛋白水平明显降低(P<0.01),且呈时间依赖性。见图2和表2。

Lane 1:Control group;Lane 2-6:3,6,9,12, and 24 h starvation groups.
图2 各组Ana-1细胞中Beclin-1和Caspase-3蛋白电泳图
Fig.2 Electrophoregram of Beclin-1 and Caspase-3 proteins in Ana-1 cells in various groups
表2 各组Ana-1细胞中Beclin-1蛋白表达水平和Caspase-3蛋白水平
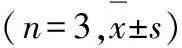
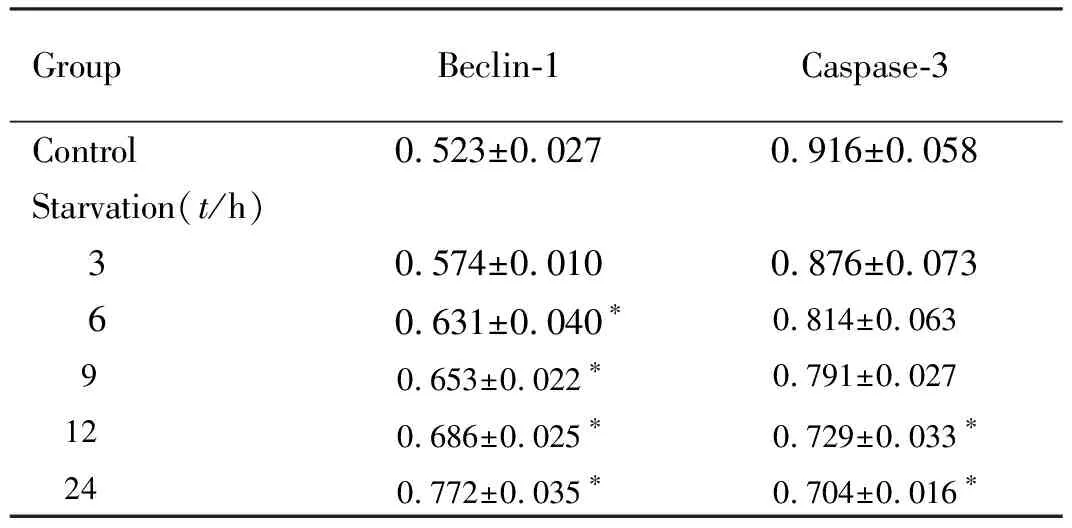
GroupBeclin-1Caspase-3Control0.523±0.0270.916±0.058Starvation(t/h) 30.574±0.0100.876±0.073 60.631±0.040∗0.814±0.063 90.653±0.022∗0.791±0.027 120.686±0.025∗ 0.729±0.033∗ 240.772±0.035∗ 0.704±0.016∗
*P<0.01 compared with control group.
2.3 各组Ana-1细胞的形态表现 饥饿处理Ana-1细胞不同时间后,与对照组比较,饥饿组细胞形态发生改变,出现细胞皱缩和碎片,随着时间的延长,细胞形态变化明显。见图3。

A-C:Control group;D-F:Starvation group;A,D:6 h;B,E:12 h;C,F:24 h.
2.4 饥饿诱导自噬和凋亡的机制实验中各组Ana-1细胞LC3-Ⅱ/ LC3-Ⅰ比值和Beclin-1蛋白表达水平及Caspase-3蛋白水平 与空白对照组比较,饥饿组Ana-1细胞中LC3-Ⅱ/ LC3-Ⅰ比值和Beclin-1 蛋白表达水平明显升高(P<0.05或P<0.01),Caspase-3蛋白水平明显降低(P<0.05);与饥饿组比较,3-MA联合饥饿组Ana-1细胞LC3-Ⅱ/LC3-Ⅰ比值和Beclin-1 蛋白表达水平明显降低(P<0.01),Caspase-3蛋白水平也明显降低(P<0.05)。见图4和表3。
3 讨 论
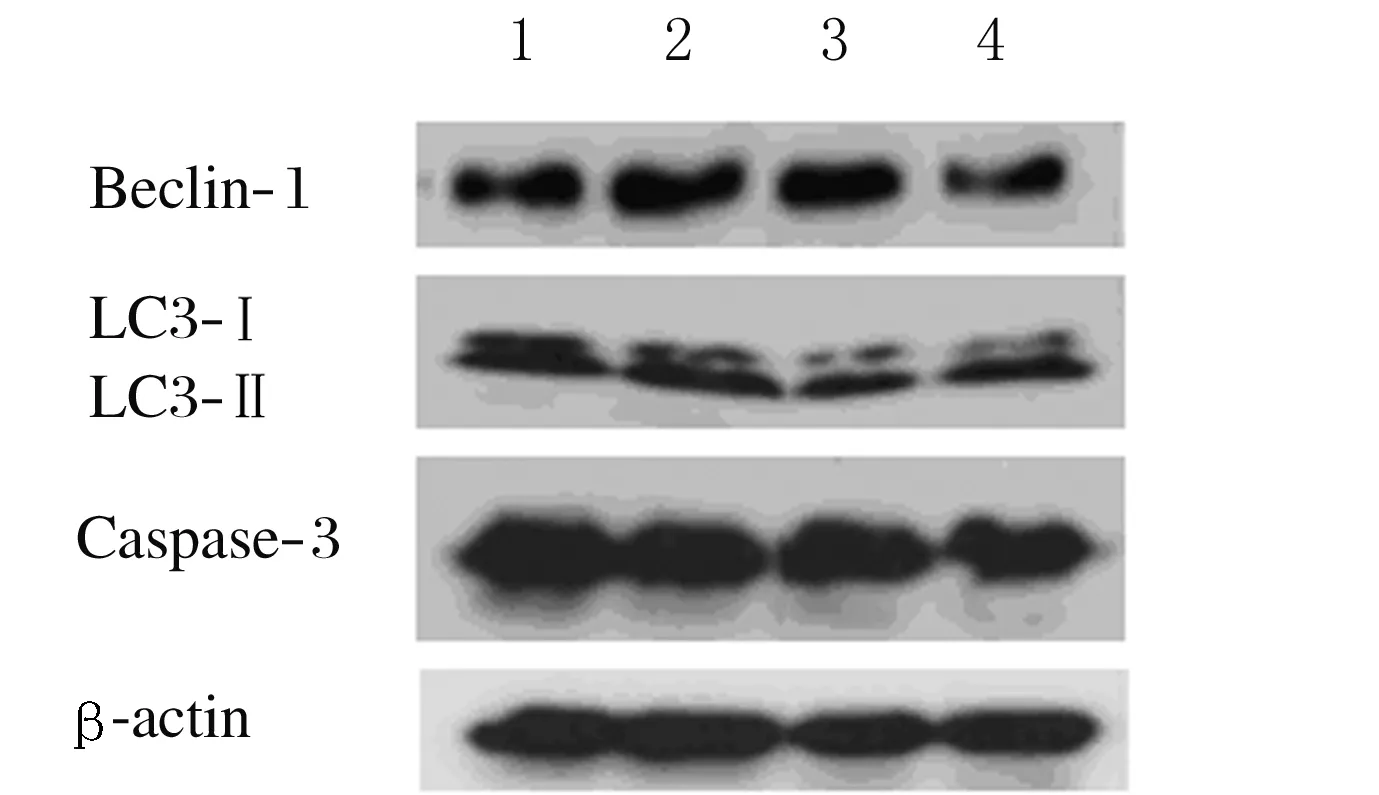
Lane 1:Blank control group;Lane 2:Starvation group;Lane 3:3-MA(10 μmol·L-1)group;Lane 4:3-MA(10 μmol·L-1)combined with starvation group.
图4 各组Ana-1细胞中LC3-Ⅱ、 LC3-Ⅰ、Beclin-1和Caspase-3蛋白电泳图
Fig.4 Electrophoregram of LC3-Ⅱ,LC3-Ⅰ, Beclin-1 and Caspase-3 proteins in Ana-1 cells in various groups
表3 各组Ana-1细胞中LC3-Ⅱ/ LC3-Ⅰ比值和Beclin-1蛋白表达水平及Caspase-3蛋白水平
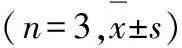
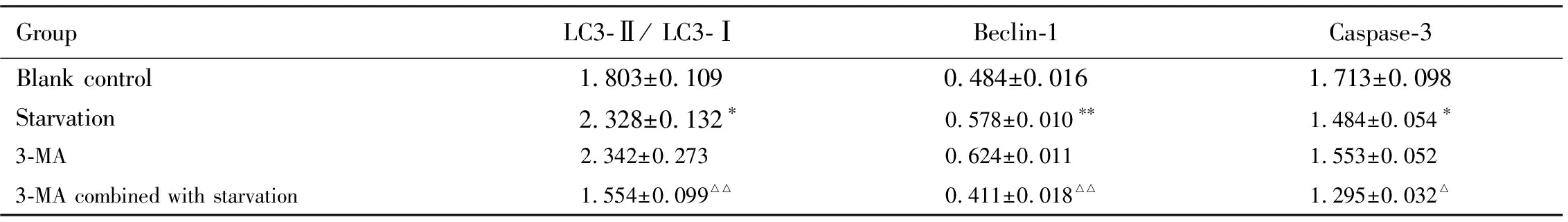
GroupLC3-Ⅱ/ LC3-ⅠBeclin-1Caspase-3Blank control1.803±0.1090.484±0.0161.713±0.098Starvation2.328±0.132∗0.578±0.010∗∗1.484±0.054∗3-MA2.342±0.2730.624±0.0111.553±0.0523-MA combined with starvation1.554±0.099△△0.411±0.018△△1.295±0.032△
*P<0.05,**P<0.01 compared with blank control group;△P<0.05,△△P<0.01 compared with starvation group.
免疫系统的免疫防御、监视和自稳功能是维持机体内环境稳定及生理平衡的重要保障,自噬是生物进化过程中保留下来的高度保守的自我保护机制,Beclin-1基因是第一个被确认的哺乳动物自噬基因,对自噬体的形成至关重要[8]。目前关于免疫细胞自噬的研究较少,因此本研究致力探讨饥饿对小鼠巨噬细胞Ana-1自噬和凋亡的影响,分析自噬关键蛋白Beclin-1在此过程中发挥的作用。
1998年Liang等[9-10]在致死性Sinbis病毒性脑炎的大鼠体内发现了Beclin-1基因,Beclin-1是酵母自噬相关基因Atg6/Vps30的哺乳动物同源基因,位于人染色体17q21位点,主要通过参与组成Ⅲ型磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3KⅢ)复合体募集胞浆中其他自噬相关蛋白,形成蛋白复合体,促进自噬体膜的发生[11-12]。本研究结果显示:在体外,饥饿可以有效地促进Ana-1细胞自噬,随着饥饿时间的延长,LC3-Ⅱ/ LC3-Ⅰ比值升高,与饥饿促进成骨细胞MC3T3-E1自噬的研究[13]结果相似;Beclin-1的表达水平也随着饥饿时间的延长而增加,推测Beclin-1可能参与了饥饿诱导的Ana-1细胞自噬。为研究饥饿诱导的自噬与Beclin-1的关系,本研究采用细胞自噬抑制剂3-MA抑制自噬,结果显示:LC3-Ⅱ/ LC3-Ⅰ比值和Beclin-1蛋白表达水平明显降低,表明饥饿诱导的Ana-1细胞自噬是以Beclin-1依赖的方式进行的,这与3-MA抑制Beclin-1而抑制自噬体的形成[14]相一致。
本研究结果还显示:在体外,饥饿可以诱导Ana-1细胞发生凋亡,饥饿处理后,镜下可见细胞开始皱缩、出现碎片,这种变化随着饥饿时间的延长而加重,另外,Caspase-3水平也明显降低,推断饥饿诱导了Ana-1细胞凋亡的发生,与饥饿下调Bcl-2/Bax从而诱导舌鳞状细胞癌细胞Tca8113凋亡[15]的研究一致。大量研究[16-18]结果显示:Beclin-1与自噬和凋亡的调节均有关联,凋亡抑制因子Bcl-2通过与Beclin-1相互作用抑制蛋白复合物的形成,从而阻止饥饿介导的Beclin-1依赖的细胞自噬的发生。为研究饥饿诱导的Ana-1细胞凋亡与Beclin-1的关系,本研究采用3-MA处理细胞,结果显示:3-MA对饥饿诱导的Caspase-3蛋白降解无抑制作用,反而有促进作用,与Beclin-1的变化不一致,表明饥饿诱导的Ana-1细胞Caspase-3蛋白降解并不依赖于Beclin-1。本研究结果与饥饿状态下3-MA间接促进心肌细胞凋亡[19]和3-MA可增强CPT对HeLa细胞凋亡的敏感性[20]等研究一致。Wirawan等[21]发现:Beclin-1是Caspase的一种底物,Caspase蛋白酶可剪切Beclin-1,形成N端和C端2个主要片段,剪切后的Beclin-1失去自噬启动作用,同时C端片段可以促进线粒体释放促凋亡基因。自噬和凋亡之间存在着错综复杂的关系,如毛地黄黄酮可通过促进巨噬细胞自噬来减弱凋亡[22]。
综上所述,饥饿可诱导Ana-1细胞发生Beclin-1依赖的自噬并引起细胞凋亡,本研究结果为外界压力刺激下免疫细胞通过对自噬和凋亡相互调控的研究提供了参考,但其具体机制还有待进一步实验证明。
