5 339例感染者丙型肝炎病毒基因型特征分析
2018-07-26陈俊梅张桂玉赵文敏董培玲娄金丽丁惠国
陈俊梅, 张桂玉, 王 征, 赵文敏, 董培玲, 娄金丽, 丁惠国
首都医科大学附属北京佑安医院肝病消化中心,北京 100069
在第69届世界卫生大会上,194个成员国达成一项历史性承诺:到2030年消灭病毒性肝炎,包括丙型病毒性肝炎(hepatitis C virus,HCV)[1]。尽管2014年开始,临床上获批了多种直接抗丙型肝炎病毒药物(direct-acting antiviral agents,DAAs),方案均具有良好的有效性及耐受性[2-3],但由于HCV所致疾病起病隐匿,病情进展缓慢且多无症状,多数感染者不能在早期及时诊断和有效治疗;同时由于人口流动性增加及感染途径的变化,尤其北京这种国际化大都市,HCV基因型的分布也发生了变化。北京佑安医院收治的病例具有极大的代表性,现总结汇报我院近3年收治的丙肝患者的HCV基因型和临床特征,旨在为丙肝的预防和治疗提供依据。
1 资料与方法
1.1一般资料收集 2015年5月至2017年11月在北京佑安医院就诊的门诊和住院患者,HCV RNA检查28 389例次,HCV RNA基因型筛查10 980例次,通过对病历号及身份证号识别排除重复病例,明确HCV感染及HCV RNA基因型者共计5 339例患者,入选病例均符合 2015年中华医学会肝病学分会、中华医学会感染病学分会制订的诊断标准[2]。绝大多数患者接受了病毒性肝炎标志物、血象、血液生化、甲胎蛋白、腹部B超等检查,少数患者仅在我院检查HCV RNA和基因型。
1.2检测方法及主要仪器、试剂
1.2.1 HCV基因型和HCV-Ab的检测方法及主要仪器、试剂:标本处理方法:患者清晨采集空腹静脉血3.5 ml,在收集后 2 h内,室温下1 600×g离心5 min,离心分离血清,如不能当日检查,-20 ℃保存备检。
HCV RNA 提取和扩增:取上述备检血清 200 μl,采用柱式提取法在 QIA cube 核酸提取仪上进行HCV RNA提取,采用实时荧光定量逆转录PCR(FQ-RT-PCR)技术,在Mx3000p PCR荧光定量扩增仪上扩增HCV RNA,泰普公司试剂盒,操作由专职实验室技术员严格按照说明书操作,每次实验中均设置阴性、临界阳性、强阳性对照和低值、高值质控。
HCV-Ab 检测:采用电化学微粒子发光法检测,罗氏有限公司(anti-HCV)试剂盒,罗氏E601全自动免疫分析仪,专职实验室技术员严格按照说明书操作,每次实验中均设置低值和高值质控。
1.2.2 HCV RNA的检测方法及主要仪器、试剂:标本处理方法:患者清晨采集空腹静脉血6 ml,EDTA抗凝,在收集后,室温下1 600×g离心 6 min,分离血清,如不能当日检查,-20 ℃保存备检。
HCV RNA 提取和扩增:取上述备检血清 800 μl,在罗氏核酸提取仪上提取RNA;采用FQ-RT-PCR技术,在Taqman48荧光定量扩增仪上扩增HCV RNA,罗氏公司试剂盒,操作由实验室专职技术员严格按照说明书操作,每次实验中均设置阴性、临界阳性、强阳性对照和低值、高值质控。

2 结果
2.1HCV感染者基因型的分布2015年5月至2017年11月北京佑安医院丙肝就诊者共5 339例感染者检测到HCV基因型,共有5种亚型:1b、2a、3a、3b、6a,不同亚型的分布如表1所示。2016年有一个患者高峰,这是由于河北某地单采浆献血感染HCV者近2 000例集中来我院诊治的结果,这组人群以1b和2a为主要感染类型,未检测到3型和6型感染者,造成2016年HCV 3型和6型感染者比例为4.2%(129/3 040),低于2015年的9.1%(101/1 108)和2017年的9.2%(110/1 191)。
2.2不同基因型患者的年龄分布及感染途径不同基因型患者的年龄分布如表2所示。1b型中,30~60岁组发生率低于<30岁组和>60岁组,差异有统计学意义(P<0.05);2a型中,各年龄组差异无统计学意义(P>0.05);3型和6型中,30~60岁组发生率高于其他两组,差异有统计学意义(P<0.05)。在1b和2a型中,42.5%(2 126例)有单采浆献血史,27.4%(1 368例)有明确接受输血史,1.0%(52例)有静脉药瘾史,29.1%(1 453例)不能明确感染途径。在3a、3b和6a型感染者中,70.6%(240/340)为男性,75.3%(256/340)有静脉药瘾史,12.1%(41/340)有输血史。在本组感染者中有12例艾滋病(AIDS)患者,6例是1b型,6例是2a型。
表15339例HCV感染者的基因型分布

Tab 1 HCV genotype distribution of 5 339 individuals 比例/%
表2不同基因型患者的年龄分布

Tab 2 Different HCV genotypes in different age groups 比例%
2.3不同基因型患者的临床特征在HCV感染者中,按照临床表现分为慢性肝炎、肝硬化、肝癌等三组,在“肝癌等”组中,包括原发性肝癌52例,AIDS 12例,淋巴瘤3例,结肠癌2例,卵巢癌2例,骨髓瘤1例,鼻咽癌1例,前列腺癌1例;在明确HCV RNA基因型的感染者中,有808例仅在我院检查HCV-Ab、HCV RNA和基因型,其他临床资料不足,不能明确其临床诊断分期,但患者数量在各基因型中仅次于慢性肝炎患者,这组感染者有可能去其他医院接受治疗,但也有可能未接受治疗而成为持续带毒者。方差分析结果显示:不同基因型组间年龄分布差异有统计学意义(P<0.001);成对比较结果显示:1b型与2a型两组比较,差异无统计学意义(P>0.05),3a型、3b型、6a型三组两两比较,差异无统计学意义(P>0.05),1b型和2a型分别与3a型、3b型、6a型比较,差异有显著统计学意义(P<0.001)。χ2检验结果显示,不同基因型组性别分布比较,差异有统计学意义(P<0.001);成对比较显示,1b型分别与2a型、3a型、3b型、6a型比较,差异有统计学意义(P<0.05);2a型分别与3a型、3b型、6a型比较,差异有统计学意义(P<0.05);3a、3b、6a型三组两两比较,差异无统计学意义(P>0.05)。F检验结果显示,慢性肝炎、肝硬化、肝癌等三组的基因型相比,差异无统计学意义(P=0.36)(见表3)。
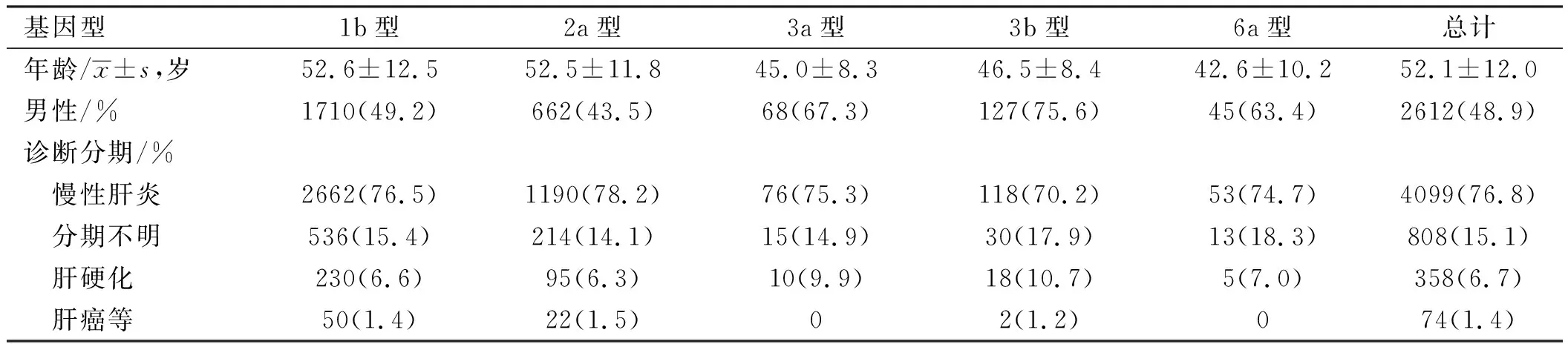
表3 不同基因型患者的临床特征Tab 3 The clinical manifestations of different HCV genotype individuals
3 讨论
HCV为单股正链RNA病毒,基因组具有显著异源性和高度可变性。由于HCV的传染源、人员流动性、传播途径及人群遗传背景不同,HCV的基因型分布呈明显的地域性。GOWER等[4-5]对PubMed和EMBASE数据库中关于HCV基因型流行情况的4 901项研究进行分析:HCV 3型呈全球性流行,HCV 1a型流行于欧洲、澳洲、南美洲和北美洲;HCV 1b型则常见于欧洲、北美洲及亚洲部分地区;HCV 2型也广泛分布于欧美等发达国家,但较1型少见;HCV 4型在北非最为常见。
分析我院2015年5月至2017年11月收治的HCV感染者的基因型分布情况,在5 339例患者中,1b、2a、3b、3a、6a型占比依次为65.1%、28.5%、1.9%、3.2%、1.3%,可见1b和2a型仍是以北京为代表的华北地区的主要感染类型,3型和6型总计占比为6.4%。这个基因型分布结果类似于2015年我国丙肝指南采用的资料[6],我国较常见的基因型为1b和2a型,其中1b型为主(56.8%),次之2型(24.1%)和3型(9.1%),6型相对较少(6.3%);但中国地域宽广,不同地区基因型分布差异较大。苏迎盈等[7]分析1994-2013年报道我国HCV基因型流行分布的140篇文献,发现北方基因型分布比南方少,东北地区有3种亚型流行,1b、2a及1b/2a混合型;西北、华北、华中以1b型为主,次之2a型,但存在3a、3b及6a型的分布;西南地区除5型外,均有发现,1b型最多,次之为3b型和3a型;华南地区6种亚型均有流行,1b型最多,次之6a型,2b型为第三位。而近期报道[8]川滇黔三地的资料显示,在216例感染者中,前三位是1b、3b、6a型,分别为36.1%、27.8%和17.1%,并发现少见的4a/6n型4例。随着人类社会活动范围的扩大,世界范围内人口流动增加,国境口岸海关筛查获得115例HCV基因型,1~6型分别为62.6%(72例)、9.6%(11例)、18.3%(21例)、6.1%(7例)、0.9%(1例)、2.6%(3例),其中1例HCV 4型患者来自德国,与既往中国报道的欧洲来华旅游者的基因具有同源性,据报道,HCV 4型尤其是4a型和4d型,通过静脉吸毒网络在欧洲传播很快,改变了欧洲的基因型分布,而非静脉吸毒者HCV 4型感染主要来源于中东和非洲移民[9]。我们要警惕入境HCV感染者可能作为传染源将HCV新亚型传入中国。
总体来看,该组患者丙肝感染率男女无差异,同2011年的流行病学调查[10]结果一致,但是对于3型和6型感染者,男性占70.6%,明显超过女性,这与静脉药瘾的感染途径有关。在本组资料中,340例3a、3b和6a型感染者中75.3%有静脉药瘾史, 94.1%感染者年龄集中在30~60岁。粤东地区静脉吸毒感染者基因型中57%(12/21)为6a型,3a和1b型均占19%,而输血感染者80%(52/65)为1b型[11];上海39例静脉吸毒HCV感染者中,3a、3b、1b、6型分别为35.9%、33.3%、17.9%、12.8%,3型占绝对优势(69.2%)[12]。这提示在静脉药瘾人群中,3型和6型占比较大,HCV 6型作为近年来主要入侵型,改变了中国南部及西南地区的基因型分布[13]。
该组5 339例患者就诊时,76.8%(4 099例)为慢性肝炎患者,6.7%为肝硬化,1.4%为肝癌等严重疾病;这意味着80%以上的感染者在被发现时是极轻微或无明显自觉症状的,但他们均具有传染性。丙肝呈全球性流行,不同性别、年龄、种族人群均对HCV易感,且无疫苗可防,正是因为其感染的隐匿性,多数感染者并不知道自己已经感染HCV,2011年流行病学调查[10]发现,抗HCV阳性率随年龄增长而逐渐上升,1~4岁组为0.09%,5~59岁组升至0.77%。患者主要感染途径是经血液传播,包括输血和血制品、单采浆献血。2015年始,我国对抗HCV阴性献血员筛查HCV RNA,基本杜绝了HCV经输血和血制品的传播,在本组就诊的人群中,66.2%(3 535/5 339)既往(尤其是20余年前)有接受输血或单采浆献血史;同时,静脉吸毒是中年男性患者的另一个重要传染途径。所以要完成在2030年消灭丙肝的目标,需大力宣传,鼓励有受血史、静脉吸毒史或其他危险行为者主动筛查HCV,最好能纳入到国家计划中,譬如婚检。
肝硬化和肝癌是慢性HCV感染的主要死因,HCV感染进展多缓慢,但一旦发展至肝硬化,肝癌的年发生率为2%~4%[3 ],HCV 1b型的患者肝癌的发生率高于其他基因型,1b型发生率为1 692 /10 000人年vs基因2a型 809/10 000人年[14]。文献[15-16]报道,促进疾病进展的因素包括感染HCV时年龄>40岁、男性、嗜酒(50 g以上)、合并感染HIV并导致免疫功能低下;另外包括肥胖、胰岛素抵抗、合并感染HBV、非酒精性脂肪肝、肝脏高铁载量、合并血吸虫感染、肝毒性药物和环境污染、遗传因素等。全球疾病负担研究报告显示,肝癌成为全球癌症死亡排名第二位的原因,仅次于肺癌;在中国,肝癌最常见的病因是HBV或HCV感染后的慢性化。2014年开始,虽然存在DAAs耐药及HCV复发的风险[17-18],全球已经有了很好的清除HCV的DAAs,使得降低丙肝相关肝硬化、肝癌的发生率成为现实,实现这一目标的关键在于提高医护人员和公众对于HCV的认知,主动筛查、主动治疗。
总之,要实现2030年消灭丙肝,降低HCV相关肝炎、肝硬化和肝癌的发生率,还有大量的实际工作要做。
