HDAC1对结直肠癌细胞凋亡及侵袭能力的影响
2018-07-26李青云司徒伟基蔡思思
李青云, 肖 鹏, 司徒伟基, 蔡思思
1.香港大学深圳医院消化内科,广东 深圳 518000; 2.中山大学附属第三医院肿瘤内科
结直肠癌是常见的消化系统肿瘤,是世界第三大恶性肿瘤,其发病率仅次于乳腺癌、肺癌,再加上其转移快、预后差,结直肠癌严重影响人类的生命健康[1]。肿瘤的发生与癌基因过度表达和抑癌基因表达缺失有关,是一个复杂的过程,随着对肿瘤发病机制研究的不断深入,基因靶向治疗肿瘤已经成为目前医学工作者研究的热点[2]。组蛋白去乙酰化酶1(histone deacetylases 1,HDAC1)编码的蛋白在组蛋白及非组蛋白的乙酰化中具有关键作用,能够调控核小体结构的改变和DNA的转录,能够调控细胞凋亡等多种生物学特性的发挥[3]。研究[4-6]显示,HDAC1在结直肠癌、肾透明癌等多种癌症中表达上调,且可以调控卵巢癌等多种癌细胞的凋亡、侵袭等过程,可能是一种癌基因。本实验用结直肠癌细胞为研究对象,通过小RNA干扰技术下调结直肠癌细胞中HDAC1的表达,以明确HDAC1对结直肠癌细胞凋亡、侵袭等的作用,为以后研究HDAC1在肿瘤中的作用提供依据。
1 材料与方法
1.1材料结直肠癌细胞Caco2购自上海JINDU公司;Lipofectamine 2000购自美国Invitrogen;HDAC1 siRNA和siRNA control购自上海Seebio;荧光定量PCR试剂盒购自大连TAKARA公司;HDAC1多克隆抗体购自英国Abcam公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自美国Pierce公司;基质金属蛋白酶-9(matrix metalloprotease 9,MMP-9)多克隆抗体、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)多克隆抗体购自美国Cell signaling公司;Cleaved caspase-3多克隆抗体、基质金属蛋白酶-2(matrix metalloprotease 2,MMP-2)多克隆抗体购自美国Santa Cruz公司。
1.2细胞转染及分组Caco2细胞生长密度约为70%时进行细胞转染,在转染前1 h用不含血清的细胞培养液孵育,用Lipofectamine 2000将HDAC1 siRNA和siRNA control转染至细胞中,步骤参照试剂盒说明书,将转染HDAC1 siRNA和siRNA control后的细胞命名为HDAC1 siRNA和siRNA-NC,以不做转染的细胞命名为Control。在细胞转染后24 h,qRT-PCR和Western blotting检测细胞中的HDAC1表达水平。
1.3qRT-PCR检测HDAC1mRNA表达Control、siRNA-NC、HDAC1 siRNA细胞在培养24 h后,根据RNA提取试剂盒提取细胞中的RNA,RNA保存在-70 ℃条件下。用分光光度计测定所提取的各组细胞中的RNA的浓度。反转录合成cDNA,再进行荧光定量PCR。HDAC1引物上游序列:5′-AACTGGGGACCTACGG-3′,下游序列:5′-ACTTGGCGTGTCCTT-3′。GAPDH上游序列:5′-CGGAGTCAACGGATTTGGTCGTAT-3′,下游序列:5′-AGCCTTCTCCATGGTGGTGAAGAC-3′。
1.4Westernblotting检测HDAC1蛋白表达Control、siRNA-NC、HDAC1 siRNA细胞培养24 h后,把培养液弃去,添加细胞裂解液,把培养板放在冰上,30 min后,用移液枪反复吹打细胞,将裂解液转移到离心管中,在低温离心机中,12 000×g离心5 min。取离心之后的上清,-20 ℃保存。用BCA法检测蛋白浓度。把蛋白与上样缓冲液混合后,100 ℃煮沸5 min。每孔40 μg蛋白样品,60 V电压电泳,观察溴酚蓝到达凝胶的边缘以后停止电泳。转膜:60 V转膜2 h。孵育抗体:把膜放在质量浓度为50 g/L的脱脂奶粉中反应1 h,TBST洗膜2次以后,再把膜放在1∶800稀释的一抗中室温孵育2 h后,TBST洗膜2次,把膜放在1∶2 000稀释的二抗中室温孵育2 h,TBST洗膜2次。ECL发光以后,凝胶图像分析仪测定条带的光密度值,以GAPDH为内参,分析目的蛋白的水平。
1.5流式细胞术检测细胞凋亡Control、siRNA-NC、HDAC1 siRNA细胞培养24 h,用胰蛋白酶消化后,加入PBS洗涤2次细胞后,在室温条件下800×g离心5 min,把上清吸除以后,在细胞中添加100 μl的缓冲液,再加入5 μl的碘化丙啶(propidium iodide,PI)和膜联蛋白V-FITC(Annexin V-FITC),混合后,再添加400 μl的缓冲液,在1 h内用流式细胞仪检测细胞凋亡。
1.6Transwell小室测定细胞侵袭和迁移Transwell在侵袭实验前用基质胶湿化30 min,Control、siRNA-NC、HDAC1 siRNA细胞用不含血清的培养液悬浮后,在小室的上室中添加300 μl的细胞悬浮液,在下室中添加600 μl的含有胎牛血清的培养液,在37 ℃孵育24 h以后,将膜上没有侵袭的细胞擦掉以后,用质量浓度为950 g/L的甲醇固定20 min后,用质量浓度为2.5 g/L的结晶紫在室温中染色30 min。观察计数细胞数目,实验重复3次,取均值。用Transwell小室检测细胞迁移,迁移实验不用基质胶湿化,其他步骤同侵袭实验。
1.7Westernblotting法测定细胞中MMP-2、MMP-9、Bax、Cleavedcaspase-3蛋白水平Control、siRNA-NC、HDAC1 siRNA细胞培养24 h以后,Western blotting方法测定MMP-2、MMP-9、Bax、Cleaved caspase-3在各组细胞中的表达水平,步骤同上。

2 结果
2.1转染后细胞中HDAC1的表达HDAC1 siRNA细胞中HDAC1 mRNA和蛋白水平均明显低于Control,差异有统计学意义(P<0.05)。siRNA-NC细胞中HDAC1 mRNA和蛋白水平与Control相比,差异无统计学意义(P>0.05)。HDAC1 siRNA可以降低结直肠癌细胞中HDAC1的转录和表达(见图1、表1)。
2.2下调HDAC1诱导结直肠癌细胞凋亡HDAC1 siRNA细胞凋亡率明显高于Control,差异有统计学意义(P<0.05)。siRNA-NC细胞凋亡率与Control相比,差异无统计学意义(P>0.05)。下调表达可以促进结直肠癌细胞凋亡(见图2、表2)。
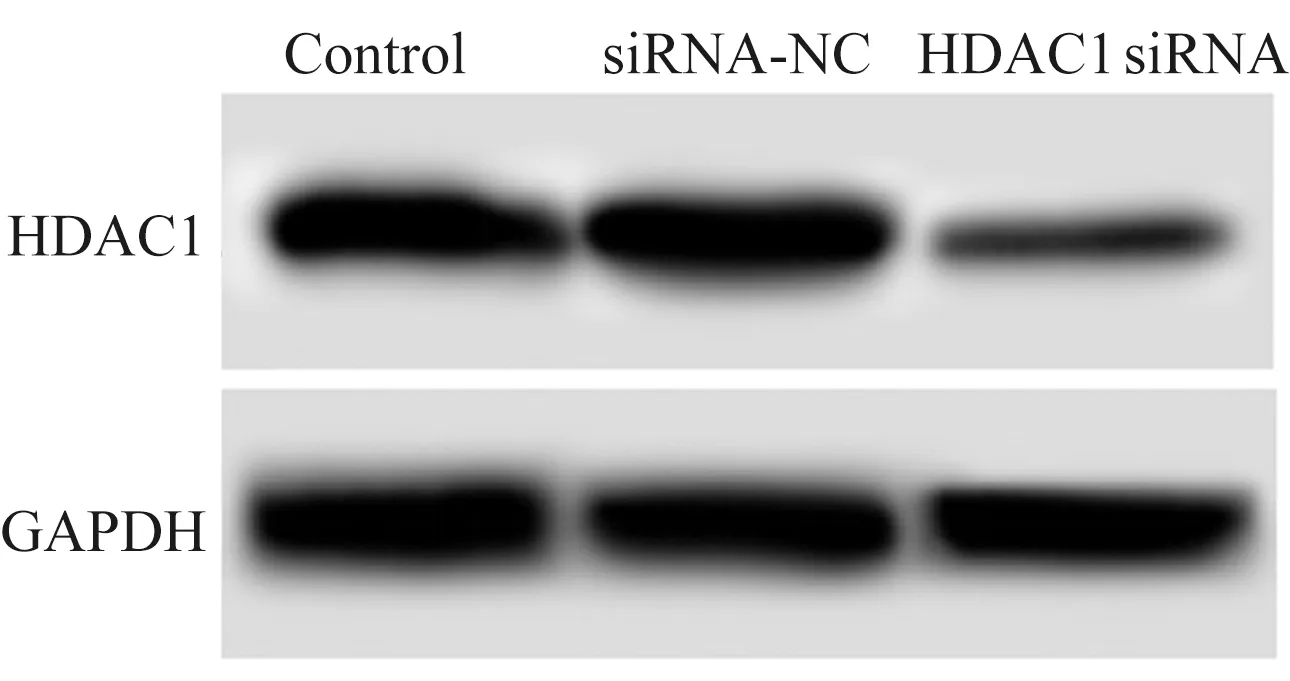
图1 Western blotting测定HDAC1蛋白在转染后细胞中的表达Fig 1 The expression of HDAC1 protein in transfected cells detected by Western blotting
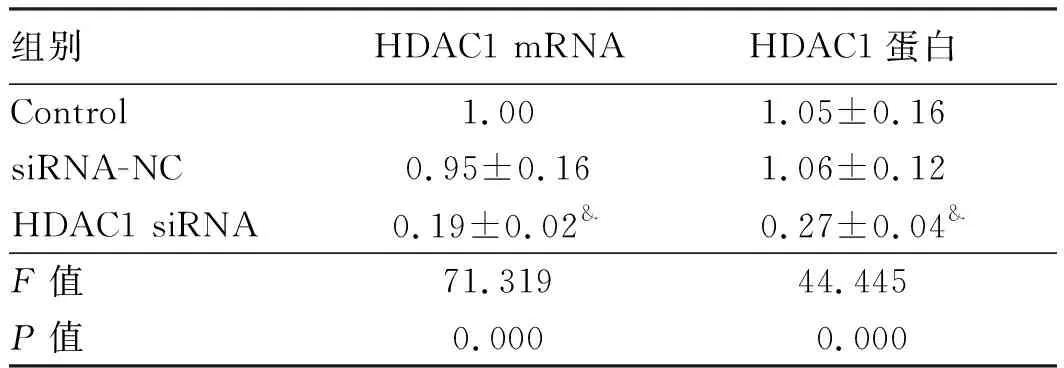
组别HDAC1 mRNAHDAC1蛋白Control1.001.05±0.16siRNA-NC0.95±0.161.06±0.12HDAC1 siRNA0.19±0.02&0.27±0.04&F值71.31944.445P值0.0000.000
注:与Control比较,&P<0.05。
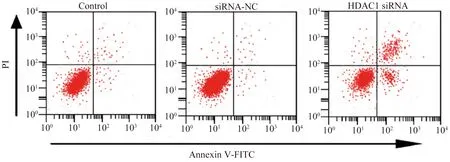
图2 流式细胞术测定HDAC1表达下调对结直肠癌细胞凋亡的影响Fig 2 Flow cytometry to determine the effect of down-regulation of HDAC1 expression on the apoptosis of colorectal cancer cells
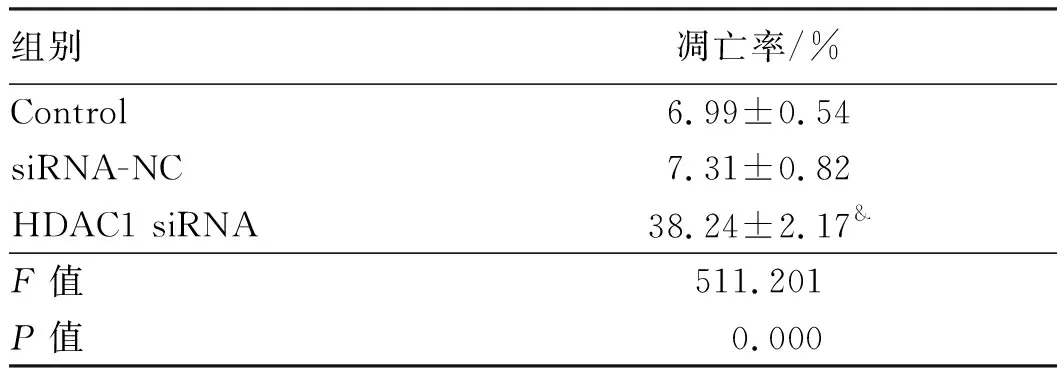
组别凋亡率/%Control6.99±0.54siRNA-NC7.31±0.82HDAC1 siRNA38.24±2.17&F值511.201P值0.000
注:与Control比较,&P<0.05。
2.3下调HDAC1降低结直肠癌细胞侵袭和迁移能力HDAC1 siRNA细胞迁移和侵袭数目明显低于Control,差异有统计学意义(P<0.05)。siRNA-NC细胞迁移和侵袭数目与Control相比,差异无统计学意义(P>0.05)。下调HDAC1表达可以降低结直肠癌细胞迁移和侵袭能力(见表3)。
表3 各组细胞迁移和侵袭数目Tab 3 The number of cell migration and invasion in each
注:与Control比较,&P<0.05。
2.4下调HDAC1对结直肠癌细胞中MMP-2、MMP-9、Bax、Cleavedcaspase-3蛋白水平影响HDAC1 siRNA细胞中MMP-2、MMP-9水平明显低于Control,Bax、Cleaved caspase-3水平明显高于Control,差异有统计学意义(P<0.05)。siRNA-NC细胞MMP-2、MMP-9、Bax、Cleaved caspase-3水平与Control相比,差异无统计学意义(P>0.05)。下调HDAC1表达可以降低结直肠癌细胞中MMP-2、MMP-9的表达,促进Bax、Cleaved caspase-3的表达(见图3、表3)。
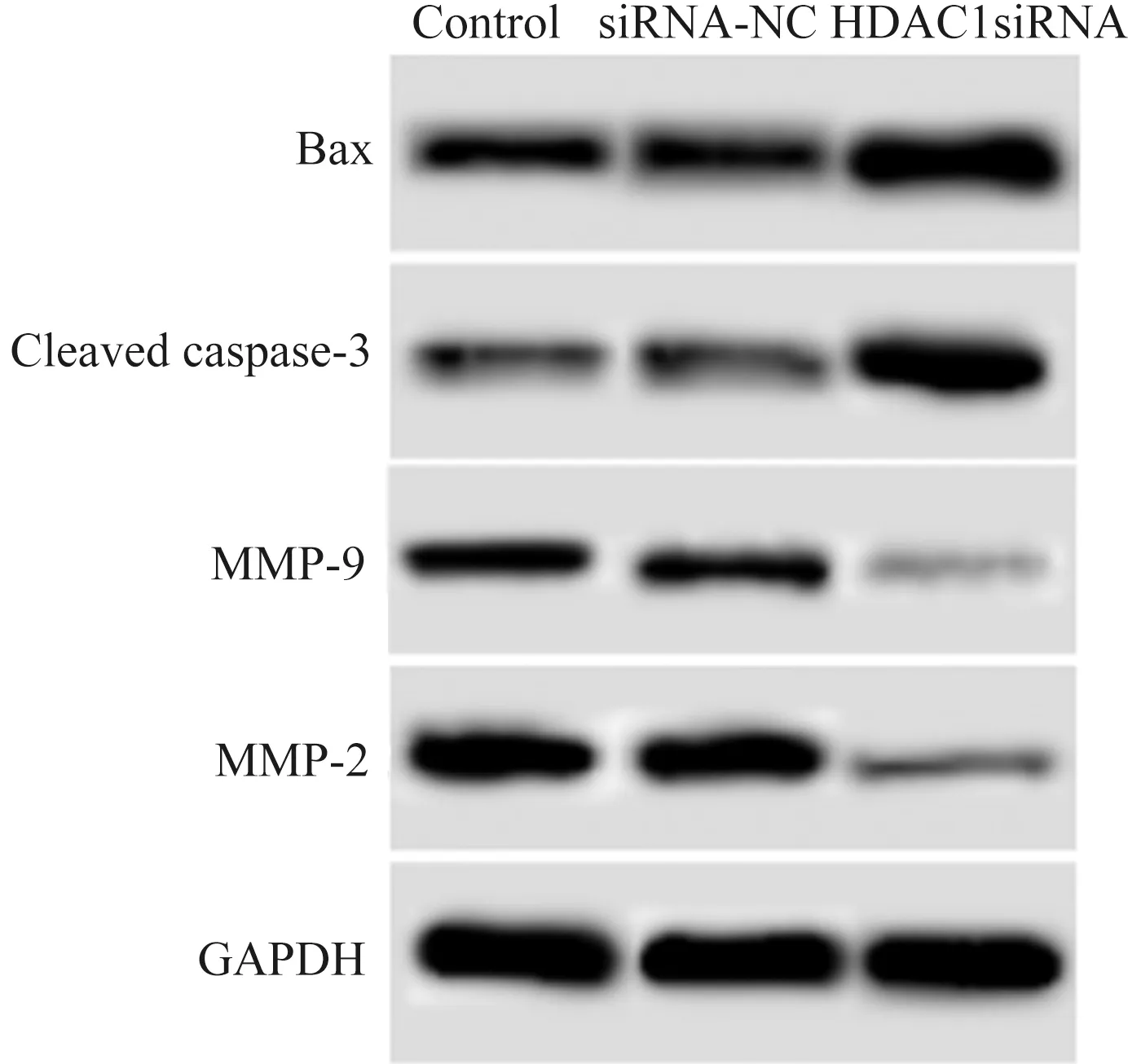
图3 Western blotting法测定HDAC1表达下调后细胞中MMP-2、MMP-9、Bax、Cleaved caspase-3蛋白水平Fig 3 Determination of MMP-2, MMP-9, Bax and Cleaved caspase-3 protein levels in cells after down-regulation of HDAC1 expression by Western blotting
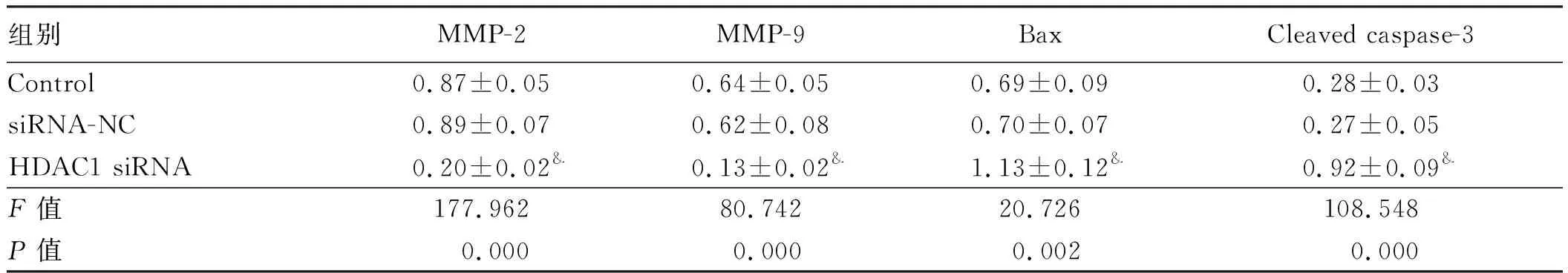
组别MMP-2MMP-9BaxCleaved caspase-3Control0.87±0.050.64±0.050.69±0.090.28±0.03siRNA-NC0.89±0.070.62±0.080.70±0.070.27±0.05HDAC1 siRNA0.20±0.02&0.13±0.02&1.13±0.12&0.92±0.09&F值177.96280.74220.726108.548P值0.0000.0000.0020.000
注:与Control比较,&P<0.05。
3 讨论
HDACs蛋白家族含有多个成员,在哺乳动物中已经发现有18种HDACs,其中HDAC1在人类的多种组织和细胞中均有表达,能够增加肿瘤细胞的增殖活性,且能够促进肿瘤细胞迁移和侵袭[7]。在胰腺癌组织中发现,HDAC1的表达水平远远高于胰腺癌旁组织,后续在肺癌、前列腺癌、宫颈癌等中也发现HDAC1的高表达[8-11]。GLASER等[12]通过小RNA干扰技术下调多种HDACs的表达后,结果发现,HDAC1在肿瘤细胞生长、凋亡等过程中必不可少。降低卵巢癌细胞中HDAC1的表达后,卵巢癌细胞侵袭和迁移能力下降[6]。研究[4]显示,HDAC1在结直肠癌中表达升高。本实验结果显示,HDAC1表达下调后的结直肠癌细胞凋亡增加,细胞侵袭和迁移能力下降,HDAC1在结直肠癌中发挥癌基因的作用。
恶性肿瘤易转移,而癌细胞的侵袭和迁移是恶性肿瘤转移的重要原因。细胞外基质是肿瘤细胞侵袭和迁移的屏障,在肿瘤向邻近部位转移的过程中,肿瘤细胞可以产生能够分解细胞外基质的蛋白酶,为肿瘤细胞的转移提供条件[13-15]。基质金属蛋白酶是肿瘤侵袭和迁移的重要蛋白酶,其激活可以降解几乎所有的细胞外基质成分,MMP-2和MMP-9主要降解V、Ⅳ型胶原酶,是目前研究的与肿瘤转移关系最为密切的基质金属蛋白酶[16]。MMP-2和MMP-9在结直肠癌组织中表达上调,而下调MMP-2和MMP-9水平均可以降低肿瘤细胞的侵袭和迁移能力[17]。本实验结果表明,HDAC1表达下调后的结直肠癌细胞中MMP-2、MMP-9表达水平均明显降低,提示HDAC1可以通过影响MMP-2、MMP-9的表达调控结直肠癌细胞的迁移和侵袭能力。
细胞凋亡在维持细胞内环境稳定中具有重要作用,是由基因调控所引发的自然死亡,与细胞内的多种调控因子有关,死亡受体途径和线粒体途径是细胞凋亡发生的经典途径,与细胞内的Caspase级联反应和Bcl-2蛋白家族有关[18]。Caspase-3位于Caspase级联反应的下游,属于效应因子,其通过酶原的形式存在于细胞内,其在激活时被剪切形成活化形式的Cleaved caspase-3,发挥凋亡促进的作用[19]。Bcl-2蛋白家族与Caspase级联反应相互结合,共同调控细胞凋亡的发生,Bax是Bcl-2蛋白家族中的促凋亡蛋白,其在肿瘤组织中表达下调[20]。本实验表明,下调HDAC1后的结直肠癌细胞中Bax表达水平升高,细胞中Cleaved caspase-3水平也升高,说明HDAC1表达下调可以通过促进Bax表达和Caspase-3活化诱导结直肠癌细胞凋亡。
以上表明,HDAC1表达下调诱导结直肠癌细胞凋亡,降低结直肠细胞的侵袭和迁移能力,促进结直肠癌细胞中Caspase-3的活化,降低细胞中MMP-2和MMP-9表达,HDAC1在结直肠癌中发挥癌基因的作用。本研究为探讨HDAC1在结直肠癌中的作用提供了理论基础,为临床上靶向HDAC1治疗结直肠癌提供了理论参考。结直肠癌的发病机制较为复杂,在后续实验中会在多株结直肠癌细胞中进行验证,对于其具体的作用机制仍需要在后续实验中探讨。
