脐带、脂肪源性间充质干细胞改善肝硬化大鼠的效果比较
2018-07-26高琳琳王静敏张艳鹤杨继康
高琳琳, 王静敏, 张艳鹤, 杨继康
焦作市人民医院消化内科,河南 焦作 454002
肝硬化是由多种病因引起的肝脏终末状态[1],研究[2-3]显示,干细胞为肝硬化治疗带来新的希望。脐带间充质干细胞(umbilical cord mesenchymal stem cells,UC-MSCs)、脂肪源性间充质干细胞(adipose-derived mesenchymal stem cells,ADSCs)是不同来源的间充质干细胞,研究[4-5]表明,两者在抑制肝星状细胞(hepatic stellate cells, HSC)活性方面均有作用。本实验探讨两种干细胞在肝硬化治疗方面有无差异。
1 材料与方法
1.1材料和试剂SD大鼠40只,6周龄,体质量220~260 g,购自郑州大学动物实验室;胎牛血清购自杭州四季青公司;Ⅳ型胶原酶购自Sigma公司;Livin、Smac兔多克隆抗体购自美国SANTA CRUZ公司;SP9000试剂盒购自北京中杉生物工程公司。
1.2细胞的分离与培养
1.2.1 UC-MSCs的分离培养:正常足月分娩的脐带,PBS洗涤后剪小段,去除外膜、血管,剪碎后置于培养瓶中,加入质量浓度为100 g/L的胎牛血清的培养基,置于体积分数为5%的CO2培养箱中培养。每3 d换液1次。细胞至80%汇合融合时,用质量浓度为2.5 g/L的胰酶消化,以1∶3的比例传代培养。
1.2.2 ADSCs的分离培养:取大鼠脂肪组织约2 mg剪碎,加含1 mg/ml胶原酶的分离液,振荡消化1 h,离心5 min后,将沉积的细胞加入质量浓度为100 g/L的胎牛血清的培养基,再次离心后,沉积的细胞加入培养基中,置于体积分数为5%的CO2培养箱中培养。24 h后换液,每3 d换液1次。细胞达80%融合时传代。
1.3建模及干细胞移植选取SD大鼠35只,将质量浓度为500 g/L的CCl4大豆油溶液,首次剂量按5 ml/kg行腹腔注射,之后按3 ml/kg腹腔注射,2次/周,共8周。随机处死5只大鼠,肝脏组织切片看到假小叶形成,证实造模成功。依据实验设计,将30只大鼠分为3组:UC-MSCs组10只,ADSCs组10只,对照组10只。干细胞移植:2 ml的细胞悬液(细胞数为5×106)分别缓慢注入UC-MSCs组和ADSCs组大鼠的尾静脉中,每2周1次,等量生理盐水同样方法注入对照组。治疗4周结束,取所有大鼠肝组织石蜡包埋。
1.4肝功能检测治疗前取大鼠尾静脉血1.5~2 ml,肝细胞移植4周后,取大鼠左心室血2 ml,用生化仪器检测肝功能丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、白蛋白(ALB)和总胆红素(TBIL)的水平。
1.5肝组织病理学检查观察肝脏大体标本。标本用质量浓度为100 g/L的甲醛固定72 h,石蜡包埋切片,常规行HE染色和Masson染色,在光学显微镜下观察标本。按Ishak评分标准修正方案[6]对肝组织炎症活动及纤维化程度进行评分。
1.6免疫组化检测α-SMA石蜡切片脱腊脱水,PBS冲洗,体积分数为3%的H2O2孵育,滴加α-SMA抗体,4 ℃过夜,滴加二抗,DAB显色,用苏木精复染,酒精脱水,中性树胶封片后观察。光镜下观察,棕黄色部位为免疫组化阳性细胞。每张切片选取4个视野,采用图像分析技术检测每个视野中阳性细胞的积分光密度值。

2 结果
2.1UC-MSCs和ADSCs的培养生长
2.1.1 UC-MSCs培养:脐带组织贴壁3 d后,大量细胞在周边长出,大部分细胞形态呈梭形,原代细胞培养15 d左右80%~90%融合,传代后,细胞增殖速度明显增快,多次传代后细胞形态均一,呈漩涡状生长(见图1)。
2.1.2 ADSCs培养:分离的细胞种植入培养皿中,48 h后有梭形和多角形细胞贴壁,3~5 d后细胞生长加快,呈梭形融合聚集,螺旋状排列,达80%融合后传代培养(见图1)。

图1 间充质干细胞(100×) A:原代UC-MSCs;B:第3代UC-MSCs;C:原代ADSCs;D:第3代ADSCsFig 1 Mesenchymal stem cells (100×) A: primary UC-MSCs; B: the third generation UC-MSCs; C: primary ADSCs; D: the third generation ADSCs
2.2肝功能指标检测细胞移植前,三组肝功能指标(AST、ALT、ALB及TBIL)相比,差异均无统计学意义(P>0.05)。治疗4周后,UC-MSCs组和ADSCs组与对照组比较,肝功能指标差异均有统计学意义(P<0.05);UC-MSCs组与ADSCs组大鼠肝功能指标相比,差异无统计学意义(P>0.05)(见表1)。
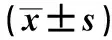
表1 移植后大鼠肝功能指标检测结果Tab 1 Results of liver function in rats after transplantation U/L
注:与对照组比较,*P<0.05。
2.3组织病理学改变及病理评分HE和Masson染色均可见,对照组大鼠肝纤维化程度,胶原纤维包绕汇管区和中央静脉区,广泛假小叶形成;UC-MSCs组和ADSCs组的肝组织内胶原纤维成细丝状,少于对照组,纤维化减轻,假小叶形成较对照组减少(见图2)。结果显示,治疗组较对照组在肝组织炎症活动度和纤维化程度评分等方面均有明显降低,差异均有统计学意义(P<0.05);UC-MSCs组与ADSCs组的肝组织评分差异无统计学意义(P>0.05)(见表2)。
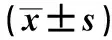
表2 大鼠肝组织标本病理评分Tab 2 Histopathological score of rat liver tissue
注:与对照组比较,*P<0.05。

图2 三组大鼠肝脏病理学改变(200×)Fig 2 Hepatic pathological changes of rats in three groups (200×)
2.4肝组织α-SMA表达肝组织中α-SMA阳性细胞呈棕黄色,多呈成片状或条索状,主要分布于肝窦周围、汇管区、纤维间隔。UC-MSCs组和ADSCs组α-SMA阳性细胞表达较对照组减少(见图3)。UC-MSCs组、ADSCs组和对照组的α-SMA表达水平分别为:125.1±21.43、121.5±6.44、156.6±23.48。UC-MSCs组、ADSCs组与对照组相比,差异有统计学意义(P<0.05);UC-MSC组与ADSCs组比较,差异无统计学意义(P>0.05)。

图3 三组大鼠肝免疫组化(200×) A:对照组;B:UC-MSCs组;C:ADSCs组Fig 3 Immunohistochemistry of liver in three groups (200×) A: control group; B: UC-MSCs group; C: ADSCs group
3 讨论
肝硬化是各种慢性肝病最常见的发展结果,严重威胁人们的健康[7]。肝移植是最有效的手段,但供体缺乏及需要终身服免疫抑制剂等,限制其临床应用[8]。间充质干细胞来源广泛,在特定条件下具有多向分化潜能,作为新治疗理念为肝硬化的治疗带来了希望[9]。UC-MSCs和ADCSs是间充质干细胞的不同来源,研究[10]证实,两种细胞与骨髓间充质干细胞有相似的细胞表型标志物及分化潜能,在体外可以稳定增殖传代,较骨髓间充质干细胞有更强的增殖能力。
HSC是肝内的非实质细胞,HSC激活后表达α-SMA,持续激活是肝脏纤维化发生、发展过程中的关键环节[11-12]。本研究分别将UC-MSCs和ADSCs注入肝硬化模型的大鼠体内,大鼠的肝功能改善,肝脏α-SMA沉积减少,肝脏炎症和纤维化程度都有所减轻。间充质干细胞治疗肝硬化的机制尚未明确,有研究[13]认为,主要有:干细胞分化为肝样细胞,再促进肝脏再生;干细胞分泌多种细胞因子,如VEGF、IL-10等, 通过调节纤维化相关基因的表达,抑制HSC的活化从而改善肝纤维化[14-15]。肝细胞样细胞具有与人类肝细胞类似的功能。有研究[16]证明,将间充质干细胞移植到肝损伤模型体内后,通过免疫组化分析显示,间充质干细胞没有取代受损伤的肝细胞,而是定居在其周边的区域。本实验证明,间充质干细胞可通过释放可溶性因子进行旁分泌行为,可能对组织的保护和修复起非常重要的作用。
综上所述,UC-MSCs和ADSCs可以改善肝纤维化程度,给晚期肝病患者带来新的选择。两种间充质干细胞的作用程度无显著性差异,临床可根据条件选择合适的细胞来源,其可能的机制及应用仍有待进一步研究。干细胞治疗虽然有很大的希望,但也有不确定性和局限性。我们需要分离和培养免疫特异性和均匀的干细胞群体,提高分化为靶细胞的效率,建立移植的最佳阶段,提高移植后定植率和再生率。
