流感病毒出芽模型与分子机制研究进展
2018-07-26包旦奇刘芹防
包旦奇,刘芹防
(中国农业科学院上海兽医研究所,上海200241)
流感是最重要的人畜共患传染病之一,持续威胁着全球公共卫生并造成严重的经济损失。根据世界卫生组织和美国疾病控制和预防中心(US Center for Disease Control and Prevention,US-CDC)的最新数据,预计每年死于季节性流感引起的呼吸道疾病的人数从十年前的250 000~500 000人增长至650 000人[1]。流感病毒属于正黏病毒科,含有8个节段的单股负链RNA基因组,编码至少11种蛋白质,是一种有囊膜包被的病毒。流感病毒的生命周期起始于病毒的血凝素(hemagglutinin,HA)与宿主细胞表面受体的特异性识别和吸附,之后病毒粒子内吞形成内吞小体并由HA介导病毒外膜与细胞膜融合,使病毒核糖核蛋白复合物(ribonucleoprotein complexes,vRNPs)释放入胞浆,然后转运至细胞核开始病毒基因组的复制和病毒成分的合成。新生成的vRNPs和病毒结构蛋白被转运至质膜表面组装成完整的病毒粒子,并以出芽的方式从宿主细胞释放。在感染末期,流感病毒的表面蛋白(HA、NA、M2)以及基质蛋白M1在细胞膜表面聚集,随后病毒内部组分被转运至出芽位点,组装为完整病毒粒子并最终完成出芽[2]。研究显示HA、NA、M2具有在体外单独表达后出芽的能力,以不同的方式在流感病毒出芽过程中起关键作用。HA蛋白在出芽位点聚集产生细胞膜的正曲率并启动病毒出芽,M2蛋白在出芽过程末期中起到膜剪切的作用,最后由NA蛋白切断HA与质膜表面唾液酸的连接使病毒粒子释放。出芽是流感病毒复制周期中十分重要的阶段,并影响着流感病毒的致病性。
1 流感病毒出芽模型
流感病毒的病毒蛋白中只有表面蛋白HA、NA和M2具有独自出芽的能力,M1蛋白和vRNPs只有通过与表面蛋白相互作用才可被携带出芽。出芽过程中,首先HA和NA定位于脂筏并聚集产生细胞膜的正曲率启动出芽,随后M1以及与其相连的vRNPs同HA和NA的胞内域相互作用,M1发生多聚化继续病毒颗粒的出芽,最后M2蛋白介导细胞膜剪切并由NA破坏与HA连接的唾液酸,使病毒粒子从细胞膜表面释放[3](图1)。因此,对于流感病毒而言,出芽并不是独奏表演,而是每种成分在不同空间和时间下经过精心策划演奏出的交响乐。
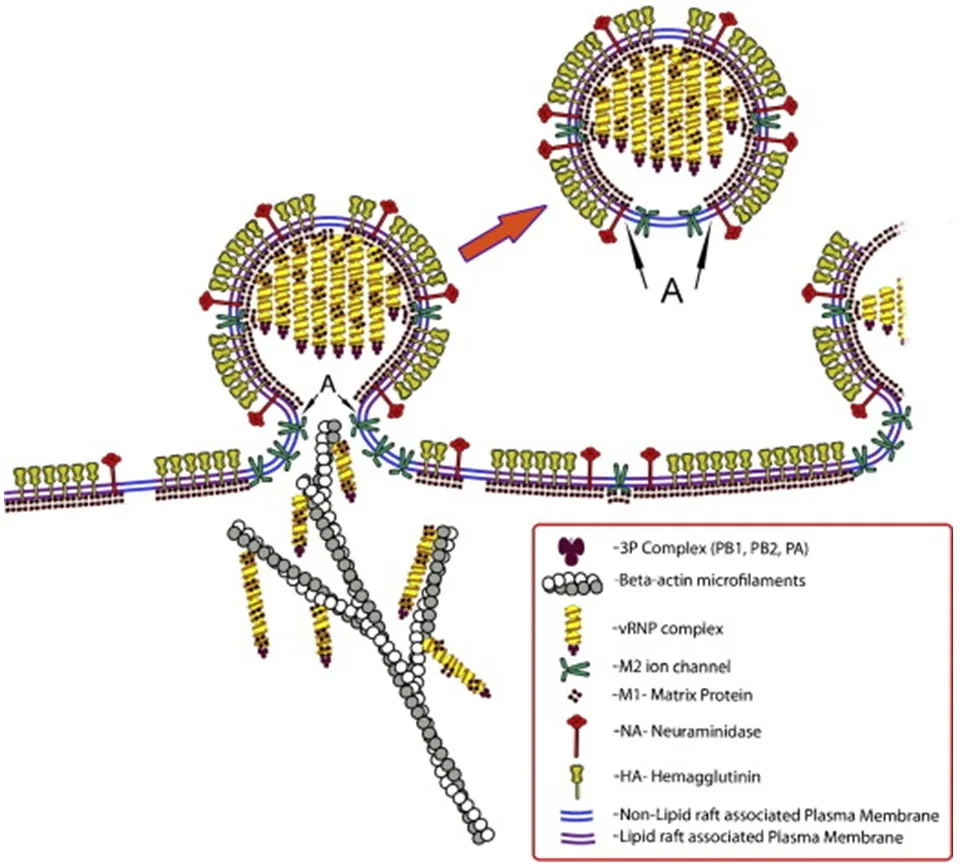
图1 流感病毒形态及出芽模型[4]Fig.1 Inf l uenza virus morphogenesis and budding model[4]
2 HA蛋白与流感病毒出芽启动
流感病毒的组装和出芽位点位于被感染细胞质膜的脂筏,脂筏大小不一,是细胞膜上胆固醇和鞘脂富集的区域。脂筏将蛋白质浓缩在质膜的特定区域,因此可作为功能域[5]。脂筏可以促进多种不同病毒的出芽过程,包括人类免疫缺陷病毒Ⅰ型、埃博拉病毒和流感病毒等。流感病毒的表面蛋白,如HA,可以定位于脂筏结构域并令其聚集从而形成“出芽区域”(图2)。
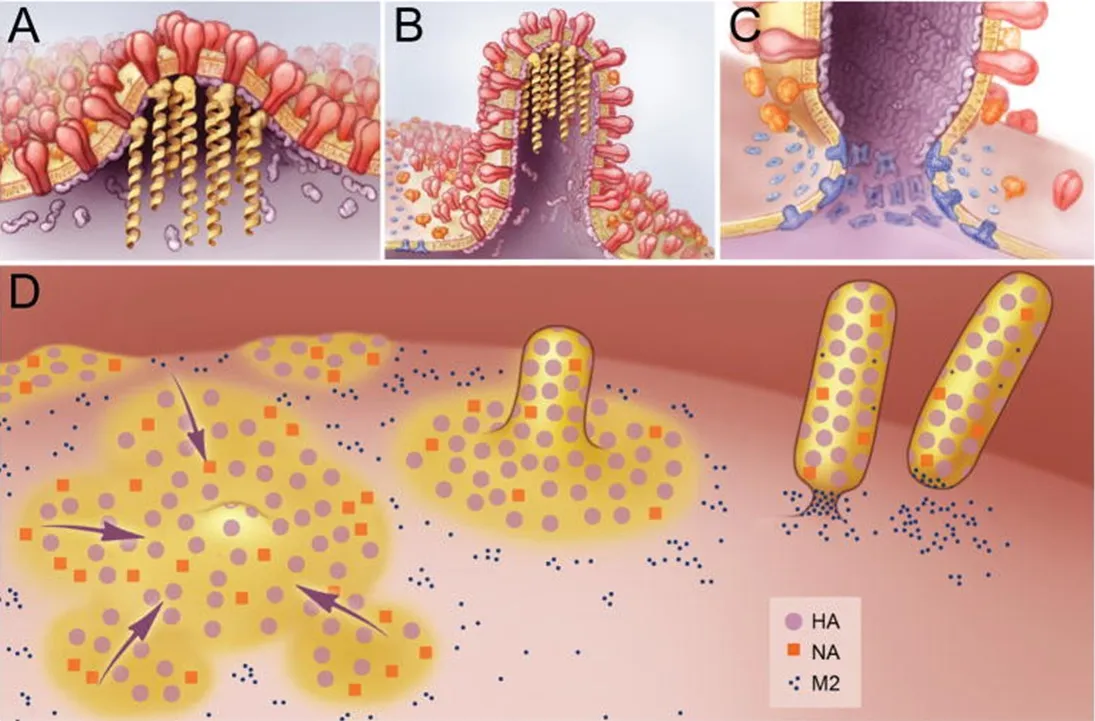
图2 流感病毒出芽过程[6]Fig.2 Inf l uenza virus budding procedure[6]
HA是病毒表面以三聚体形式存在的糖蛋白,每个单体含有529个左右氨基酸残基,主要参与病毒的吸附和入侵。HA蛋白具有27 aa的跨膜结构域(transmembrane domain,TM),其中3个棕榈酰化半胱氨酸残基介导HA与脂筏的相互作用[4]。研究显示HA在脂筏的定位对病毒复制十分重要,对HA蛋白TM的突变可阻止其定位于脂筏,继而显著抑制流感病毒的复制。
在病毒样颗粒(virus-like particles,VLP)系统中,编码HA蛋白的真核表达质粒在293T细胞中表达后,在不表达任何其他病毒蛋白的情况下单独出芽至细胞上清。HA蛋白在细胞内可引起细胞膜的曲率变化,因此,HA蛋白在脂筏处聚集后可使质膜产生正曲率并具有启动出芽过程的能力,说明HA蛋白是确定病毒出芽发生位点的重要蛋白[7]。NA和M2单独表达后也可完成出芽,但出芽效率较HA蛋白低。
然而,对HA的缺失或突变并不会使从宿主细胞出芽的病毒颗粒数目显著降低,即便这些病毒颗粒的感染能力有缺陷。这表示即便缺少HA蛋白,其他表面蛋白如NA也能够代替HA启动出芽过程。
3 M1与病毒组装
HA可以启动但无法完成出芽过程,病毒的出芽过程还需要M1蛋白参与调节[8]。M1蛋白是病毒颗粒中含量最多的一种蛋白,也是一种多功能蛋白,包含3个结构域,分别为N端结构域、中间结构域和C端结构域。M1蛋白于感染晚期在胞质内大量合成,然后通过其N端的核定位信号入核,一方面阻止病毒mRNA转录,另一方面通过中间结构域与vRNP及核输出蛋白(nudear export protein,NEP)形成复合体并介导M1-vRNP转移至细胞质[6]。M1还可与HA和NA的胞内域相互作用,同时与RNP和病毒膜表面连接,在病毒膜下形成具有规则间隔孔的螺旋网,这些孔可能用于插入HA和NA的细胞质尾部并与之相互作用。
不同于流感病毒的表面蛋白,在病毒样颗粒系统中单独表达的M1蛋白无法完成出芽,需要通过与表面蛋白相互作用被携带出芽[7]。在293T细胞中将M1与HA或NA共表达后,在上清中可同时检测到表面蛋白和M1蛋白,最近研究结果显示M1蛋白N端1~160 aa区域是与NA蛋白相互作用的唯一且最小区域,将这一区域两端只去掉20 aa便会使其丧失与NA结合的能力[10]。M1蛋白晶体结构显示其89~160氨基酸序列形成一个四螺旋结构域,而1~20氨基酸残基和140~160氨基酸残基形成的两个螺旋在空间上十分靠近,而这两个螺旋之间潜在的相互作用可能是稳定1~160功能区域的关键,1~20 aa与140~160 aa的残缺可能直接或间接导致基质蛋白M1的稳定性降低,从而削弱其与NA的相互作用[8-11](图3)。
细胞浆中,M1蛋白与HA或NA的胞内域相互作用使其结合于脂筏并导致多聚化和出芽过程的延伸。定位于质膜的M1可作为接头分子招募vRNPs[12]。多聚化的M1在病毒外膜下形成一层基质,同时与表面蛋白和内部结构相互作用,起到维持病毒内外结构的作用。最近有针对同为正黏病毒科的传染性鲑鱼贫血病毒(Infectious salmon anaemia virus,ISAV)基质蛋白晶体结构的研究,发现其N端和C端之间存在1个弯曲结构,这使得M1蛋白单体之间能够组装成具有类似A型流感病毒膜相关蛋白基质结构特征的无限2D晶格,这一机制也可能存在于流感病毒[13](图4)。
此外,M1蛋白与病毒粒子的形态有关,已有研究证明M1蛋白特定序列的突变能够赋予流感病毒形成丝状病毒粒子的能力。球状与丝状毒株的M1蛋白螺旋转弯的螺距不同,进一步说明M1蛋白结构的不同可造成病毒粒子形态的差异[14]。M1在细胞中游离状态下为可溶性单体,与病毒表面蛋白胞内域互作后与脂筏连接,并促进其在出芽位点的多聚化。
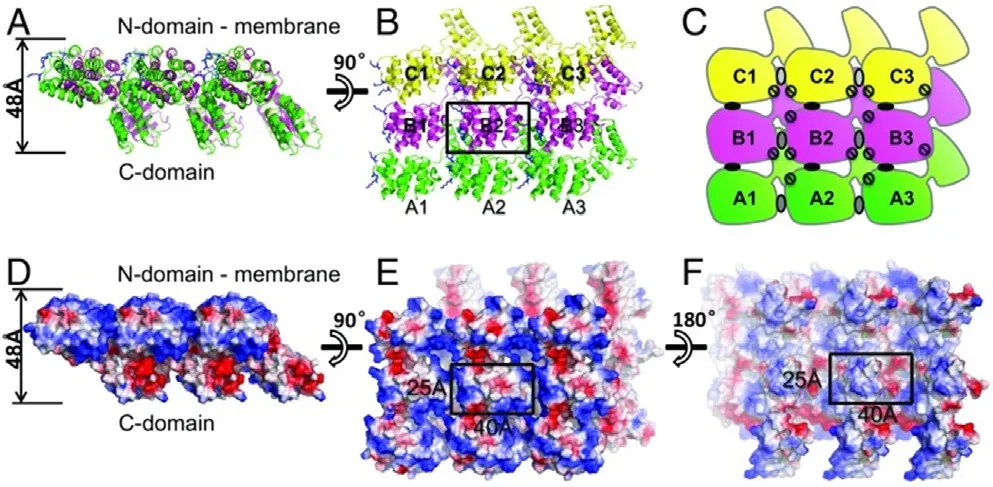
图3 M1蛋白晶体结构及多聚化机制[13]Fig.3 Crystal structure and polymerization mechanism of M1 protein[13]
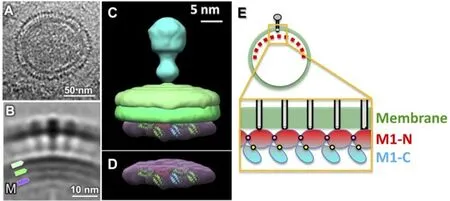
图4 M1蛋白多聚化模型[13]Fig.4 M1 protein multimerization model[13]
4 M2蛋白与膜剪切
M2是HA和NA以外的第三个表面蛋白,含有97个氨基酸,在病毒表面以四聚体形式存在,分为胞内区、胞外区以及疏水区3个结构域[15,16]。其主要功能是作为离子通道蛋白,介导病毒脱壳时病毒内部酸化。M2蛋白可定位于脂筏和剩余的大量质膜之间的边界处,在出芽过程末期处于芽生病毒颗粒颈部,可产生质膜的正曲率并导致膜剪切,使新生病毒粒子得以释放(图5)。
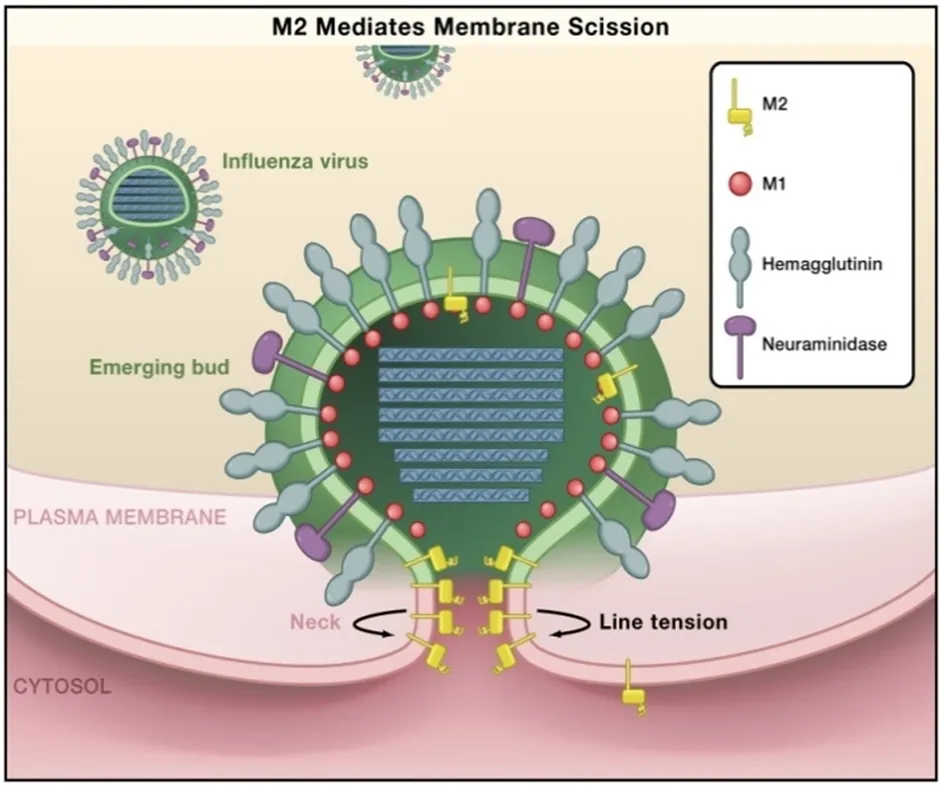
图 5 M2蛋白介导流感病毒出芽过程的剪切[17]Fig.5 M2 protein mediates membrane scission of inf l uenza virus budding[17]
M2蛋白C端的两亲性螺旋在这一过程中起关键作用,脂筏中富含的胆固醇可以改变镶嵌于其中的M2蛋白空间构型,从而促进改变质膜曲率,对两亲螺旋的突变可造成M2蛋白对胆固醇的敏感性下降,进而抑制病毒出芽[18](图6)。
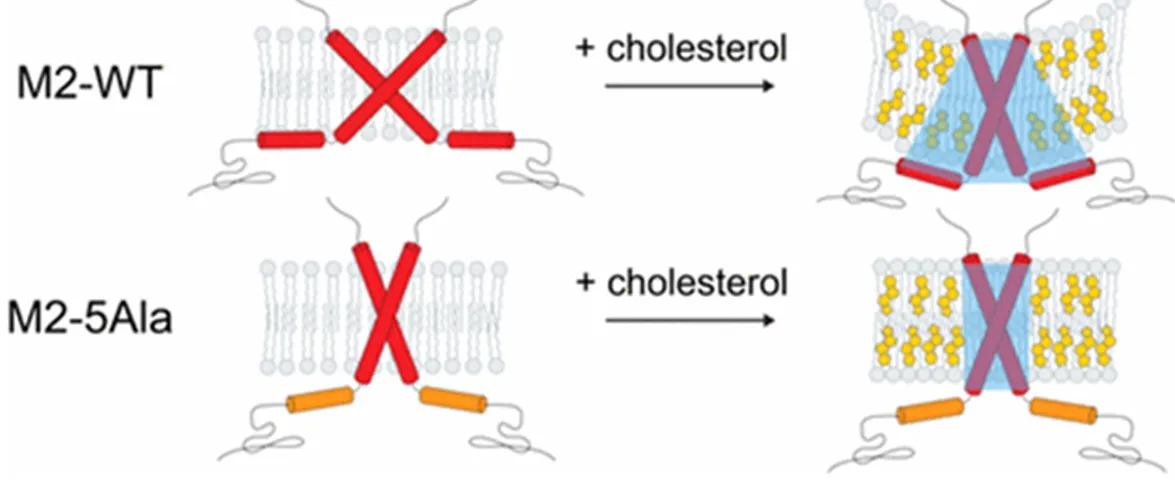
图6 M2蛋白的膜剪切机制[18]Fig.6 Membrane scission mechanism of M2 protein[18]
5 NA蛋白与病毒释放
在流感病毒出芽过程中,定位于脂筏的NA通过其胞浆区与M1蛋白相互作用,并通过此相互作用携带病毒内部结构出芽。全部A型流感病毒NA序列胞浆区氨基酸序列为Met-Asn-Pro(Thr)-Asn-Gly-Lys(Arg),这一区域在流感病毒中是十分保守的[19]。有研究者利用反向遗传技术构建了NA胞内域缺失的流感病毒,结果显示,NA胞内域的缺失不会影响NA蛋白的酶活性和其在病毒表面的分布,说明胞内域的缺失不会影响NA的四聚化和定位。然而这一区域的缺失却使病毒颗粒的形状和出芽效率受到影响,同时还会影响到病毒的毒力。同时NA的神经氨酸酶活性在出芽末期催化破坏膜表面与HA连接的唾液酸促进病毒粒子释放,是出芽过程的最后阶段[20](图7)。此外NA与M基因的搭配会影响流感病毒的致病性,比如2009年H1N1大流行毒株,其NA与M基因来源于欧亚类禽毒株,研究结果证明,NA基因与M基因的搭配对其致病性有重要的作用。
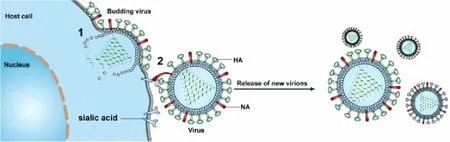
图7 NA蛋白破坏唾液酸促进病毒释放[20]Fig.7 NA protein destroys sialic acid and promotes virus release[20]
6 针对流感病毒出芽过程的抗病毒药物
NA在流感病毒出芽和传播过程中有重要作用,人们根据NA的催化机制和晶体结构设计了NA抑制剂(NA-inhibitions,NAIs),如奥司他韦、扎那米韦等。NAIs通过抑制NA的神经氨酸酶活性,抑制病毒颗粒从宿主细胞释放,是一种重要的抗流感药物。然而流感病毒容易通过点突变(NA-R292K、NA-E119V、NA-I222K/R等)产生对NAIs的抗药性[21]。
银翘散是一种经典的中药配方,具有治疗呼吸道疾病的功效,其主要成分是来自连翘的连翘酯苷A。有研究者发现连翘酯苷A可在体外降低不同亚型流感病毒感染细胞后的滴度,并且降低感染流感病毒后小鼠的死亡率。连翘酯苷A抗流感的机制是降低M1蛋白表达,继而抑制流感病毒出芽并限制病毒传播[22]。
Sambucus Nigra是一种广泛使用的抗微生物感染药物,有证据表明其具有潜在的抗病毒活性。Sambucus Nigra可以通过影响脂筏结合来抑制病毒的膜融合和出芽,并降低H9N2流感病毒在A549细胞内的复制水平[23]。
