miR-140表达与肿瘤发生发展关系的研究进展
2018-07-12李维娜何飞
李维娜,何飞
MicroRNA是真核生物中的一类小分子非编码RNA,能调控约1/3人类基因的表达,在细胞发育、分化、增殖、凋亡和肿瘤发生发展等生理及病理过程中都发挥着重要作用[1-7]。miR-140最早被发现表达于软骨细胞,能够调控软骨的发育[8-9]。近年来越来越多的研究发现miR-140在多种肿瘤中呈低表达,可能发挥抑癌基因的作用[10]。
1 miR-140概述
MicroRNA主要通过结合mRNA的3'非翻译区(UTR)来影响mRNA的降解或翻译,进而在转录后水平调控基因的表达。microRNA的5'端6~9个核苷酸的种子序列(seed sequence)与mRNA的3'-UTR形成不完全互补,因此一个种子序列可能与数百个mRNA结合,调控数百个靶基因的表达。microRNA由Ⅱ型RNA聚合酶合成,首先在核内转录成初级转录本miRNA(pri-miRNA),后者经Drosha核糖核酸酶剪切加工后形成约70nt大小、呈茎环样结构的前体miRNA(pre-miRNA),pre-miRNA在转运蛋白Exportin-5和Ran-GTP的作用下转运出细胞核。在核糖核酸内切酶Dicer的作用下,pre-miRNA被加工为大小约20~23个碱基对的双链RNA,后者与RNA诱导的沉默复合物(RISC)结合之后解开双链,此时将靠近5'端的一条RNA链称为miR-X-5p,而靠近3'端的互补链称为miR-X-3p。通常情况下,microRNA只有一条RNA链丰度高,而另一条则被降解[2-4]。但是,人miR-140与大多数microRNA不同,有miR-140-5p和miR-140-3p两种形式(图1),二者表达丰度基本相当[11],其内在的分子机制目前仍不清楚。
miR-140位于人染色体16q22.1上,该位点是染色体的脆性部位(图2)。研究发现,miR-140位于E3泛素连接酶WWP2的内含子中,成熟miR-140与WWP2-C的剪接体基因共表达,受其启动子调控[12]。
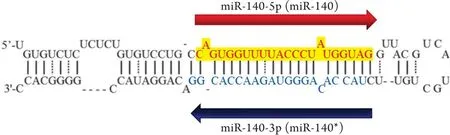
图1 pre-miR-140的茎环结构以及两种成熟形式Fig.1 A stem-loop structure and two mature forms of pre-miR-140
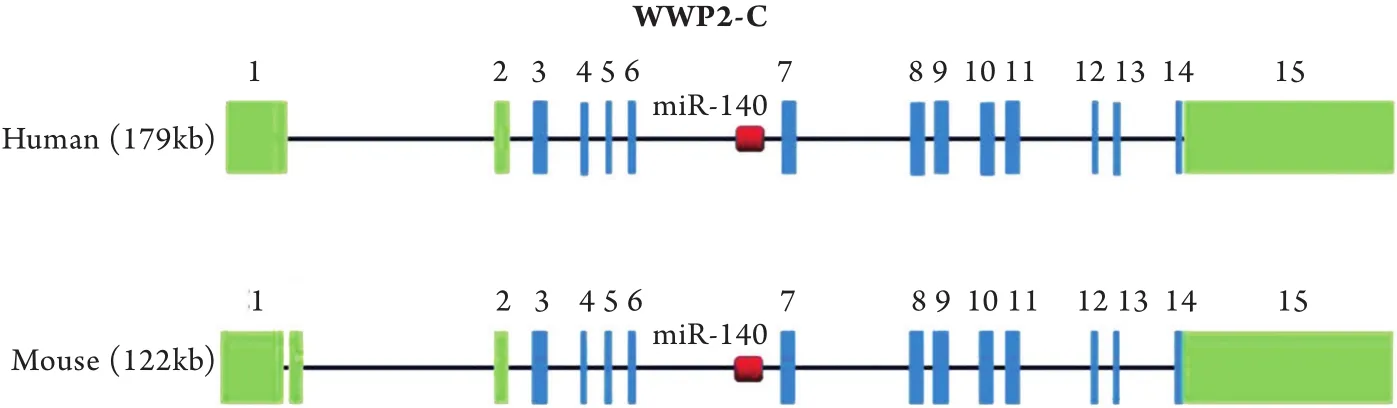
图2 miR-140在人类染色体的位置Fig. 2 Schematic diagram of the position of miR-140 gene
2 miR-140与肿瘤
2.1 miR-140与乳腺肿瘤 miR-140与乳腺癌密切相关。在早期乳腺癌中,Li等[13]比较了正常乳腺组织和不同恶性程度乳腺导管内原位癌(DCIS)miRNA表达谱的差异,发现DCIS中miR-140-3p表达降低,且DCIS恶性程度越高,miR-140-3p表达越低;进一步研究发现,在雌激素受体阴性(ERα–)的基底样癌中,肿瘤干细胞(CD44+CD24–)的miR-140-3p表达水平低于乳腺干细胞;在乳腺癌发生模型MCF10中,过表达miR-140-3p可抑制克隆形成和细胞增殖,抑制肿瘤干细胞的自我更新和肿瘤生长,而敲低miR-140-3p则能促进肿瘤细胞的增殖、抑制细胞凋亡。研究发现,在ERα–的乳腺癌肿瘤干细胞中,miR-140-3p低表达与DNA的异常甲基化有关。miR-140启动子区CpG岛的甲基化程度明显增高,用DNA甲基转移酶抑制剂处理后,miR-140表达水平升高。此外,对miR-140-3p的下游靶基因进行分析发现,miR-140-3p可能是通过调控干细胞调节因子人性别决定区Y框蛋白9(SOX9)和乙醛脱氢酶1(ALDH1)的表达来影响肿瘤干细胞生长的[13]。
同时,在雌激素受体阳性(ERα+)的侵袭性和非侵袭性乳腺癌中,miR-140-3p的表达水平亦下降[14]。miR-140-3p能调控雌激素受体(ERα)作用下乳腺癌肿瘤干细胞的自我更新,从而发挥抑癌基因作用。ERα通过雌二醇(E2)结合于miR-140-3p启动子区的雌激素应答元件(ERE),抑制miR-140-3p的表达,进而导致miR-140-3p的下游靶基因干细胞调节因子SOX2表达升高。
与Li等[13]的研究类似,Yoshida等[15]亦发现miR-140能调控乳腺肿瘤干细胞的干性,发挥抑制肿瘤的作用。他们发现抑癌基因Rb通过正性调节miR-140的表达,抑制白细胞介素6(IL-6)的表达,而IL-6能促进肿瘤干细胞、胚胎干细胞的自我更新[16]。但是Rb如何调控miR-140的表达,其机制尚未阐明。
外泌体是调节肿瘤干细胞龛活性的一个重要途径[17]。Gernapudi等[18]发现紫草素(SK)能使乳腺脂肪前体细胞外泌体中的miR-140含量明显增加,从而抑制乳腺肿瘤干细胞的自我更新和肿瘤生长,发挥抑癌作用。此外,miR-140也能作为判断乳腺癌患者预后的指标之一。Chang等[19]发现高表达miR-140-3p的患者预后好。
2.2 miR-140与肝脏肿瘤 肝癌是最常见的肿瘤之一,我国肝癌发病率居世界首位[20]。肝癌的发生与肝脏的慢性炎性反应密切相关,与核转录因子-kappa B(NF-κB)信号传导失调有关[21]。Takata等[22]发现miR-140-3p能抑制NF-κB共激活因子NRIP的表达,从而抑制NF-κB的信号活性。Takata等[23]通过进一步建立二乙基亚硝胺(DEN)诱导肝细胞肝癌(HCC)模型,发现miR-140敲除小鼠更容易出现HCC。分子机制研究表明,蛋白质-RNA复合物miRNP蛋白DEAD框解旋酶20(DDX20)表达降低可导致miR-140-3p功能障碍,使其下游靶基因Dnmt1表达增高,金属硫蛋白MTs启动子区CpG岛甲基化,MTs表达下降,NF-κB信号活性增强,从而促进肿瘤的发生[23]。
除miR-140-3p在肝癌中发挥抑癌基因作用外,miR-140-5p也可抑制肝癌细胞的生长。Yang等[24]发现在肝癌组织和多种肝癌细胞系中miR-140-5p表达降低。他们发现miR-140-5p通过调控下游靶基因转化生长因子β受体1(TGFBR1)和成纤维细胞生长因子9(FGF9),调节转化生长因子β(TGF-β)和丝裂原活化蛋白激酶(MAPK)信号通路,从而影响肝癌细胞的转移和增殖。Yan等[25]发现miR-140-5p可作用于下游靶基因脯胺酰异构酶Pin1,降低蛋白激酶B(Akt)和细胞外调节蛋白激酶(ERK)的磷酸化,阻断多种促癌信号的激活。Lv等[26]发现乙型肝炎病毒(hepatitis B virus,HBV)能诱导肝癌细胞非编码长链RNA(lncRNA)Unigene56159的表达,而Unigene56159是miR-140-5p的竞争性内源RNA(ceRNA),拮抗miR-140-5p行使功能,因此,HBV可通过Unigene56159/miR-140-5p/Slug途径促进HCC的侵袭和转移。
miR-140-5p不仅在HCC中发挥抑癌作用,同样也在胆管细胞癌中发挥抑制肿瘤的作用。研究发现,miR-140-5p在胆管细胞癌中呈低表达,其靶基因肿瘤促进基因(tumor promoting gene)Septin2表达上调[27]。
2.3 miR-140与肺癌 近年来,研究者对miR-140在肺癌中的作用机制展开了一系列研究。Yanaihara等[28]早在2006年就比较了肺癌组织与正常肺组织的microRNA表达谱,从中发现43种表达异常的microRNA,其中肺癌组织中miR-140-5p表达下调。Tan等[29]进一步比较了肺组织与肺鳞状细胞癌(SCC)的microRNA表达谱,发现了5个可以区分正常组织与癌组织的具有差异表达特性的microRNA,miR-140-3p即为其中之一,它在SCC中表达降低。Kong等[30]和Dong等[31]亦发现miR-140-3p在肺癌组织中低表达,而其过表达可抑制肺癌细胞的增殖、侵袭和迁移,其靶基因为ATP6AP2和ATP8A1。Yuan等[32]发现miR-140-5p在非小细胞肺癌组织和细胞系中低表达,miR-140-5p的低表达导致其靶基因胰岛素样因子1受体(IGF1R)高表达,从而促进肿瘤细胞的增殖、侵袭和转移。Zhang等[33]发现Smad3是miR-140-5p的靶基因,肺癌细胞中miR-140-5p的低表达导致pSmad3活性增强,后者不仅促进上皮间质转化(EMT),促进肿瘤细胞的侵袭、转移,同时也作用于癌基因Trib2启动子,增加Trib2的表达,促进肺癌细胞增殖。
本课题组研究发现,单核细胞向巨噬细胞分化相关基因(MMD)在肺癌组织中高表达,且与miR-140-5p的表达呈负相关,而进一步研究表明MMD是miR-140-5p的靶基因[34]。miR-140-5p通过调控MMD的表达而影响细胞增殖相关信号途径MAPKERK1/2的活性[34]。
Izzotti等[35]通过建立大鼠吸烟模型,发现吸烟能使大鼠肺组织中miR-140的表达下降,因此推测miR-140是吸烟导致肺癌的分子机制之一。
2.4 miR-140与消化道肿瘤 miR-140与各种消化道肿瘤的发生、发展、侵袭和转移密切相关。在食管癌中,Li等[36]发现,与相邻正常的食管组织相比,miR-140-5p在食管癌组织中表达水平降低。进一步研究表明,在食管癌细胞中,miR-140-5p可通过调控靶基因Slug的表达来影响肿瘤细胞的侵袭和转移。
Liang等[37]发现,miR-140-5p在胰腺癌组织和细胞系中表达明显下降,在人胰腺癌PANC-1细胞中,过表达的miR-140-5p能削弱肿瘤细胞的增殖和侵袭能力。同时,他们的研究还发现,miR-140-5p能作用于靶基因凋亡刺激蛋白P53的抑制因子(iASPP),过表达miR-140-5p会降低PANC-1中iASPP、肿瘤蛋白63(ΔNp63)、基质金属蛋白酶2/9(MMP2/9)的水平,从而发挥抑癌作用。
Zou等[38]发现,在胃癌组织和多种胃癌细胞系中存在miR-140-5p表达降低的情况,在人胃癌细胞HGC-27中过表达miR-140-5p能抑制肿瘤细胞存活和克隆形成,导致G0/G1期阻滞,推测其分子机制可能是miR-140-5p作用于靶基因SOX4,从而抑制了胃癌细胞的增殖。
Piepoli等[39]通过microRNA表达谱筛选了19例结肠癌样本中差异表达的microRNA,发现4个失调的miRNA,即miR-195、miR-1280、miR-140-3p和miR-1246,其中miR-140-3p表达下调。Zhang等[40]发现结肠癌样本和细胞系中miR-140-5p的表达下调,通过靶基因血管内皮生长因子A(VEGFA)影响肿瘤细胞的增殖、侵袭,且miR-140-5p低表达的程度与结肠癌的恶性程度及患者生存率密切相关。与此研究相似,Yu等[41]发现,结肠癌中的miR-140-5p表达下降,但不同的是,miR-140-5p可能是通过靶基因血小板反应蛋白解整合素金属肽酶5(ADAMTS5)和胰岛素样生长因子结合蛋白5(IGFBP5)来影响结肠癌细胞的侵袭和迁移的。赵文月等[42]认为miR-140-5p通过作用于靶基因蠕虫果蝇母抗同源蛋白3(Smad3)来影响结肠癌细胞的侵袭和转移。Zhai等[43]研究发现miR-140-5p还能调控结肠癌肿瘤干细胞(CSC,CD44highCD133high)的功能。体外实验发现,过表达miR-140-5p能明显抑制CSC的生长和干细胞球的形成,而体内研究则发现过表达miR-140-5p可抑制结肠癌CSC的成瘤和转移[43]。他们认为miR-140-5p可通过靶基因Smad2来调节结肠癌的增殖和侵袭、转移。此外他们还发现miR-140-5p可使自噬相关蛋白12(ATG12)的表达降低,从而干扰CSC的自噬能力。尽管miR-140-5p能抑制结肠癌CSC的增殖能力,但Song等[44]认为miR-140-5p可导致CSC对5-氟尿嘧啶等细胞周期化疗药物的敏感性降低。
2.5 miR-140与骨肉瘤 miR-140最早被发现高表达于软骨细胞,其与软骨的发育密切相关[8-9]。但miR-140与骨肿瘤的关系尚不清楚。Xiao等[45]发现,与正常骨组织相比,骨肉瘤中miR-140-5p的表达下调,过表达miR-140-5p能抑制骨肉瘤细胞的增殖和迁移。miR-140-5p能通过作用于靶基因组蛋白去乙酰化酶4(HDAC4)抑制骨肉瘤细胞的增殖。Song等[44]发现,miR-140-5p可诱导p53和p21蛋白的表达并作用于靶基因HDAC4,使骨肉瘤细胞在G1和G2期阻断,抑制细胞增殖。同时,体外研究发现,由于miR-140-5p抑制细胞周期的作用,导致骨肉瘤细胞对5-氟尿嘧啶等细胞周期特异性化疗药物不敏感。但与此不同的是,Meng等[46]发现,在对化疗药物抵抗的骨肉瘤组织标本中miR-140-5p的表达明显低于对化疗药物敏感的标本,故推测过表达miR-140-5p可增强骨肉瘤细胞对甲氨蝶呤等化疗药物的敏感性,其分子机制是miR-140-5p作用于靶基因高迁移率族核小体结合域蛋白5(HMGN5),从而抑制了细胞自噬,而自噬则是肿瘤化疗药物抵抗的重要机制之一[47]。
2.6 miR-140与其他肿瘤
2.6.1 头颈部肿瘤 Sand等[48]用microRNA芯片技术分别筛选了皮肤基底样细胞癌组织与正常组织、皮肤鳞状细胞癌与正常组织中差异表达的microRNA,分别发现了10个和6个表达下调的microRNA,而miR-140-3p是其中之一。Jing等[49]发现,miR-140-5p在下咽癌肿瘤组织中低表达,并且与下咽癌患者肿瘤TN分期明显相关,miR-140-5p能抑制下咽癌细胞的迁移和侵袭能力,这种作用可能是通过调控整合素金属蛋白酶10(ADAM10)的表达,进而影响Notch1蛋白的激活来实现的。Kai等[50]在舌部鳞状细胞癌中也发现miR-140-5p可通过ADAM10调控舌癌细胞的迁移和侵袭,同时还发现迁移相关基因HDAC7、层粘连蛋白Gamma 1(LAMC1)和配对盒基因6(PAX6)是miR-140-5p的靶基因。
2.6.2 神经系统肿瘤 胶质瘤是神经系统最常见的肿瘤。Liu等[51]发现,miR-140在胶质瘤样本和细胞系中低表达,在胶质瘤细胞中过表达miR-140-5p能抑制细胞的增殖和侵袭,他们推测miR-140发挥此作用的靶基因可能是ADAM9。肿瘤相关的lncRNA H19在多种肿瘤中呈高表达[52],Zhao等[53]发现H19在胶质瘤中高表达,且能与miR-140-5p结合并抑制其功能,导致miR-140-5p下游靶基因iASPP的表达升高,而后者升高能够促进肿瘤细胞存活。
2.6.3 血液肿瘤 Reddemann等[54]筛选了30例血管免疫母细胞性T细胞淋巴瘤(AITL)样本的microRNA表达谱,发现miR-140-3p表达下调。Correia等[55]发现miR-140-5p在急性T淋巴细胞白血病(T-ALL)样本和细胞系中低表达,其靶基因是与T-ALL发生密切相关的促癌基因T淋巴细胞白血病因子1(TAL1)。
2.6.4 泌尿生殖系统肿瘤 宫颈癌和卵巢癌都是女性的常见肿瘤。Su等[56]在宫颈癌标本中发现miR-140-5p和miR-140-3p都呈低表达,且miR-140-5p低表达与患者的预后密切相关,同时还发现miR-140-5p能通过靶基因IGF2BP1调控肿瘤细胞生长、侵袭和转移。Iorio等[57]通过microRNA芯片技术比较了69例恶性卵巢癌样本、15例正常卵巢样本和5种卵巢癌细胞系中差异表达的microRNA,其中miR-140-5p表达下调。Miles等[58]通过microRNA芯片发现在卵巢癌样本中miR-140-3p呈低表达。Lan等[59]进一步研究发现,部分miR-140-5p通过作用于靶基因血小板源性生长因子受体A(PDGFRA)而发挥抑制卵巢癌细胞生长的作用。Ingelmo-Torres等[60]发现,膀胱癌组织中miR-140-5p表达水平降低,且miR-140-5p的表达水平越低,膀胱癌的恶性程度越高。Wang等[61]进一步研究发现,过表达miR-140-5p可通过降低ΔNp63基因的表达来抑制膀胱癌的进展。
2.7 miR-140的促癌作用 尽管在大多数肿瘤中miR-140都能发挥抑制肿瘤生长、侵袭和转移的作用,但也有相反的报道。研究发现miR-140-3p在脊索瘤中表达增高,增高的miR-140-3p与肿瘤复发和患者预后密切相关[62]。甲状腺乳头状癌患者血清中miR-140-3p水平明显高于甲状腺良性结节患者[63]。
综上所述,miR-140受多种因子调控,在多种肿瘤中呈低表达,无论是成熟的miR-140-5p还是miR-140-3p,在乳腺癌、肝癌、肺癌、消化道肿瘤、骨肉瘤等多数肿瘤中均发挥着抑癌基因作用。由表1可见,它们通过抑制多种下游靶基因的表达,调控肿瘤细胞的增殖、凋亡和侵袭转移。
3 展 望
miR-140在大多数肿瘤中低表达,可能成为多种肿瘤的标志物之一,与其他指标相结合,可用于健康筛查、早期诊断和肿瘤复发的检测。此外,检测组织样本或血液中miR-140的表达水平可能有助
于判断肿瘤的恶性程度及预后情况。
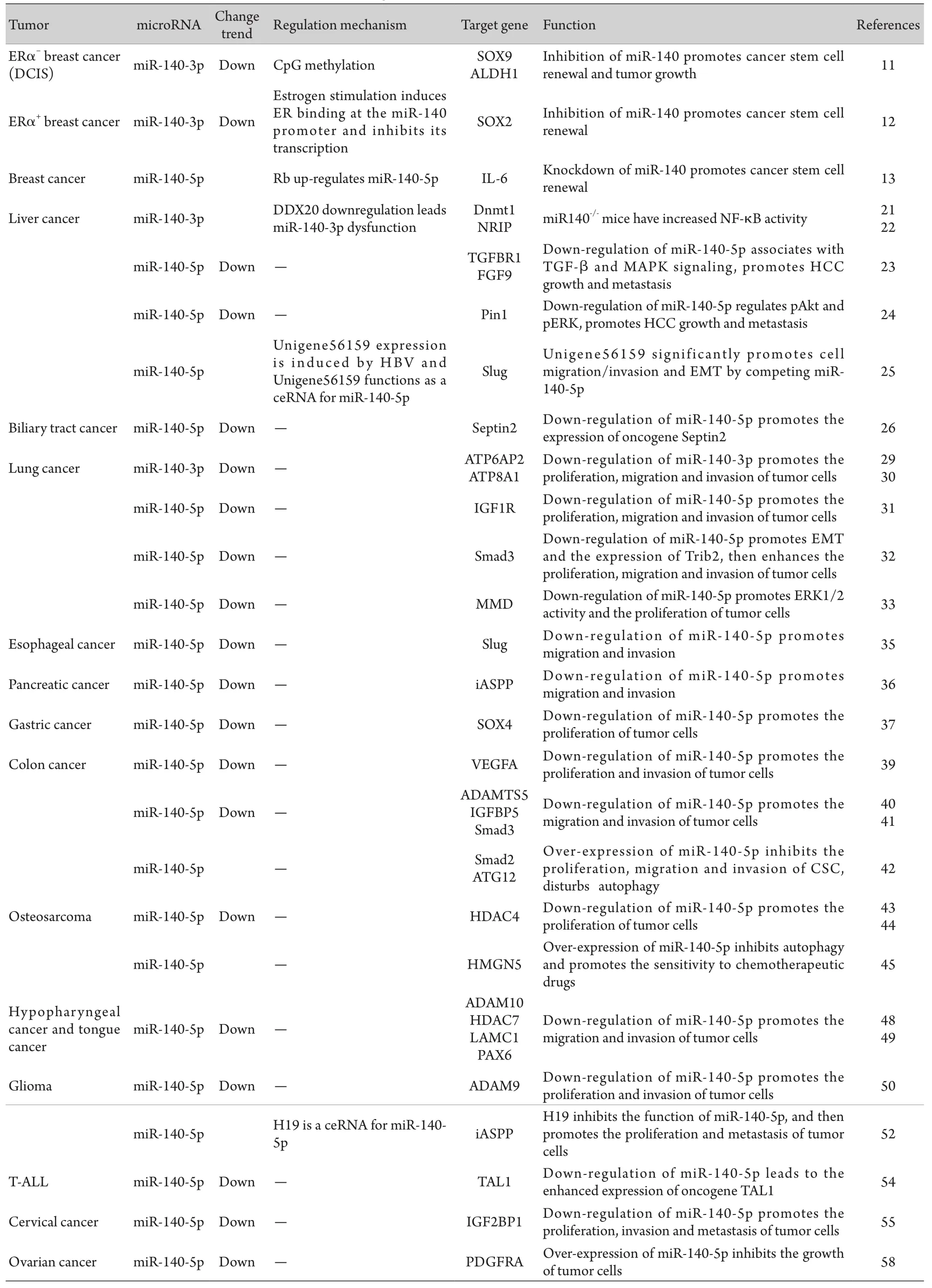
表1 miR-140在多种肿瘤中的表达及其下游靶基因和功能Tab.1 Expression, target and function of miR-140 in different tumors
miR-140在多种肿瘤中发挥抑癌基因的作用,有望成为肿瘤治疗的靶标。通过调控miR-140来治疗肿瘤的策略有:①外源性补充miR-140;②去除抑制miR-140表达的因素,促进其内源性表达;③抑制miR-140下游靶基因的表达或功能。总之,miR-140在多种肿瘤的发生发展过程中都发挥着重要作用,是一种重要的抑癌miRNA,但目前的研究仍处在初步探索阶段,进一步深入研究的结果值得期盼。
[1] Ambros V. The functions of animal microRNAs[J]. Nature,2004, 431(7006): 350-355.
[2] Bartel DP. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009, 136(2): 215-233.
[3] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297.
[4] Fabian MR, Sonenberg N, Filipowicz W. Regulation of mRNA translation and stability by microRNAs[J]. Annu Rev Biochem,2010, 79: 351-379.
[5] Liu D, Gao NJ, Tian XX, et al. Effects of microRNA-124 on the proliferation and apoptosis of human umbilical vein endothelial cells[J]. Med J Chin PLA, 2016, 41(1): 7-11. [刘丹, 高乃婧, 田孝祥, 等. MicroRNA-124对人脐静脉内皮细胞增殖和凋亡的影响[J]. 解放军医学杂志, 2016, 41(1): 7-11.]
[6] Cao D, Sun XF. Research progress of Micro RNA expression in renal fibrosis[J]. Chin J Pract Intern Med, 2017, 37(3): 262-266.[曹聃, 孙雪峰. MicroRNA在肾组织纤维化中的研究进展[J].中国实用内科杂志, 2017, 37(3): 262-266.]
[7] Liu D, Gao NJ, Tian XX, et al. Effects of microRNA-124 on the proliferation and apoptosis of human umbilical vein endothelial cells[J]. Med J Chin PLA, 2016, 41(1): 7-11. [刘丹, 高乃婧, 田孝祥, 等. MicroRNA-124对人脐静脉内皮细胞增殖和凋亡的影响[J]. 解放军医学杂志, 2016, 41(1): 7-11.]
[8] Lagos-Quintana M, Rauhut R, Yalcin A, et al. Identification of tissue-specific microRNAs from mouse[J]. Curr Biol, 2002,12(9): 735-739.
[9] Miyaki S, Sato T, Inoue A, et al. MicroRNA-140 plays dual roles in both cartilage development and homeostasis[J]. Genes Dev,2010, 24(11): 1173-1185.
[10] Green D, Dalmay T, Fraser WD. Role of miR-140 in embryonic bone development and cancer[J]. Clin Sci (Lond), 2015,129(10): 863-873.
[11] Rakoczy J, Fernandez-Valverde SL, Glazov EA, et al. MicroRNAs-140-5p/140-3p modulate Leydig cell numbers in the developing mouse testis[J]. Biol Reprod, 2013, 88(6): 143.
[12] Yang J, Qin S, Yi C, et al. MiR-140 is co-expressed with Wwp2-C transcript and activated by Sox9 to target Sp1 in maintaining the chondrocyte proliferation[J]. FEBS Lett, 2011, 585(19): 2992-2997.
[13] Li Q, Yao Y, Eades G, et al. Downregulation of miR-140 promotes cancer stem cell formation in basal-like early stage breast cancer[J]. Oncogene, 2014, 33(20): 2589-2600.
[14] Zhang Y, Eades G, Yao Y, et al. Estrogen receptor α signaling regulates breast tumor-initiating cells by down-regulating miR-140 which targets the transcription factor SOX2[J]. J Biol Chem,2012, 287(49): 41514-41522.
[15] Yoshida A, Kitajima S, Li F, et al. MicroRNA-140 mediates RB tumor suppressor function to control stem cell-like activity through interleukin-6[J]. Oncotarget, 2017, 8(8): 13872-13885.
[16] Korkaya H, Kim GI, Davis A, et al. Activation of an IL6 inflammatory loop mediates trastuzumab resistance in HER2+breast cancer by expanding the cancer stem cell population[J].Mol Cell, 2012, 47(4): 570-584.
[17] Barcellos-Hoff MH, Lyden D, Wang TC. The evolution of the cancer niche during multistage carcinogenesis[J]. Nat Rev Cancer, 2013, 13(7): 511-518.
[18] Gernapudi R, Yao Y, Zhang Y, et al. Targeting exosomes from preadipocytes inhibits preadipocyte to cancer stem cell signaling in early-stage breast cancer[J]. Breast Cancer Res Treat, 2015,150(3): 685-695.
[19] Chang JT, Wang F, Chapin W, et al. Identification of MicroRNAs as breast cancer prognosis markers through the cancer genome atlas[J]. PLoS One, 2016, 11(12): e0168284.
[20] Block TM, Mehta AS, Fimmel CJ, et al. Molecular viral oncology of hepatocellular carcinoma[J]. Oncogene, 2003, 22(33): 5093-5107.
[21] Luedde T, Schwabe RF. NF-κB in the liver--linking injury,fibrosis and hepatocellular carcinoma[J]. Nat Rev Gastroenterol Hepatol, 2011, 8(2): 108-118.
[22] Takata A, Otsuka M, Kojima K, et al. MicroRNA-22 and microRNA-140 suppress NF-κB activity by regulating the expression of NF-κB coactivators[J]. Biochem Biophys Res Commun, 2011, 411(4): 826-831.
[23] Takata A, Otsuka M, Yoshikawa T, et al. MicroRNA-140 acts as a liver tumor suppressor by controlling NF-κB activity by directly targeting DNA methyltransferase 1 (Dnmt1) expression[J].Hepatology, 2013, 57(1): 162-170.
[24] Takata A, Otsuka M, Yoshikawa T, et al. A miRNA machinery component DDX20 controls NF-κB via microRNA-140 function[J]. Biochem Biophys Res Commun, 2012, 420(3):564-569.
[25] Yang H, Fang F, Chang R, et al. MicroRNA-140-5p suppresses tumor growth and metastasis by targeting transforming growth factor β receptor 1 and fibroblast growth factor 9 in hepatocellular carcinoma[J]. Hepatology, 2013, 58(1): 205-217.
[26] Yan X, Zhu Z, Xu S, et al. MicroRNA-140-5p inhibits hepatocellular carcinoma by directly targeting the unique isomerase Pin1 to block multiple cancer-driving pathways[J]. Sci Rep, 2017, 7: 45915.
[27] Lv J, Fan HX, Zhao XP, et al. Long non-coding RNA Unigene56159 promotes epithelial-mesenchymal transition by acting as a ceRNA of miR-140-5p in hepatocellular carcinoma cells[J]. Cancer Lett, 2016, 382(2): 166-175.
[28] Yu J, Zhang W, Tang H, et al. Septin 2 accelerates the progression of biliary tract cancer and is negatively regulated by mir-140-5p[J]. Gene, 2016, 589(1): 20-26.
[29] Yanaihara N, Caplen N, Bowman E, et al. Unique microRNA molecular profiles in lung cancer diagnosis and prognosis[J].Cancer Cell, 2006, 9(3): 189-198.
[30] Tan X, Qin W, Zhang L, et al. A 5-microRNA signature for lung squamous cell carcinoma diagnosis and hsa-miR-31 for prognosis[J]. Clin Cancer Res, 2011, 17(21): 6802-6811.
[31] Kong XM, Zhang GH, Huo YK, et al. MicroRNA-140-3p inhibits proliferation, migration and invasion of lung cancer cells by targeting ATP6AP2[J]. Int J Clin Exp Pathol, 2015, 8(10):12845-12852.
[32] Dong W, Yao C, Teng X, et al. MiR-140-3p suppressed cell growth and invasion by downregulating the expression of ATP8A1 in non-small cell lung cancer[J]. Tumour Biol, 2016,37(3): 2973-2985.
[33] Yuan Y, Shen Y, Xue L, et al. miR-140 suppresses tumor growth and metastasis of non-small cell lung cancer by targeting insulinlike growth factor 1 receptor[J]. PLoS One, 2013, 8(9): e73604.[34] Zhang YX, Yan YF, Liu YM, et al. Smad3-related miRNAs regulated oncogenic TRIB2 promoter activity to effectively suppress lung adenocarcinoma growth[J]. Cell Death Dis, 2016,7(12): e2528.
[35] Li W, He F. Monocyte to macrophage differentiation-associated(MMD) targeted by miR-140-5p regulates tumor growth in nonsmall cell lung cancer[J]. Biochem Biophys Res Commun, 2014,450(1): 844-850.
[36] Izzotti A, Calin GA, Arrigo P, et al. Downregulation of microRNA expression in the lungs of rats exposed to cigarette smoke[J]. FASEB J, 2009, 23(3): 806-812.
[37] Li W, Jiang G, Zhou J, et al. Down-regulation of miR-140 induces EMT and promotes invasion by targeting Slug in esophageal cancer[J]. Cell Physiol Biochem, 2014, 34(5): 1466-1476.
[38] Liang S, Gong X, Zhang G, et al. MicroRNA-140 regulates cell growth and invasion in pancreatic duct adenocarcinoma by targeting iASPP[J]. Acta Biochim Biophys Sin (Shanghai), 2016,48(2): 174-181.
[39] Zou J, Xu Y. MicroRNA-140 Inhibits cell proliferation in gastric cancer cell line HGC-27 by suppressing SOX4[J]. Med Sci Monit, 2016, 22: 2243-2252.
[40] Piepoli A, Tavano F, Copetti M, et al. Mirna expression profiles identify drivers in colorectal and pancreatic cancers[J]. PLoS One, 2012, 7(3): e33663.
[41] Zhang W, Zou C, Pan L, et al. MicroRNA-140-5p inhibits the progression of colorectal cancer by targeting VEGFA[J]. Cell Physiol Biochem, 2015, 37(3): 1123-1133.
[42] Yu L, Lu Y, Han X, et al. microRNA-140-5p inhibits colorectal cancer invasion and metastasis by targeting ADAMTS5 and IGFBP5[J]. Stem Cell Res Ther, 2016, 7(1): 180.
[43] Zhao WY, Zou JR, Wang B, et al. microRNA-140 suppresses the migration and invasion of colorectal cancer cells through targeting Smad3[J]. Chin J Oncol, 2014, 36(10): 739-745. [赵文月, 邹佳芮, 王波, 等. miR140通过下调Smad3表达抑制结肠癌细胞迁移和侵袭能力[J]. 中华肿瘤杂志, 2014, 36(10):739-745.]
[44] Zhai H, Fesler A, Ba Y, et al. Inhibition of colorectal cancer stem cell survival and invasive potential by hsa-miR-140-5p mediated suppression of Smad2 and autophagy[J]. Oncotarget, 2015,6(23): 19735-19746.
[45] Song B, Wang Y, Xi Y, et al. Mechanism of chemoresistance mediated by miR-140 in human osteosarcoma and colon cancer cells[J]. Oncogene, 2009, 28(46): 4065-4074.
[46] Xiao Q, Huang L, Zhang Z, et al. Overexpression of miR-140 inhibits proliferation of osteosarcoma cells via suppression of histone deacetylase 4[J]. Oncol Res, 2017, 25(2): 267-275.
[47] Meng Y, Gao R, Ma J, et al. MicroRNA-140-5p regulates osteosarcoma chemoresistance by targeting HMGN5 and autophagy[J]. Sci Rep, 2017, 7(1): 416.
[48] Pan ST, Li ZL, He ZX, et al. Molecular mechanisms for tumour resistance to chemotherapy[J]. Clin Exp Pharmacol Physiol,2016, 43(8): 723-737.
[49] Sand M, Skrygan M, Sand D, et al. Expression of microRNAs in basal cell carcinoma[J]. Br J Dermatol, 2012, 167(4): 847-855.
[50] Jing P, Sa N, Liu X, et al. MicroR-140-5p suppresses tumor cell migration and invasion by targeting ADAM10-mediated Notch1 signaling pathway in hypopharyngeal squamous cell carcinoma[J]. Exp Mol Pathol, 2016, 100(1): 132-138.
[51] Kai Y, Peng W, Ling W, et al. Reciprocal effects between microRNA-140-5p and ADAM10 suppress migration and invasion of human tongue cancer cells[J]. Biochem Biophys Res Commun, 2014, 448(3): 308-314.
[52] Liu X, Wang S, Yuan A, et al. MicroRNA-140 represses glioma growth and metastasis by directly targeting ADAM9[J]. Oncol Rep, 2016, 36(4): 2329-2338.
[53] Matouk IJ, DeGroot N, Mezan S, et al. The H19 non-coding RNA is essential for human tumor growth[J]. PLoS One, 2007,2(9): e845.
[54] Zhao H, Peng R, Liu Q, et al. The lncRNA H19 interacts with miR-140 to modulate glioma growth by targeting iASPP[J].Arch Biochem Biophys, 2016, 610: 1-7.
[55] Reddemann K, Gola D, Schillert A, et al. Dysregulation of microRNAs in angioimmunoblastic T-cell lymphoma[J].Anticancer Res, 2015, 35(4): 2055-2061.
[56] Correia NC, Melão A, Póvoa V, et al. microRNAs regulate TAL1 expression in T-cell acute lymphoblastic leukemia[J].Oncotarget, 2016, 7(7): 8268-8281.
[57] Su Y, Xiong J, Hu J, et al. MicroRNA-140-5p targets insulin like growth factor 2 mRNA binding protein 1 (IGF2BP1) to suppress cervical cancer growth and metastasis[J]. Oncotarget, 2016,7(42): 68397-68411.
[58] Iorio MV, Visone R, Di Leva G, et al. MicroRNA signatures in human ovarian cancer[J]. Cancer Res, 2007, 67(18): 8699-8707.
[59] Miles GD, Seiler M, Rodriguez L, et al. Identifying microRNA/mRNA dysregulations in ovarian cancer[J]. BMC Res Notes,2012, 5: 164.
[60] Lan H, Chen W, He G, et al. miR-140-5p inhibits ovarian cancer growth partially by repression of PDGFRA[J]. Biomed Pharmacother, 2015, 75: 117-122.
[61] Ingelmo-Torres M, Lozano JJ, Izquierdo L, et al. Urinary cell microRNA-based prognostic classifier for non-muscle invasive bladder cancer[J]. Oncotarget, 2017, 8(11): 18238-18247.
[62] Wang M, Du M, Ma L, et al. A functional variant in TP63 at 3q28 associated with bladder cancer risk by creating an miR-140-5p binding site[J]. Int J Cancer, 2016, 139(1): 65-74.
[63] Zou MX, Huang W, Wang XB, et al. Identification of miR-140-3p as a marker associated with poor prognosis in spinal chordoma[J]. Int J Clin Exp Pathol, 2014, 7(8): 4877-4885.
[64] Zhang X, Cairns M, Rose B, et al. Alterations in miRNA processing and expression in pleomorphic adenomas of the salivary gland[J]. Int J Cancer, 2009, 124(12): 2855-2863.
