玉米赤霉烯酮降解菌的分离鉴定及其降解特性研究
2018-07-12潘丽婷徐圣佳胡晓丹徐丽梅史建荣顾振新徐剑宏
潘丽婷 徐圣佳 胡晓丹 徐丽梅 史建荣 顾振新 徐剑宏
(南京农业大学1,南京 210095) (江苏省食品质量安全重点实验室—省部共建国家重点实验室培育基地;农业部农产品质量安全风险评估实验室(南京);江苏省现代粮食流通与安全协同创新中心; 江苏省农业科学院农产品质量安全与营养研究所2,南京 210014)
玉米赤霉烯酮(Zearalenone,ZEN),又称F-2毒素,是一种由镰刀菌产生的类雌激素性质的真菌毒素,最早于1962年由Stob从患赤霉病的玉米中分离到[1]。ZEN在世界各地的谷物及农副产品中广泛存在[2-4]。 2012年,王金勇等[5]对我国的饲料和谷物受ZEN污染水平的调查结果显示,玉米中平均值为0.332 mg/L,最高值为1.961 mg/L;DDSG(酒糟蛋白)饲料中平均值为0.567 mg/L,最高值为2.811 mg/ L;麸皮中平均值为0.409 mg/ L,最高值为3.274 mg/L。2012-2014年间,华中地区的食品与食品添加剂的检测结果显示,90.2%的样品中含有ZEN毒素[6]。这说明我国食品及饲料中ZEN污染现状不容乐观。
ZEN性质稳定,在储藏、加工和高温烹调条件下均不发生降解,通过食物进入体内,危害人和动物的健康[7]。ZEN对人畜的毒性主要是造成动物体内生殖激素分泌紊乱,破坏动物生殖发育系统[8]。动物中最为敏感的是猪,可使其出现假发情、不孕、假孕、流产死胎等症状[9]。ZEN还可以诱导动物免疫细胞毒性,降低动物的免疫能力,引起基因突变和细胞核病变;引发肝肾组织退行性变化,造成肝肾功能紊乱;激活内源性逆转录病毒和促进相关肿瘤抗原的表达,从而诱发肿瘤的发生[10]。
鉴于ZEN污染的普遍性和危害性,对其脱毒控制一直受到科研人员的关注。常用的物理和化学脱毒法因其在除毒的同时,也会被吸附或者改变谷物中营养成分。因此,目前脱毒的最佳方法是生物去毒[11]。在ZEN 微生物降解方面,早期分离到的主要是真菌,如el-Sharkawy等[12-15]发表了多篇关于真菌转化ZEN的文章。Takahashi等[4]筛选到一株粉红色螺旋聚孢霉(Clonostachysrosea)IF7063,可将ZEN转化为无雌激素活性的代谢产物。采用细菌脱毒的研究较晚,据报道PseudomonasputiaZEA-1能够降解100~200 mg/L ZEN[16]。程波财等[17]分离到一株藤黄微球菌,该菌在LB培养基中培养120 h后能够降解2 mg/ L的ZEN。Tinyiro等[18]分离到能吸附和降解ZEN的两株芽孢杆菌。尽管报道了不少能降解ZEN的微生物,但是真正能够应用的很有限。因此,需要继续筛选ZEN降解菌,扩大菌种资源库,并应用于实际生产,这对于控制谷物中的ZEN毒素污染,保障人畜健康具有重要应用前景。
1 材料与方法
1.1 材料
1.1.1 样品和培养基
样品:2015年江苏省不同小麦产区采集的小麦样品。
培养基:基础盐培养基(MM):K2HPO4(2.5 g/L)、KH2PO4(1.2 g/L)、 NH4NO3(1.0 g/L)、MgSO4.7H2O(0.2 g/L)、Ca(NO3)2.4H2O (0.4 g/L)、NaCl (0.5 g/L)和Fe2(SO4)3(0.001 g/L) (pH 7.0),用于毒素降解菌的驯化富集;LB培养基:酵母粉5 g/L、胰蛋白胨10 g/L、NaCl 10 g/L,培养基121 ℃灭菌20 min。
1.1.2 试剂
试剂:乙腈、甲醇为色谱纯级,美国ROE公司;玉米赤霉烯酮标准品SIGMA公司;酵母粉、胰蛋白胨为食品级:上海生工生物有限公司; KH2PO4、K2HPO4、NH4NO3、MgSO4.7H2O、Ca(NO3)2.4H2O、Fe2(SO4)3、NaCl均为分析纯:上海国药集团化学试剂有限公司。
1.2 方法
1.2.1 玉米赤霉烯酮的提取检测方法
玉米赤霉烯酮的提取:称取5 g玉米粉(精确到0.01 g)置于150 mL离心管中,加入25 mL提取液(84%乙腈),180 r/min振荡提取30 min,8 000 r/min 离心5 min后取上清,取3 mL上清液润洗氨基柱,取3 mL上清液过净化柱,流速1 d/s,取3 mL 上清液淋洗2次,流速2 d/ s,收集滤液,氮气吹干后,用50%甲醇重溶,过0.22 μm的滤膜后,上液质联用仪检测。
液相色谱检测法:在文献[19, 20]基础上作部分改进,具体条件为:安捷伦Zorbax SB-C18柱(4.6 mm×250 mm,粒径 5 μm);进样量:20 μL;流动相:乙腈∶水(80∶20v/v);流速:1.0 mL/min;紫外检测器,检测波长:236 nm。
液质联用检测:在文献[21, 22]基础上作部分改进,条件为:AB3500 LC/MS,四极杆质谱系统。液相色谱条件:进样量:5 μL;流动相A:5 mmol/L醋酸铵水,B:色谱甲醇,梯度洗脱(见表1);质谱参数:电喷雾电离模式(ESI-),多反应监测模式(MRM),离子源温度:600 ℃,雾化气:50 psi,辅助气:50 psi,气帘气:35 psi,喷雾电压:4500 V,碰撞室射出电压:6 V,ZEN检测的多反应监测质谱参数见表2。
ZEN降解率=(对照组ZEN含量-样品组ZEN含量) ÷对照组含量×100%。
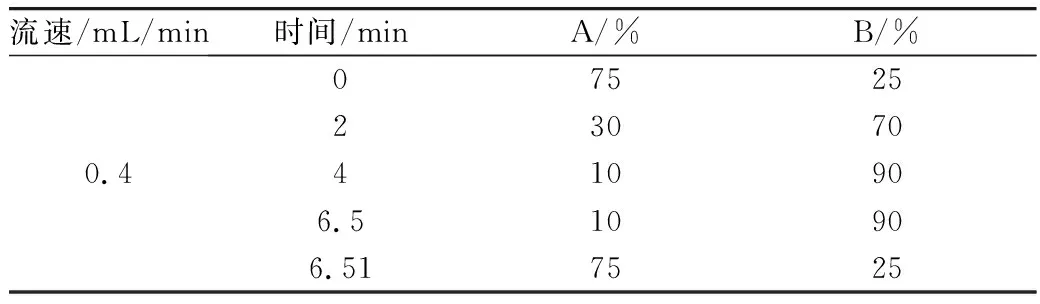
表1 流动相流速及梯度

表2 ZEN检测的多反应监测质谱参数
1.2.2 ZEN降解菌的分离及纯化
称取5 g麦粒,用75%的乙醇浸泡3 min后,用无菌水洗涤3次,然后加入用无菌水清洗后的粉碎仪中,粉碎后,加入50 mL无菌水,放置于30 ℃,180 r/min 的摇床中,振荡1 h后,10 000 r/min离心5 min后取上清,以10%的接种量加入到ZEN质量浓度为10 mg/L的MM培养基中,于30 ℃,180 r/min的摇床中连续培养7 d,以相同的方法转接5次,用高效液相色谱法检测培养液中ZEN含量。把具有ZEN降解效果的富集液涂布于LB平板上,30 ℃培养72 h后,选取不同的单菌落进行划线纯化后。再将纯化后的单菌落接种于ZEN质量浓度为10 mg/L的MM培养基中,以不加菌、含有相同ZEN质量浓度的MM培养基为空白对照,30 ℃,180 r/min的摇床中连续培养72 h 后,用高效液相色谱检测ZEN含量。选取降解ZEN效果明显的菌株,再用液质联用的方法进一步验证,最终获得ZEN高效降解菌株。
1.2.3 降解菌的菌种鉴定
形态鉴定:把降解菌接种到LB液体培养基中,30 ℃培养48 h后,用蔡司扫描电子显微镜(EVO-LS10)观察菌体的形态;生理生化鉴定[23,24]:由中国普通微生物菌种保藏管理中心进行鉴定;细菌16S rDNA 基因序列测定:①基因组DNA的提取:采用高盐法[20]提取降解菌的基因组DNA;②16S rRNA序列的PCR反应引物:27F:5'-AGAGTTTGATCCTGGCTCAG-3’;1492R:5'-TACCTTGTTACGACTT-3’;③gyrA基因引物:gyrA-F: CAGTCAGGAAATGCGTACGTCCTT,gyrA-R:CAAGGTAATGCTCCAGGCATTGCT;④测序:由上海生工生物工程技术有限公司纯化和测序;⑤序列数据处理:测序结果在NCBI使用Blast比对,从GenBank数据库中获得与菌株16S rDNA 源和gyrA源的公认标准序列数据,使用MEGA5[25],构建菌株的系统进化树,最后综合分析,确定降解菌的种属地位。 1.2.4 环境因素对降解菌降解玉米赤霉烯酮的影响实验
将降解菌7D3-2单菌落接种于LB液体培养基中,30 ℃、180 r/min培养至OD600为1.0左右,10 000 r/min 离心5 min,弃上清后,加入等体积的无菌水洗涤沉淀,10 000 r/min离心5 min后弃上清,再用和培养液等体积无菌水悬浮沉淀,制成种子液。1)培养温度对菌株7D3-2降解玉米赤霉烯酮的影响:将种子液按5%的接种量接入到含10 mg/LZEN的MM培养基中,分别于15、20、25、30、35、40 ℃,180 r/min摇床培养,同时以不接菌的含有相同ZEN质量浓度的MM培养基作为对照,每组设3次重复,48 h之后取样,采用液质联用的方法测定不同培养液中ZEN的含量。2)pH对菌株7D3-2降解玉米赤霉烯酮的影响:将种子液按5%的接种量接入到含10 mg/L ZEN、pH值分别为4.0、5.0、6.0、7.0、8.0及9.0的MM培养基中,30 ℃、180 r/min摇床培养,同时以不接菌的含有相同ZEN质量浓度、pH值为4.0、5.0、6.0、7.0、8.0及9.0的MM培养基为对照,每组设3个重复,48 h之后取样,采用液质联用的方法测定不同培养液中ZEN的含量。3)接种量对菌株7D3-2降解玉米赤霉烯酮的影响:将种子液分别按0.5%、1%、2%、5%、10%及20%体积比接入到含10 mg/L ZEN的MM培养基中,30 ℃、180 r/min摇床培养,同时以不接菌的含有相同ZEN质量浓度的MM培养基作对照,每组设3个重复,48 h之后取样,采用液质联用的方法测定不同培养液中ZEN的含量。(4)ZEN初始质量浓度对菌株7D3-2降解玉米赤霉烯酮的影响:将种子液按5%的接种量接入到含有ZEN初始质量浓度分别为1.0、2.0、5.0、10.0、25.0、50.0、75.0、100.0 mg/ L ZEN的MM培养基中,30 ℃,180 r/min 摇床培养,同时以不接菌的含有相同ZEN质量浓度的MM培养基作为对照,每组设3次重复,48 h后取样,采用液质联用的方法测定不同培养液中ZEN含量。
1.2.5 玉米赤霉烯酮降解物质的定域实验
采用渗透冲击法[26],按照下列程序分步提取:先取培养24 h后的7D3-2菌液100 mL 室温离心(6 000 r/min,10 min)上清液(S1)冻存;沉淀(P1)用10 mL(pH8.0)0.01 mol/ LTris-HCl重悬,离心(4 ℃,6 000 r/min,10 min),洗涤2次,上清液(S2)冻存;沉淀(P2)以10 mL,25%蔗糖溶液重悬,于25 ℃震荡10 min,离心(4 ℃,13 000 r/min,10 min),上清液(S3)冻存;沉淀(P3)加冷的双蒸水重悬,在冰水浴中震荡10 min,离心(4 ℃,13 000 r/min,10 min),上清液(S4)冻存;沉淀(P4)重悬于10 mL 0.01 mol/L Tris-HCl(pH7.5)中,在冰浴中超声波破碎1 min,重复5次,间隔1 min,再离心(4 ℃,15 000 r/min,20 min),上清液(S5)冻存,沉淀(P5)弃去,将S1、S2和S3合并,即为胞外提取液,S4为膜周质提取液,S5为膜内提取液。取三种提取液,加入到含有5 mg/L ZEN的MM培养基中,测定不同提取液对ZEN的降解能力,从而获得ZEN降解物在细胞中的分布情况。
1.2.6 7D3-2对玉米粉中ZEN的降解实验
称取含有ZEN的玉米粉600 g,充分混合后平均分成12份,设对照和处理,空白:不做任何处理;对照1:加入200 mL无菌水;对照2:加入200 mL LB培养液;处理1:加入200 mL 7D3-2 LB培养液(OD600=2.0)。对照1、对照2、处理1置于30 ℃摇床中,180 r/min培养48 h后,40 ℃烘干,提取玉米粉中的ZEN,采用液质联用的方法检测样品中ZEN含量,每个处理重复3次。
2 结果与分析
2.1 ZEN降解菌的初筛
以ZEN为选择压力,对采集到的样品进行富集驯化培养,得到3组对ZEN具有降解功能的富集液,这3组富集液对ZEN的降解效果均达到90%以上,在LB平板上对这三组富集液进行涂布培养,对平板上生长出来的菌落进行ZEN降解功能的验证,最终得到15株ZEN降解菌株。选择降解能力最好的菌株7D3-2进行后续研究。
2.2 7D3-2对ZEN的降解
按5%的接种量把7D3-2的种子液接种到含有10 mg/L ZEN毒素的MM培养基中,30 ℃、180 r/min摇床中培养48 h后,取样,加入色谱纯乙腈,使乙腈的终体积分数为70%,超声混匀后过孔径0.22 μm的有机相针头滤器,用高效液相色谱检测培养液中的ZEN含量,检测结果见图1。结果表明,ZEN在7D3-2 的作用下,48 h后,基本检测不到 ZEN,这表明7D3-2对ZEN毒素有很好的降解功能。
2.3 ZEN降解菌株7D3-2的鉴定
7D3-2在LB培养基上培养,其菌落呈乳白色,好氧,有芽孢,革兰氏染色阳性,通过蔡司扫描电子显微镜EVO-LS10观察,7D3-2菌体呈杆状,大小约为0.5 μm×1.6 μm。
生理生化特征试验表明:7D3-2能利用葡萄糖、明胶、蔗糖、柠檬酸等,不能利用糊精、D-麦芽糖、D-半乳糖、D-果糖等(表3)。
将7D3-2的16S rDNA基因序列和gyrA基因序列在NCBI进行Blast比对,从GenBank数据库中获得相关的标准序列数据进行系统发育分析,结果见图2,7D3-2的16S rDNA基因序列与Bacillusamyloliquefaciens,Bacillussubtilis等的同源性高达99%,无法确定其属种。因此,继续对7D3-2的gyrA基因序列与芽孢杆菌属的种进行比较,结合遗传距离、最后综合7D3-2的形态特征、生理生化特征以及遗传发育地位,参照常见细菌系统鉴定手册以及伯杰氏细菌鉴定手册,7D3-2被初步确定为解淀粉芽孢杆菌属(Bacillusamyloliquefaciens)[23,25]。


图1 7D3-2对ZEN降解的液相色谱图
表3 7D3-2的生理生化特性

项目结果项目结果项目结果项目结果接触酶+硝酸盐还原+葡萄糖利用+蔗糖利用+革兰氏染色+酪素水解+D-果糖利用+糊精利用-芽孢+尿酶+D-甘露糖利用+松二糖利用-硝酸盐还原+精氨酸双水解+D-麦芽糖利用-果胶利用-氧化酶+明胶液化+庆大霉素抗性-吐温利用-接触酶+W柠檬酸利用-D-半乳糖利用-丙酸利用-
注:“+”表示阳性,“-”表示阴性,“+W”表示弱阳性。


图2 基于7D3-2 16SrDNA、gyrA基因序列的系统进化发育树
2.4 环境因素对7D3-2降解玉米赤霉烯酮的影响
2.4.1 培养温度的影响
培养温度对菌株7D3-2降解ZEN的影响如图3所示,在15~35 ℃温度范围内,7D3-2对ZEN的降解率呈现先升高后降低的趋势,最适温度是30 ℃,此温度下ZEN的降解率高达96.82%,其次是35 ℃和25 ℃。说明在25~35 ℃范围内,菌株7D3-2产生的降解物质活性较高。
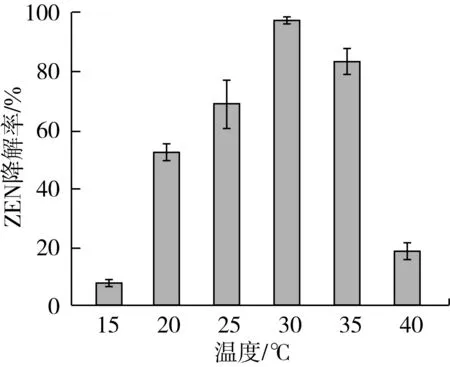
图3 培养温度对菌株7D3-2降解玉米赤霉烯酮的影响
2.4.2 初始pH的影响
起始pH对菌株7D3-2降解ZEN的影响如图4所示,在pH在4.0~9.0的范围内,7D3-2对ZEN的降解率呈现先增高后降低的趋势,在pH7.0时,ZEN的降解率最高,达95.12%,其次是pH8.0、pH6.0。这说明当pH为6.0~8.0范围时,7D3-2产生的降解物活性较高,过酸和过碱的条件下,ZEN降解活性大幅度降低。
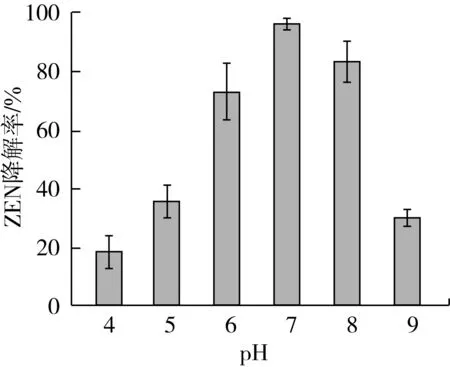
图4 初始pH对菌株7D3-2的降解玉米赤霉烯酮的影响
2.4.3 接种量的影响
接种量对菌株7D3-2降解ZEN的影响如图5所示。由图5可以看出,在接种量在0.5%~10%的范围内,ZEN的降解率呈现升高的趋势,ZEN的降解率最高可达 96.22%,当接种量大于10%时,ZEN降解率趋于平稳,不再增加。因此从经济节约的角度出发,7D3-2降解ZEN的最适接种量为10%。
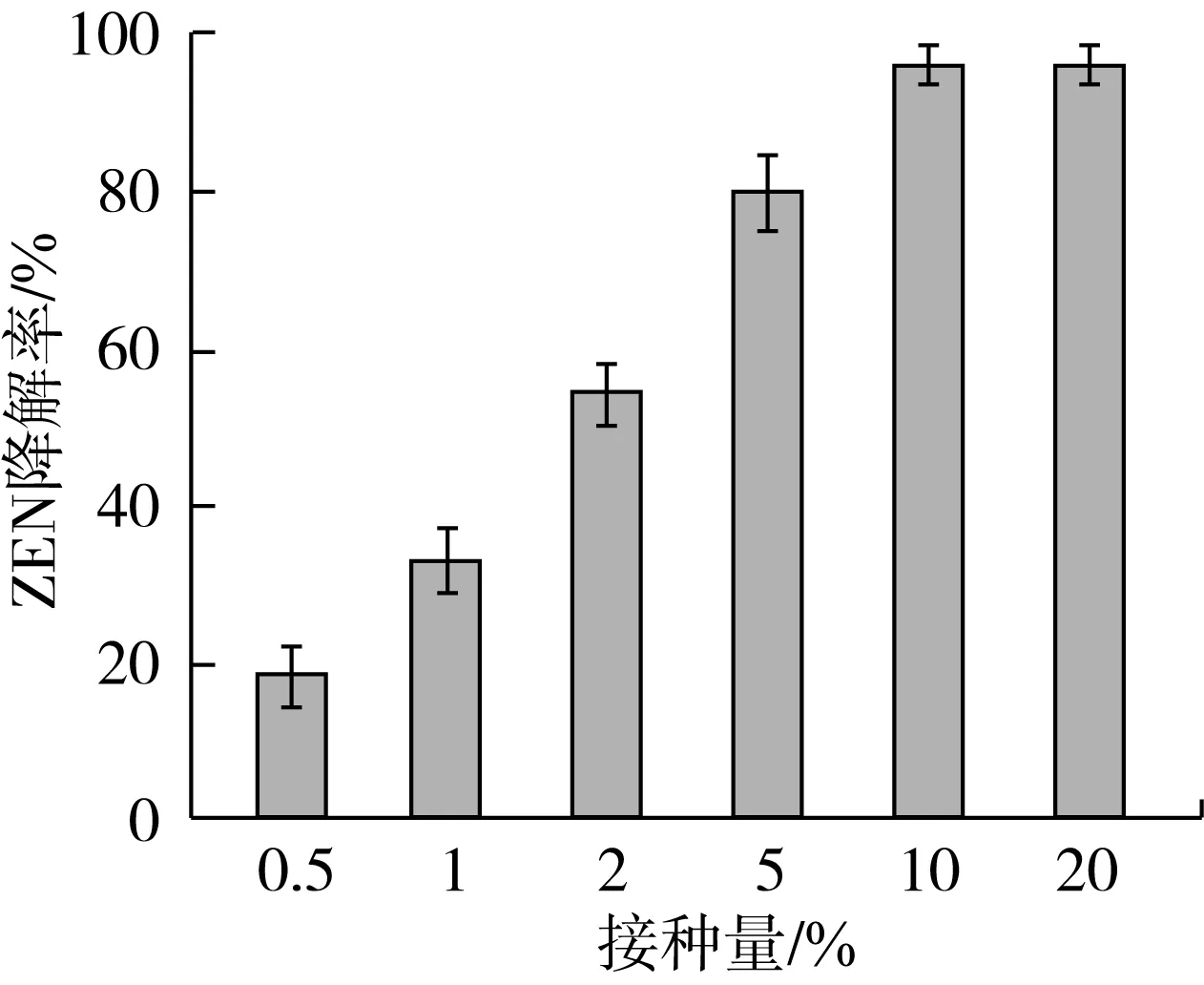
图5 接种量对菌株7D3-2的降解玉米赤霉烯酮的影响
2.4.4 ZEN初始质量浓度的影响
ZEN质量浓度对7D3-2降解玉米赤霉烯酮的影响如图6所示。从结果可以看出, ZEN初始质量浓度为1.0~100.0 mg/L范围内,ZEN降解率先处于平稳不变然后再逐渐降低的趋势:当ZEN质量浓度为1.0~25.0 mg/L之间时, ZEN的降解率基本不变,都大于95%,当ZEN质量浓度大于25.0 mg/L时,降解率显著降低;但是如果从ZEN的绝对降解量来看,ZEN初始质量浓度为1.0 ~100.0 mg/L范围内,ZEN的绝对降解量随着ZEN初始质量浓度的增加而增加,两者呈正相关。

图6 ZEN初始质量浓度对7D3-2降解ZEN的影响
2.5 玉米赤霉烯酮降解物质定域实验结果
分别测定了不同部位的降解物质对ZEN的降解效率,结果见图7。从结果可以看出,在菌株7D3-2中,ZEN降解物质主要位于胞外提取液中,胞内提取物和周质空间中的物质几乎没有ZEN降解活性,因此7D3-2中ZEN降解物质是分泌到细胞外的。

图7 ZEN降解物质的定域实验
2.6 7D3-2对玉米粉中ZEN的降解效果
含有ZEN的玉米粉经过处理后,放入30 ℃培养48 h后,提取各处理样品中ZEN,并用液质联用的方法检测提取液中ZEN的含量,结果见图8。从结果可以看出,和空白样品相比,对照样品1和2中ZEN质量浓度降低达到了极显著水平,降解率为11.83%和17.82%;加入降解菌7D3-2处理的样品中ZEN含量显著低于对照1和对照2,降解率可以达到75.96%,因此7D3-2对玉米粉中ZEN具有很好的降解效果。

图8 7D3-2对玉米粉中ZEN的降解
3 结论
3.1 采用富集培养的方法从麦粒中筛选到一株ZEN降解菌7D3-2。该菌株对ZEN的降解能力达95%以上;通过形态、生理生化特性以及16S rDNA、gyrA基因系统进化发育地位分析,7D3-2被鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。3.2 7D3-2对ZEN有良好的降解效果,在含10 mg/L ZEN的MM培养基中,48 h对ZEN的降解率可达到95%以上;7D3-2降解ZEN的最适温度为30 ℃,最适pH为7.0;当接种量小于10%时,ZEN的降解率与7D3-2接种量成正比;在ZEN初始质量浓度为1.0~25.0 mg/L时,ZEN降解率差异不显著,但当ZEN质量浓度大于25.0 mg/L时,ZEN降解率与其初始质量浓度呈反相关,但是ZEN被降解的绝对量与初始质量浓度呈正相关。
3.3 降解物的定域实验表明:7D3-2中降解ZEN的物质位于胞外上清液中;7D3-2不仅对培养液中ZEN具有降解效果,对玉米粉中的ZEN也有很好的降解效果。
