香鱼脂肪酸组成分析及其抗氧化研究
2018-07-12任霞霞刘零怡楼乔明浩翁佩芳吕亚宁胡本峰刘连亮
任霞霞 刘零怡 楼乔明 苗 亮 张 浩翁佩芳 吕亚宁 胡本峰 刘连亮
(宁波大学海洋学院,浙江省动物蛋白食品精深加工技术重点实验室1,宁波 315211) (武汉轻工大学食品科学与工程学院2,武汉 430023) (山东省农业机械科学研究院3,济南 250100)
香鱼(Plecoglossusaltivelis)特产于东亚地区,隶属胡瓜鱼目(Osmeriformes)香鱼科(Plecoglossidae),是一种小型名贵经济鱼类,具有清香无形、肉质细嫩的优点[1]。香鱼体内的香脂腺能使其散发清香,使其自古以来一直受到人们的喜爱,在中国曾被用作贡品,在日本和韩国也正是由于其清新的香味而成为人们最喜爱的海鲜之一[2]。香鱼具有生长快、商品周期短、经济价值高等特点,在日本香鱼每年市场需求量大约为3~5万t,国内消费市场也逐步形成。在中国香鱼分布较广泛,北起辽宁省鸭绿江、南至广西北仑河及台湾沿海山溪,均有分布。自80年代末、90年代初,香鱼养殖业获得了很大发展[3]。目前针对香鱼资源分布、人工繁殖、遗传与免疫等方面已有较为详细的研究,但对香鱼脂肪酸组成及其氧化稳定性的研究相对较少[4-8]。
鱼油含有丰富的多不饱和脂肪酸(PUFAs),其制品也越来越多地应用到保健品和药品中,在治疗疾病和保健上表现出的价值日益突出[9-11]。然而鱼油富含不饱和脂肪酸,稳定性比较差,容易氧化酸败[12-13]。现有研究主要是对不同地理分布的香鱼以及对不同饲料喂养的香鱼的脂肪酸进行分析[4-5],而对香鱼不同部位脂肪酸的组成却鲜有报道,分析香鱼不同部位的脂肪酸组成有助于改进香鱼的加工工艺和加工方式。本研究提取香鱼鱼头、背部肌肉、香脂腺、精巢和卵巢五个部位的脂肪,对不同部位的脂肪含量和组成进行分析,并采用烘箱法和Rancimat法和添加不同抗氧化剂对其氧化稳定性进行评价。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
香鱼采自浙江宁海凫溪香鱼养殖场,全长(17.23±0.72) cm,体重(39.31±5.21) g。
燕麦酚酸(OP) 为70%乙醇溶液提取物(得率(4.20±0.20)%,酚酸质量分数(34.75±2.40)mg/g,以没食子酸计)[14]。特丁基对苯二酚(TBHQ)、抗坏血酸棕榈酸酯(AP),三氯乙酸、甲醇、石油醚等试剂均为分析纯:国药集团。
1.1.2 主要仪器与设备
旋转蒸发仪:上海亚荣生化仪器厂;822型Rancimat油脂氧化稳定性测定仪:瑞士万通中国有限公司;7890GC气相色谱仪:美国Agilent公司;冷冻干燥机:宁波新芝生物科技股份有限公司。
1.2 方法
1.2.1 香鱼不同部位总脂肪的提取
每条香鱼分成鱼头、鱼身、香脂腺、精巢和卵巢五部分,各部分称取10 g左右,分割成块状,用滤纸包好(n=10)。将其分别放入150 mL氯仿-甲醇混合液(2∶1,V/V)中,在60 ℃条件下加热4 h,上清液旋蒸后干燥,得到香鱼鱼油样品。
1.2.2 中、极性脂肪组成的测定
干燥后的总脂肪采用液-液分离法,以石油醚及95%甲醇水溶液萃取分离中性脂肪和极性脂肪[15-16],真空干燥至恒重,计算中性脂肪和极性脂肪的百分比含量。
1.2.3 脂肪酸分析
脂肪酸甲酯化:参照GB/T 17376—2008三氟化硼法,将单个组分用含1%的浓盐酸回流1.5 h后转化为脂肪酸甲酯,采用硅胶柱层析用二氯甲烷/正己烷洗脱纯化甲基酯(2/1,V/V),用气相色谱仪进行脂肪酸分析[17]。
气相色谱条件:采用DB-WAX 聚乙二醇毛细管色谱柱(60 m×0.25 mm×0.25 μm)进行分析,载气氦气,流速1 mL/min,分流比50∶1;起始柱温180 ℃,保留15 min后,以4 ℃/min升至210 ℃后,保留30 min,再以3.0 ℃/min升至230 ℃,保留15 min。
1.2.4 鱼油氧化稳定性实验
鱼油品质检测:不同部位香鱼鱼油的过氧化值参照GB 5009.227—2016测定[18],碘值测定参照GB/T 5532—2008[19];酸价参照GB 5009.229—2016进行[20]。
鱼油氧化稳定性测定:取(3.00±0.01)g待测鱼油样品放入Rancimat测定管,测量池中加入50 mL去离子水,于90 ℃通入空气,流速20 L/h,按照GB/T 21121—2007进行实验[21],通过诱导时间(IP)比较各试样的氧化稳定性。
不同抗氧化剂对香脂腺油脂的品质影响:取一定量香脂腺油脂分别加入TBHQ、AP、OP以及AP+OP混合物,设置空白对照为CK组,添加量均为0.02%。将各处理样品放入60 ℃的烘箱[22]中鼓风处理,加速油脂的氧化,测定鱼油在不同时间的过氧化值(POV)和硫代巴比妥酸值(TBA)。
1.2.5 数据处理
实验结果以平均值±标准差表示。采用Excel软件对检测数据进行统计分析并制图,用SPSS 17.0进行单因子方差分析(One-Way ANOVA),多重比较采用Duncan检验,P<0.05视为差异显著,P<0.01视为差异极显著。
2 结果与讨论
2.1 香鱼不同部位的脂肪分布及性质
香鱼不同部位的总脂肪含量以及脂肪酸组成存在显著差异 (P<0.05),香脂腺脂肪质量分数显著高于其他四个部位,为(50.20±2.23)%,是香鱼脂肪的主要来源;鱼头的总脂肪质量分数最低,为(4.92±0.21)%(表1)。动物脂肪可分为结构脂质和储能脂质,其中极性脂肪主要为结构脂质,而中性脂肪主要为储能脂质。近年来,极性脂肪中的磷脂因其具有特殊的生理活性而备受关注[23]。精巢的极性脂肪组成最高,为(72.8±3.72)%,其次为鱼头(66.30±3.07)%;背肌的极性脂肪含量最低,中性脂肪含量最高,这与其能量储存功能具有密切关系。香鱼中性脂肪和极性脂肪中的具体组成,还有待今后进一步深入研究。
从理化指标的检测结果可以看出(表1),本实验制备的香鱼鱼油均达到了精制鱼油的标准。对比SC/T 3502-2016 鱼油可知,5组鱼油样品的过氧化值均达到了一级精制鱼油的要求,仅香脂腺和精巢鱼油的酸价能够达到一级标准,其他3个部位鱼油的酸价仅能达到二级标准,而五组鱼油样品的碘值达到粗鱼油的标准。尽管如此,数据也表明从香鱼各部位提取的油脂的基本指标已经达到商业鱼油的标准,具有应用前景。

表1 香鱼不同部位的脂肪含量、组成和品质检测
2.2 香鱼不同部位的脂肪酸组成和含量
面积归一法求得的香鱼不同部位的脂肪酸组成及含量如表2所示。香鱼脂肪酸主要包含棕榈酸、亚油酸、十六烯酸、硬脂酸、十四烷酸、亚油酸、亚麻酸等,但是不同部位的脂肪酸组成及含量存在一定差异。在鱼头、卵巢、香脂腺、背肌四个部位中,棕榈酸(C16∶0)和亚油酸(C18∶2)是含量最高的2种脂肪酸。在人工饲养过程中,香鱼饲料中往往含有高含量的C18∶2脂肪酸,这是导致香鱼各部位具有高含量C18∶2的主要原因[2]。在本实验中,所选取的5个部位的饱和脂肪酸(SFAs)均超过50%。脂肪酸组成尤以鱼头和香脂腺最为丰富,均检测出16种脂肪酸,其次是背肌,共检测出15种脂肪酸。香脂腺脂肪含量显著高于香鱼其他部位,也是其清香气味主要来源。鱼头、卵巢、香脂腺和背肌中的PUFAs总量分别为(34.33±0.04)%、(29.75±0.19)%、(31.18±0.05)%和(30.50±0.10)%。亚油酸和亚麻酸是人体必需脂肪酸,具有降低血清脂质、防治动脉粥样硬化等功能[23]。表2结果也表明,尽管香鱼油脂中并不含二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),但是香鱼鱼头、卵巢和背肌均可以作为良好的食物来源。
精巢脂肪酸种类明显少于其他部分,只检测出7种脂肪酸,并且PUFAs也显著低于其他4个部位(P<0.01),但是其含有的SFAs以及十七碳烯酸(C17∶1)质量分数最高,分别为(67.43±0.08)%和(10.09±0.09)%。精巢中的C17∶1含量是其他部位的10倍之多,可能与其在精巢中的功能有关,尚待进一步研究。
C24∶1俗称神经酸,是大脑神经细胞和组织的核心天然成分,具有修复神经细胞和防止脑神经衰老的生理功能[24]。在大多数淡水鱼中神经酸未被检出,目前只在鳡鱼肌肉脂肪酸中发现少量[25]。在本实验中,香鱼卵巢和精巢未检测出神经酸,香鱼鱼头、香脂腺和背肌中分别含有(0.42±0.03)%、(0.35±0.03)%、(0.40±0.03)%的神经酸,表明香鱼脂肪酸具有特殊的营养价值。
2.3 鱼油氧化稳定性
2.3.1 Rancimat 油脂氧化稳定性
Rancimat油脂氧化稳定性测定是在高温下通入空气,通过测定诱导时间来表征油脂氧化稳定性的强弱,油脂的氧化稳定性随着诱导时间的增长而增大[26]。不同部位鱼油在90 ℃下的氧化稳定性结果如图1所示。和其他4个部位相比,精巢油脂表现出更好的稳定性,这与其含有相对较低的PUFAs有关。油脂不饱和程度越高,氧化作用越明显,稳定性就越低,然而与其他油脂的Rancimat结果相比,香鱼油脂的氧化稳定性仍然较弱[27-30]。因此添加抗氧化剂对于增强其氧化稳定性、延长其储藏货架期显得尤为必要。
2.3.2 不同抗氧化剂对香鱼香脂腺的氧化稳定性
本实验利用烘箱法通过加速氧化来研究油脂的氧化稳定性。POV和TBA都是判断油样酸败、氧化与否或氧化程度的重要指标。氢过氧化物是油脂氧化的初级产物,通常用POV来反映初级氧化程度。丙二醛是油脂氧化产生的次级代谢产物之一,TBA表示最终脂质氧化产物的浓度,反映氧化程度[31-32]。香脂腺是香鱼的重要器官,也是香鱼鱼油主要来源,在60 ℃条件下TBHQ、AP、OP和AP+OP对香脂腺鱼油POV和TBA的影响分别如图2、图3所示。

表2 香鱼不同部位的脂肪酸组成
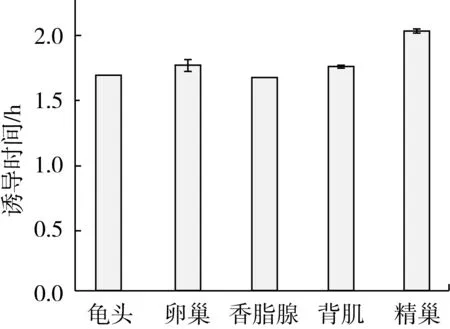
图1 香鱼不同部位油脂在90 ℃下的氧化稳定性
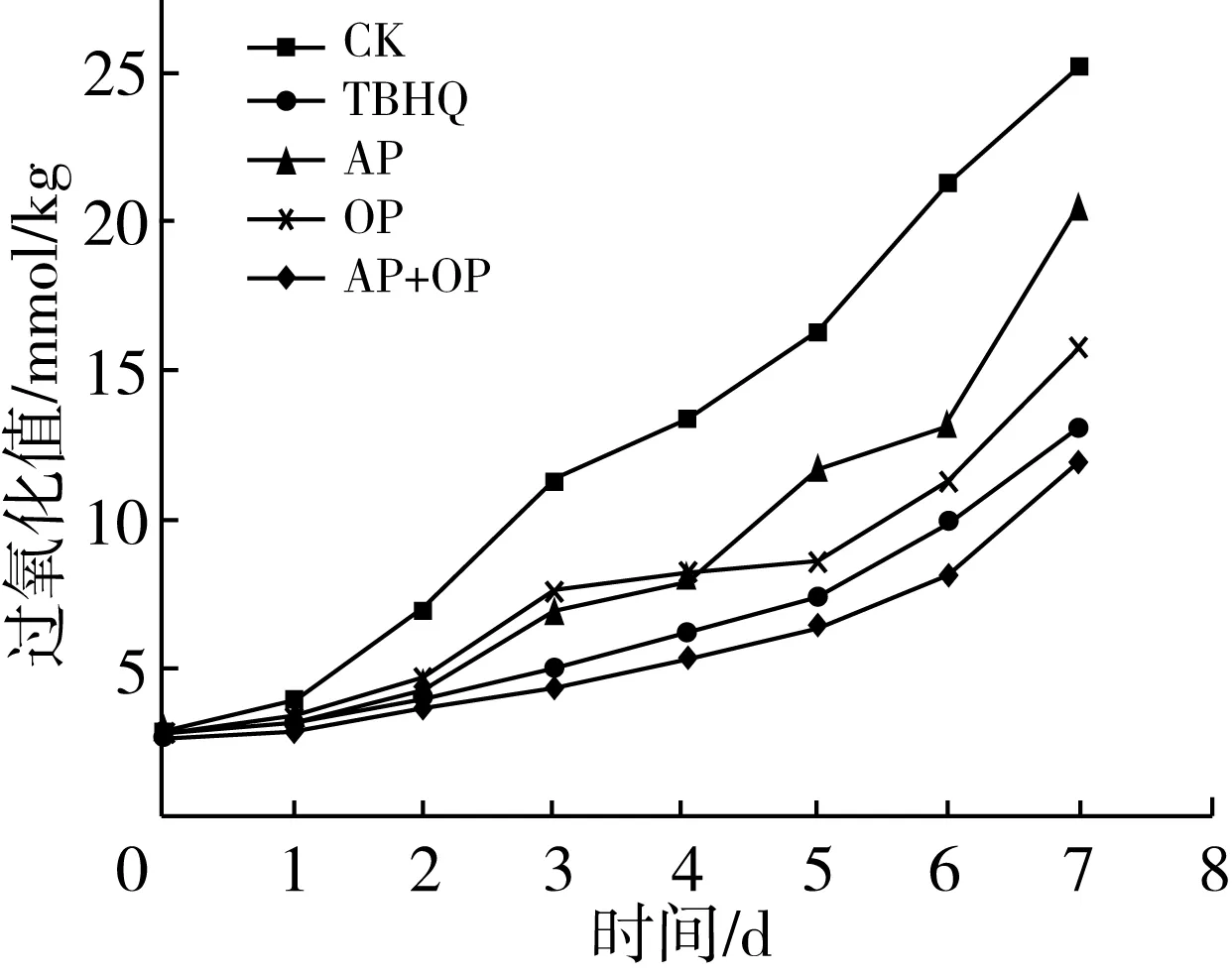
图2 60 ℃时不同抗氧化剂对鱼油过氧化值的影响
由图2可以看出,空白鱼油样品的POV随时间的延长而迅速的增长,添加抗氧化剂后,鱼油的氧化稳定性有了显著提高。在相同时间下,添加AP+OP混合物的鱼油的POV小于添加TBHQ、AP和OP样品的POV值,表明OP+AP混合使用的效果最好。添加剂单一使用时,TBHQ的使用效果最为显著,在第14天时,AP的抗氧化性优于OP,但在第4天之后,OP的抗氧化性优于AP。总体来说,抗氧化剂对鱼油氧化稳定性的影响程度为:AP+OP>TBHQ>OP>AP。燕麦多酚具有良好抗氧化活性,本实验所用燕麦多酚为乙醇提取物(游离酚酸),其主要抗氧化成分为醇溶性成分,包括酚酸类、黄酮类等酚类化合物,具有优良的抗脂质氧化功能[33-34]。
本实验中添加TBHQ的鱼油的诱导期从1 d延长到5 d,延长了近5倍,在汉麻籽油的抗氧化研究中,0.02%的TBHQ在100 ℃时的诱导期从4.1 h提高到15.9 h,延长了3倍左右[35]。由此可见TBHQ无论在动物油脂还是植物油脂的抗氧化方面,其单独使用效果都是最好的。在抗氧化剂复配使用方面,天然来源的AP+OP复配可以协同增效,较单一抗氧化剂使用效果更好,也证实了目前研究多种氧化剂混合使用较单一使用效果好的结论[36-37]。此外也有研究表明,抗氧化剂会改变油脂的挥发性成分和含量[38]。

图3 60 ℃时不同抗氧化剂对鱼油硫代巴比妥酸值的影响
图3表明,丙二醛在第1~2 d缓慢产生,从第5天开始迅速增加,其中1~5 d处于诱变期,之后处于突变期。图3显示的结果与测定的POV的实验结果基本相似。即添加抗氧化剂后,鱼油的抗氧化能力均有很大提升,同样OP+AP混合使用效果最好,预测鱼油的货架期可延长51 d[39]。
3 结论
香脂腺是香鱼脂肪的主要来源,为(50.20±2.23)%;鱼头的总脂肪质量分数最低,为(4.92±0.21)%。精巢的极性脂肪组成最高,为(72.80±3.72)%,其次为鱼头(66.30±3.07)%;肌肉中的极性脂肪含量最低,中性脂肪含量最高。香鱼不同部位油脂的性质和数量不同,实验测得有16种类型的脂肪酸,主要包含棕榈酸、亚油酸、亚麻酸、二十碳烯酸、二十碳二烯酸、二十二碳烯酸等,其中SFAs质量分数高达27%~34%,MUFAs质量分数为5.00%~9.00%,PUFAs为18.56%~34.33%。虽然精巢MUFAs含量最低,但是C17∶1为其他部位的10倍以上。
Rancimat (90 ℃)测定结果表明,精巢提取油脂的氧化稳定性最高,烘箱法结果表明抗氧化剂能显著延长油脂稳定性。其中加入OP+AP的混合物协同增效,对鱼油的氧化稳定影响最大,最大地延长了鱼油的货架期,对香鱼的开发利用以及香鱼加工和储藏货架期的延长有一定的指导意义。
