痛风泄浊方对高尿酸血症的治疗机制
2018-07-12王慧超张威李铁军
王慧超,张威,李铁军
(河南大学第一附属医院,河南 开封 475000)
高尿酸血症(HUA)是一种常见的慢性非传染性代谢性疾病,早期临床上常无明显伴随症状及体征,其危害性也往往被人们所忽视。高尿酸血症是一种尿酸盐超饱和状态,当超过其最大溶解度时可以析出结晶沉积关节处诱发炎症进而引起痛风,因而HUA也通常被认作是痛风发生的最直接原因和生化基础[1]。随着社会经济的发展,餐桌膳食搭配比例的改变以及人口老龄化趋势,高尿酸血症患病率在国内外均呈现出上升趋势,成为严重危害大众健康的主要疾患之一,我国成人高尿酸血症的的患病率为8.4%~13.3%,对其防治刻不容缓[2-4]。
目前,HUA的治疗可采用药物和非药物治疗相结合的手段。临床上常用降血尿酸的西药主要为抑制尿酸生成和促进尿酸排泄两类[5]。前者以别嘌醇片,后者以苯溴马隆片、丙磺舒为代表。临床降尿酸作用显著,但与此同时,在服药过程中的副作用也会不同程度的出现,如皮疹、消化道刺激、血液系统损害、肝肾功能损害等,严重时危及生命,影响患者的持续服药,病情出现反复,一定程度上限制了其在临床上的应用[6-7]。寻找新型安全有效的降尿酸药物也因此成为了国内外医学领域的研究热点。中医药治疗从整体观出发,辨证论治,标本兼顾,同时注重个体差异,近年来通过采用健脾补肾、清热利湿、活血化瘀等治则,在治疗高尿酸血症上取得了较好的疗效,且副作用少,获得了更多的关注[8]。但对于作用机理研究还相对不够深入,因此通过中药干预实验性高尿酸血症,加强中医药治疗HUA的作用机制研究,对本病的治疗具有重要意义。
痛风泄浊方是导师根据长期临床经验总结,结合众多医家的思想,在二妙散基础上加味而成,临床应用中取得了较好的疗效,具有明显止痛,降低血尿酸作用。近年随着流行病学的深入研究,发现HUA与代谢综合征、心血管疾病、肾脏疾病等密切相关,因此,HVA发生与否也和系统性免疫炎性反应存在一定的关系,炎症因子在其中有怎样的表现,都是这一领域亟待解决的问题。目前我们对高尿酸血症炎症反应过程中参与的炎症因子及其机制仍未完全明确。本文拟通过观察痛风泄浊方对高尿酸血症大鼠的IL-17/IL-23水平,进一步验证其降尿酸疗效,并初步探讨其作用机制,为HUA的防治提供了一定的参考,也为本方今后临床推广应用提供实验依据。
1 材料与方法
1.1 实验动物
SD雄性SPF级健康大鼠60只,体质量(200±20)g,购自河南省实验动物中心,适应性饲养7 d后开始实验。随机分为对照组、模型组、痛风泄浊方高剂量组、痛风泄浊方中剂量组、痛风泄浊方低剂量组、别嘌醇组,每组10只。
1.2 主要试剂与药物
1.2.1试剂
黄嘌呤氧化酶(XO)试剂盒(A002,南京建成生物技术有限公司);BCA蛋白定量试剂盒(20201ES76,上海碧云天生物技术有限公司);IL-17(ab119535)、IL-23 ELISA(ab64708)试剂盒,IL-17一抗(Abcam,ab79056),IL-23一抗(Abcam,ab45420),免疫组化二抗试剂盒(SP0023,北京博奥森生物技术有限公司);DAB显色试剂盒(AR1022,武汉博士德生物工程有限公司)。
1.2.2药物
阳性对照组药物采用别嘌醇片(100 mg/片,上海信谊万象药业股份有限公司,100片/盒,国药准字:H31020344);造模药物应用盐酸乙胺丁醇片(0.25 g/片,上海信谊药厂有限公司,100片/盒,国药准字:H31021140)、腺嘌呤(AdenineAladdin industrial Corportion);治疗药物药物为痛风泄浊方:采用中药免煎颗粒(深圳市三九现代中药有限公司),购于淮河医院草药房。组方:黄柏15 g,苍术15 g,防已20 g,苦参15 g,土茯苓30 g,泽泻15 g,萆薢15 g,猪苓15 g,红花15 g,桃仁15 g,川芎15 g,全蝎10 g,穿山甲10 g,青风藤30 g,伸筋草30 g,共计生药265 g。
1.3 主要仪器及耗材
酶标仪(ELX800,BioTek);微量台式高速离心机(TG15-W,湖南湘仪实验室仪器有限公司);多功能全自动生化分析仪(7180,日立);生化培养箱(上海一恒科仪有限公司);轮转切片机(KD-1508A,科迪仪器);快速匀浆器(SK96-A,江苏新康医疗器械有限公司);普通光学显微镜及拍照系统(上海光学仪器厂);黏附载玻片(25 mm×75 mm,江苏世泰实验器材有限公司);精密电子分析天平(梅特勒);85-2恒温磁力搅拌器(江苏金坛市环宇科学仪器厂)。
2 方法
2.1 高尿酸血症模型复制
大鼠适应性饲养1周后,参照文献,取0.05 g/ml盐酸乙胺丁醇和0.02 g/ml腺嘌呤进行灌胃造模。上午9点给予腺嘌呤(100 mg/kg)+乙胺丁醇(250 mg/kg)进行灌胃,1次/日;当日下午2点给予蒸馏水灌胃,共14 d。
2.2 给药方法
以成人体质量60 kg计算,按人鼠药物剂量换算1 kg大鼠剂量约为1公斤成人体重的6.3倍计算给药量,不同剂量之间呈2倍递增关系,设痛风泄浊方高、中、低生药剂量组(24 g/kg、12 g/kg、6 g/kg),分别配制成1.6 g/ml、0.8 g/ml、0.4 g/ml浓度药液,按15 ml/kg灌胃,置于4℃冰箱备用;别嘌醇片给药剂量为10 mg/kg,研末配制成0.68 mg/ml,按15 ml/kg灌胃,置于4℃冰箱备用。治疗组处理如下:上午9点给予腺嘌呤(100 mg/kg)+乙胺丁醇(250 mg/kg)进行灌胃,1次/日;当日下午2点给予1.6 g/ml痛风泄浊方或0.68 mg/ml别嘌醇灌胃,给药体积按15 ml/kg,共14 d。
2.3 指标观察方法
2.3.1一般情况观察
每日密切观察大鼠饮食、饮水、运动及尿量情况。
2.3.2血清XO检测
设置空白管与测定管并标记,每组取10份大鼠血清标本,再次离心取上清液,分装标记置于冰盒上,提前取出试剂1、试剂4,前者置于水浴锅融化(37℃水浴),后者临用前稀释,冰上操作;准备完毕后,空白管滴加60 μl蒸馏水,测定管滴加60 μl上清液,避光条件下两管均依次滴加试剂1、2、3、4后混匀,37℃水浴20 min,随后滴加试剂5,混匀,反应液体积共2.33 ml,取200 μl加入微量样板孔,采用酶标仪进行测定OD值。
2.3.3IL-17、IL-23检测
取大鼠血清,参照ELISA试剂盒操作说明,通过绘制标准曲线,检测血清中IL-17、IL-23水平。
2.3.4肾组织病理学观察
各组大鼠采血后,迅速置于操作台,取肾组织,置于4%多聚甲醛中固定,8h后依次进行脱水、透明、浸蜡、包埋、切片(5 μm),进行苏木素-伊红(HE)染色,光学显微镜观察染色情况并进行摄片分析。
2.3.5肝组织XO水平测定
取肝组织置于-80℃冰箱备用,实验前解冻标本,每组选取10个标本,均称取0.35 g,分管标记,按照1:9的比例(即重量:体积)加入0.9%生理盐水3.15 ml,置于冰上,机械匀浆,匀浆液(10%)配制完汲取同体积用BCA法测定匀浆液蛋白浓度,余下匀浆液在3 000 r/min转速条件下离心10 min,留取上清备测OD值,步骤同血清XO测定。
2.3.6肾脏组织中IL-17、IL-23表达检测
组织切片脱蜡至水化,微波修复抗原,3% H2O2消除非特异性染色,正常山羊血清封闭,一抗过夜,二抗孵育,DAB显色,苏木素复染。各实验组随机取5个标本,各个标本随机拍照3个高倍视野,应用Image-Pro Plus 6.0分析系统进行半定量分析。
2.4 统计学方法
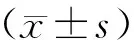
3 结果
3.1 一般状态观察
由于预实验熟练掌握了灌胃技术,在模型复制和灌胃过程中,未发生灌胃导致的死亡。与正常组比较,模型大鼠饮食、饮水量减少,活动缓慢,毛色欠光泽,尿量明显减少,各治疗组与对照组一般情况无统计学意义。
3.2 血清XO水平比较
如表1所示,与对照组比较,模型组大鼠XO水平明显升高(P<0.01),经痛风泄浊方高/中剂量预治疗,XO水平明显降低(P<0.05或P<0.01),但低剂量组与阳性对照组无明显差异(P>0.05)。
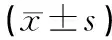
表1 血清黄嘌呤氧化酶(XO)水平比较
注:与A组比较,**P<0.01;与B组比较,#P<0.05,##P<0.01
3.3 血清IL-17、IL-23水平比较
如表2所示,经灌胃造模后,大鼠血清IL-17、IL-23水平明显升高,从对照组(0.05±0.02)pg/ml,(0.03±0.01)pg/ml,升高至(41.64±11.23)pg/ml,(29.88±7.99)pg/ml,(P<0.05), 痛风泄浊方高剂量组IL-17、IL-23水平较模型组明显降低(23.65±6.85)pg/ml,(17.88±4.63)pg/ml,(P<0.05或P<0.01),痛风泄浊方中剂量组IL-17、IL-23水平也明显降低(32.94±8.86)pg/ml,(9.67±5.97)pg/ml,(P<0.05或P<0.01),低剂量组与阳性对照组比较无明显差异(P>0.05)。
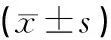
表2 血清IL-17、IL-23水平比较
注:与A组比较,**P<0.01;与B组比较,#P<0.05,##P<0.01
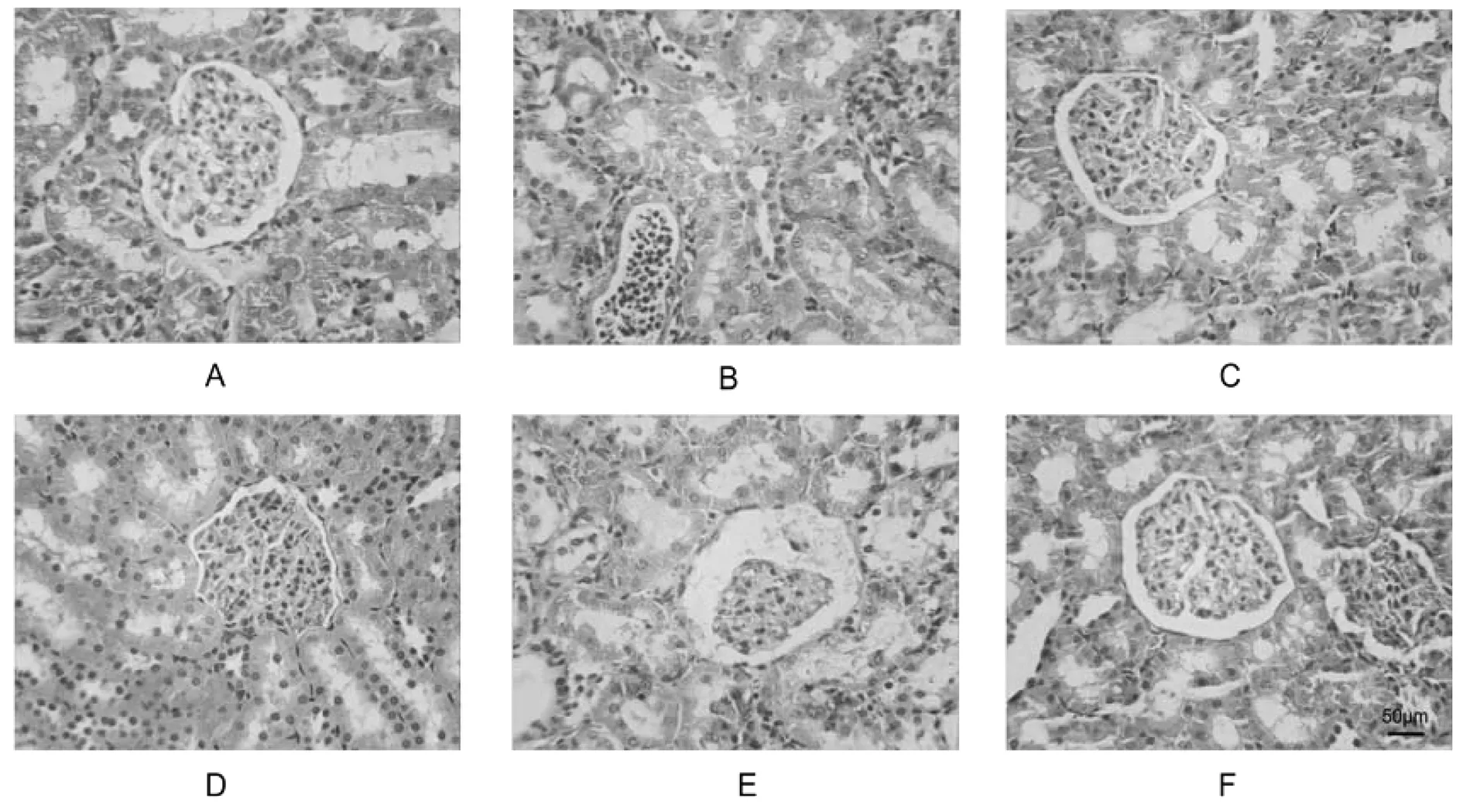
图1 肾组织病理学改变(HE染色,400×)
3.4 肾组织病理学改变
如图1所示。对照组:肾组织结构正常,正常形态肾小球,结构清楚、无硬化萎缩,肾间质未见炎性细胞浸润,间质区及管腔内未见尿酸盐结晶沉积,肾近曲及远曲小管上皮细胞未见肿胀,脱落,空泡变性表现,管腔无扩大。模型组:大量肾小球出现萎缩现象,硬化,肾间质可有大量炎性细胞浸润表现,间质区及管腔内有较多尿酸盐结晶沉积,大量肾小管上皮细胞出现水肿,脱落,空泡变性,管腔扩张明显。痛风泄浊方高剂量组:少量肾小球有萎缩现象,但无硬化,肾间质可有少量散在炎性细胞浸润表现,间质区及管腔内偶见尿酸盐结晶沉积,小部分肾小管上皮细胞出现水肿,脱落,空泡变性,管腔无明显扩张。痛风泄浊方中剂量组:部分肾小球有萎缩现象,但无硬化,肾间质可有少量散在炎性细胞浸润表现,间质区及管腔内可见少量尿酸盐结晶沉积,部分肾小管上皮细胞出现水肿,脱落,空泡变性,部分管腔明显扩张。痛风泄浊方低剂量组:部分肾小球出现萎缩、硬化,肾间质大量炎性细胞浸润,间质区及管腔内可见较多尿酸盐结晶沉积,大量肾小管上皮细胞表现出水肿、脱落及空泡变性等特点,管腔扩大明显。别嘌醇组:部分肾小球出现萎缩、硬化,肾间质少量炎性细胞浸润,间质区及管腔内可见少量尿酸盐结晶沉积,部分肾小管上皮细胞表现出水肿、脱落及空泡变性等特点,部分管腔明显扩张。
3.5 肝组织XO水平
由表3与对照组比较,模型组大鼠肝组织XO水平明显升高(P<0.01),经痛风泄浊方高/中剂量预治疗,XO水平明显降低(P<0.05或P<0.01),而低剂量组与模型组比较无明显差异(P>0.05)。
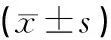
表3 肝脏组织黄嘌呤氧化酶(XO)水平比较
注:与A组比较,**P<0.01;与B组比较,##P<0.01
3.6 肾脏组织中IL-17、IL-23表达
如图2所示,免疫组化结果显示:对照组大鼠肾组织内可见到IL-17、IL-23表达微弱;病变组织内IL-17、IL-23蛋白表达面积增加,颜色深,半定量分析统计数据显示,平均光密度较对照组明显升高(P<0.05),与模型组比较,痛风泄浊方高、中剂量组大鼠肾组织内IL-17、IL-23平均光密度明显降低(P<0.05),中剂量组和别嘌醇组较模型组平均光密度有下降趋势,但无统计学差异(P>0.05)。结果见表4。
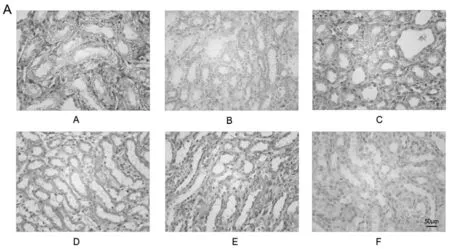
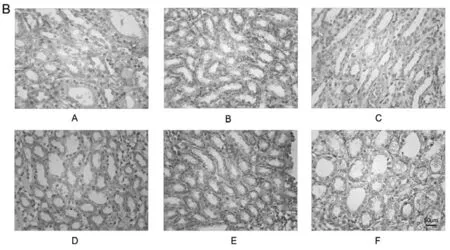
图2 肾脏组织中IL-17、IL-3表达情况比较

组别nIL-17IL-23对照组(A)100.397±0.0670.185±0.049模型组(B)100.693±0.094**0.498±0.091**痛风泄浊方高剂量组(C)100.467±0.066#0.301±0.010#痛风泄浊方中剂量组(D)100.508±0.087#0.395±0.072#痛风泄浊方低剂量组(E)100.602±0.0960.446±0.083别嘌醇组(F)100.612±0.1080.417±0.089
注:与A组比较,**P<0.01;与B组比较,##P<0.01
4 讨论
高尿酸血症(HUA)是一种常见的非传染性代谢性疾病,随着物质生活改善、膳食搭配比例改变以及人口老龄化,高尿酸血症患病率在国内外均呈上升趋势。鉴于高尿酸血症的高患病率及与其他疾病并发,世界卫生组织将高尿酸血症列入代谢综合征范畴,已成为继糖尿病之后的第二大代谢类疾病,对其防治刻不容缓[2]。
HUA的发生有基因缺陷、尿酸合成增多或(和)排泄障碍等。前期的研究发现,HUA常伴发高血压、脂代谢紊乱、糖代谢异常、肥胖等,因此慢性低毒炎症反应贯穿始终;痛风是尿酸盐微结晶触发体内炎症反应而导致的急性发作,由此我们是否也可以推测在未发展至痛风的长期高尿酸血症的患者其体内也存在慢性低度炎症,从而引发血管内皮损伤[9]。炎性细胞因子具有多种生物学效应,是一类主要由免疫系统细胞生成的内源性多肽,亦可介导多种免疫反应。近几年,人们对代谢性疾病的发病机制的研究不断深入,多项研究指出:低度的慢性的系统性炎性反应也是代谢性疾病发生的核心之一,同时也是代谢综合征各个组分间的联系点和纽带。因此,本文从炎症因子的角度探讨高尿酸血症的发生机制及痛风泄浊方的治疗机制。
IL-17是首次在小鼠体内发现的新型促炎性细胞因子[10],2007年发现IL-17是由一类从CD4+T细胞分化而来的名为Th17的细胞分泌的[11-12],目前研究已证实,IL-17与多种自身免疫病发病机制有关,被认为具有介导炎性反应、自身免疫性疾病等重要免疫调节作用[13-15]。IL-23是IL-12分子家族中的促炎性细胞因子,参与机体控制 感染和自身免疫性疾病发生[16]。IL-23对于维持Thl7细胞增殖和存活有重要的意义和作用,IL-23还可以显著增强IL-17的分泌和产生[17]。本研究发现,HUA血清及组织中IL-17及IL-23水平和表达均明显升高,提示细胞因子是HUA病理过程中重要的发病机制,而痛风泄浊方在降低血尿酸水平,改善肾损伤能的同时,有效抑制血清及组织IL-17及IL-23水平和蛋白表达,表明痛风泄浊方可能通过抑制炎性细胞因子起到降低血尿酸的治疗作用。
现代医学认为,HUA患病原因总体归于尿酸生成增多或(和)排泄障碍两方面因素[18-19]。尿酸生成方面,现代医学认为体内参与嘌呤代谢相关酶的活性异常是导致尿酸合成增多的重要因素,其中XO作为嘌呤代谢终末阶段的关键酶,直接调控尿酸的合成,影响显著并且也已成为开发降尿酸新药的重要靶点[20]。本研究发现,模型大鼠血清及组织中XO水平明显增高,高、中剂量的痛风泄浊方能有效改善这种高XO状态,提示痛风泄浊方可能通过抑制XO活性起到降低血尿酸的治疗作用。但XO与IL-23/IL-17在HUA发病过程中的因果关系,目前尚未见任何报道,这些研究内容将是我们课题组今后重点研究的重点。
综上,痛风泄浊方可有效降低实验大鼠血尿酸水平,改善肾功能,改善实验大鼠肾脏病理损害,保护修复肾单位,减轻肾组织炎症反应。痛风泄浊方降低血尿酸水平的机制可能与抑制实验大鼠血清及肝XO活性,下调肾小管IL-17/IL-23蛋白表达有关。
