透明质酸修饰的中药提取物咖啡酸脂质体的制备及初步细胞学研究
2018-07-12赵玉玺魏莹陈钏杨兰张帆
赵玉玺,魏莹,陈钏,杨兰,张帆
(川北医学院药学院,药物研究所,四川 南充 637000)
恶性肿瘤已经成为威胁人类生命安全的第二大疾病,目前呈高发趋势[1-2]。常规化疗药物在肿瘤部位浓度低、选择性差、对正常的组织或器官可产生明显的毒性作用,从而引起严重不良反应[3-4]。中药作为天然产物,具有效果好、不良反应少、抗药性低等特点,目前从中药成分中探索抗肿瘤作用,已经成为研究热点[5-7]。咖啡酸(caffeic acid,CA)是一种酚酸类化合物[8],化学名为3-(3,4-二羟基苯基)-2-丙烯酸,广泛存在于小蓟、金银花、杜仲、牛至、茵陈蒿、蒲公英等多种药用植物中,其药理作用包括心血管保护、抗氧化[9]、抗病毒等[10]。近年来研究发现,咖啡酸及其衍生物还具有抗肿瘤的作用,对肝癌[11]、结肠癌[12]、口腔癌[13]等多种癌症均有抑制作用。但咖啡酸是脂溶性药物,体内吸收差,使其临床应用受到很大的阻碍。脂质体是一种具有良好生物相容性的纳米递药系统[14],脂质体包封脂溶性药物可以有效地提高其在体内的生物利用度,增强疗效,同时脂质体表面修饰配体是构建主动靶向脂质体的重要方式,能够使其靶向到特异性组织[15]。
透明质酸(hyaluronic acid,HA)是一种天然多糖,是目前研究较多的一种主动靶向配体,透明质酸及其衍生物可与细胞表面受体CD44特异性结合[16]。HA受体在多种恶性肿瘤细胞表面高表达,如肺腺癌、卵巢癌、乳腺癌等[17],因此表面经透明质酸及其衍生物修饰的脂质体可靶向递送抗肿瘤药至HA受体高表达的肿瘤细胞和组织。本研究选取透明质酸(HA)为主动靶向的配体修饰载咖啡酸的脂质体(HA-CA脂质体),增加CA的抗肿瘤效果,同时达到靶向治疗的目的。
1 仪器与材料
1.1 仪器
ALPHA 2-4 LSC冻干机(德国Christ公司);RE-52AA旋转蒸发仪(上海青浦泸西仪器厂);Agilent 1100 Series高效液相色谱仪(美国安捷伦公司);CJ-2S超净台(江苏天润仪器有限公司);DM-IL倒置显微镜(德国徕卡公司);TGL-16G-A离心机(上海安亭科学仪器厂);Forma Series细胞培养箱(美国Thermo Scientific公司);恒温摇床(北京同正生物技术发展有限公司);Model 550酶联分析仪(美国 BIORAD 公司);100 μL、1 000 μL移液枪 (美国Thermo Scientific公司);Thermo Array scan VTI 高内涵筛选仪(Thermo Scientific)。
1.2 药品与试剂
咖啡酸、DOPE、大豆磷脂、胆固醇、MTT、Hochest 33258(美国Sigma公司);透明质酸钠(Mw=8 000 Da)(山东福瑞达生物化工有限公司);胎牛血清(FBS,美国GIBCO 公司);胰酶(美国Hyclone公司);DMEM培养基(美国HyClone公司);6-香豆素(日本TCI公司8LUEF-CC);其余试剂为分析纯。
人肺腺癌A549细胞(川北医学院);人肝癌HepG2细胞(川北医学院)。
2 方法与结果
2.1 HA-DOPE的制备[18]
称取HA 30 mg,置10 ml蒸馏水中溶胀后超声溶解。加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)60 mg和N-羟基硫代琥珀酰亚胺(NHS)90 mg,加氢氧化钠溶液调至pH值7.5,于37℃水浴活化24 h。持续搅拌下滴加含DOPE 72 mg的混悬液,反应过夜。透析除去反应液中多余反应物和副产物,经薄层色谱(展开剂:氯仿-甲醇-水,65:25:4,碘蒸气显色)验证,反应液中已无游离DOPE存在,冷冻干燥即得。
2.2 HA-CA脂质体的制备
精密称取卵磷脂120 mg,胆固醇30 mg(磷脂比为4∶1),咖啡酸5 mg于茄型瓶中,加入氯仿丙酮混合溶剂10 ml(氯仿:丙酮体积比为4∶1),超声使其充分溶解,置于旋转蒸发仪中将溶剂蒸出。加入3 ml(pH值7.4)PBS磷酸盐缓冲溶液和2 ml HA-DOPE的PBS溶液(HA-DOPE含量为1 g/L)后在60 ℃水浴条件下水化1 h,即得。
2.3 HA-CA脂质体的粒径测定
取脂质体适量,用超纯水稀释后用动态光散射粒径分析仪测定粒径,测得平均粒径、多分散系数(PDI),结果见图1。平均粒径为210.5 nm,PDI为0.17,粒径分布较窄,脂质体粒径较均匀。
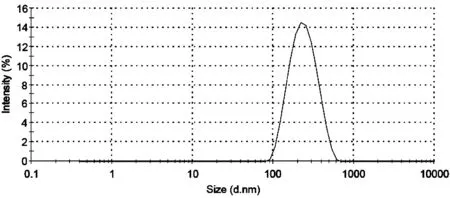
图1 粒径分布图
2.4 咖啡酸体外含量测定方法的建立
2.4.1色谱条件[19]
Agilent C18色谱柱(4.6 mm×150 mm,5 μm);流动相为甲醇:0.1%磷酸水溶液(15∶85);检测波长为327 nm;流速为1.0 mL/min;进样量为5 μL;柱温为35℃。
2.4.2标准曲线的绘制
精密称取咖啡酸原料药适量,用甲醇溶解,制备成质量浓度分别为0.1、0.2、0.4、0.6、0.8 g/L的梯度标准溶液,0.22 μm微孔滤膜过滤,备用。在“2.4.1”的色谱条件下测定咖啡酸的峰面积,以峰面积为纵坐标,浓度为横坐标绘制标准曲线,得咖啡酸的标准曲线方程Y=28 883X-19.506,R2=0.999 4,表明咖啡酸在0.1~0.8 g/L浓度范围内线性关系良好。
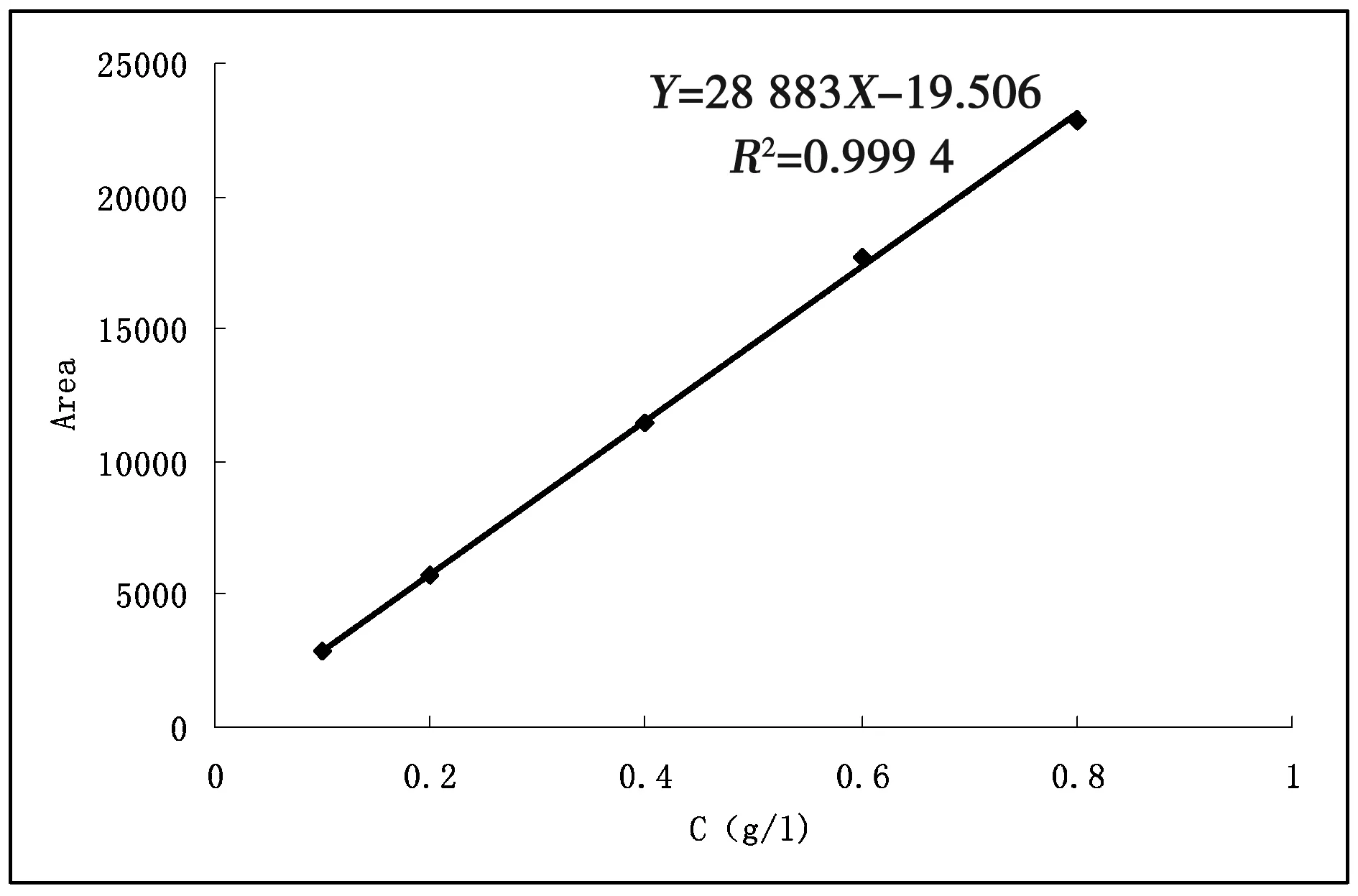
图2 咖啡酸标准曲线图
2.4.3精密度试验
精密吸取浓度为0.2 g/L的咖啡酸样品溶液,在“2.4.1”色谱条件下测定,共6次,RSD为1.22%(n=6),表明仪器精密度良好。
2.4.4稳定性试验
精密吸取浓度为0.2 g/L的咖啡酸样品溶液进样测其稳定性,每3 h测定1次,共6次,RSD为1.11%(n=6),表明咖啡酸样品在15 h内稳定性良好。
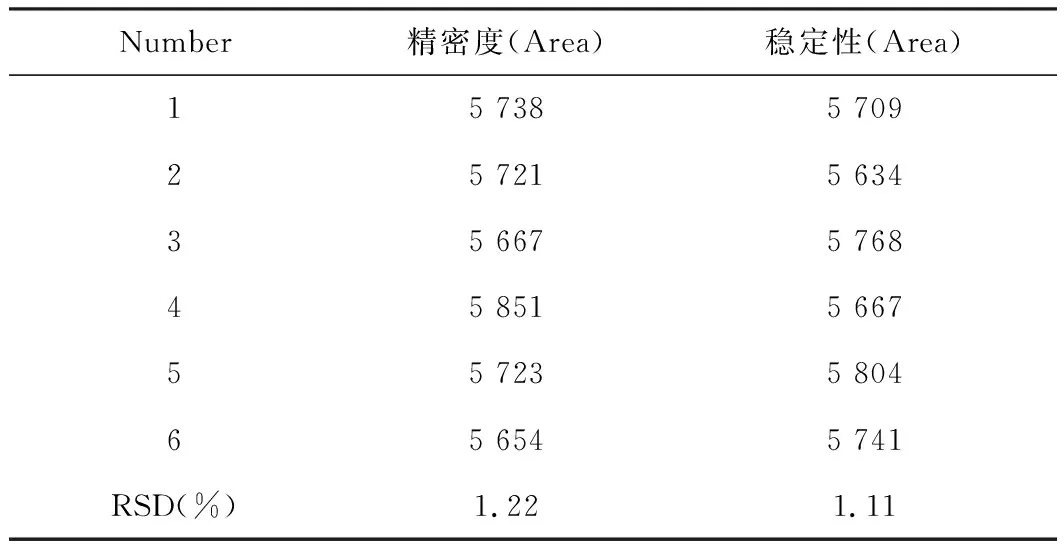
表1 精密度和稳定性试验结果
2.4.5回收率试验
精密量取浓度为0.4 g/L的咖啡酸样品溶液适量,按比例加入HA空白脂质体1 mL,用流动相配成高、中、低3种质量浓度的咖啡酸脂质体溶液,每种5份,加甲醇破坏脂质体,稀释定容至刻度,摇匀,离心吸取上清液,在“2.4.1”项色谱条件下测定。结果回收率分别为98.2%、99.5%、98.6%。
2.5 HA-CA脂质体包封率的测定
采取离心法测定脂质体的包封率。量取HA-CA脂质体溶液2 mL,置于离心管中,14 000 r/min转速下离心30 min,下层沉淀部分即为制备的咖啡酸脂质体。小心倒去含有游离咖啡酸的上层溶液,用甲醇溶液超声20 min溶解底部的咖啡酸脂质体后置5 ml容量瓶中定容,在“2.4.1”的色谱条件下测定咖啡酸的峰面积,代入标准曲线,按外标法计算咖啡酸的含量,并计算HA-CA脂质体的包封率。连续测定5批脂质体,得到HA-CA脂质体的包封率为(88.87±1.32)%。
包封率公式如下:包封率(CA)=MCA/M×100%,其中MCA为消解后测得CA的浓度,M为制备时加入的CA的量。
2.6 HA-CA脂质体的细胞毒性实验
分别培养A549细胞(HA受体高表达)和HepG2(HA受体低表达)并接种于96孔板中,当孔板中细胞完全贴壁且处于对数生长期时,以含10%FBS的培养基为空白对照组,以未经药物处理过的细胞悬液为阴性对照组,加入3个浓度(5、15、30 μL/ml)的游离CA、CA脂质体以及HA-CA脂质体。继续培养48 h后取出,每孔加入MTT 20 μL(20 g/L) 溶液,再放回孵箱中继续孵育4 h。离心,弃上清,每孔加入200 μL DMSO,振荡10 min,用酶标仪在490 nm 处测定各孔的光密度值(OD)。计算空白脂质体、游离CA、CA脂质体以及HA-CA脂质体对A549细胞和HepG2细胞的增殖抑制率。
细胞抑制率=[1-(OD实验组-OD空白组)/(OD阴性对照组-OD空白组)]×100%
实验结果如图3~4所示,随着药物浓度的增加A549细胞和HepG2细胞的增殖抑制率增强。在相同给药浓度下,HA-CA脂质体对A549细胞的增殖抑制作用显著强于CA脂质体,最高达80.11%,而对于HepG2细胞来说,HA-CA脂质体的增殖抑制作用与CA脂质体相当。
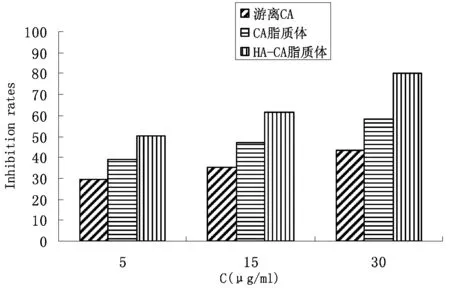
图3 细胞抑制率图(A549,48 h)
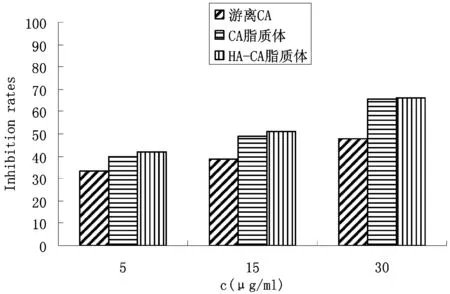
图4 细胞抑制率图(HepG2,48 h)
2.7 细胞摄取实验
精密称取6-香豆素0.5 mg于10 ml容量瓶中,加二氯甲烷溶解,配制成0.05 g/L的6-香豆素储备液。另精密称取卵磷脂120 mg,胆固醇30 mg(磷脂比为4∶1),加入氯仿丙酮混合溶剂10 ml(氯仿:丙酮体积比为4∶1),超声使其充分溶解,加入1 ml香豆素溶液,置于旋转蒸发仪中将溶剂蒸出,直至在瓶壁上形成均匀的脂质膜。加入3 ml(pH值7.4)PBS磷酸盐缓冲溶液和2 ml HA-DOPE的PBS溶液(HA-DOPE含量为1 g/L),在60℃水浴条件下水化1 h,即得。
分别将培养24 h的A549细胞和HepG2细胞悬液(密度为10×104个/mL)弃去培养基,将6-香豆素DMSO溶液、HA-C脂质体加药,每孔加入1 mL,继续于37℃孵育2 h;弃去培养基,并以冷的PBS洗2次;再以4%多聚甲醛固定10 min;再用冷的PBS洗2次;以Hochest 33258 (2.5 μg/mL)染细胞核15 min后,再以PBS洗1次,最后置于高内涵仪中分析结果。
实验结果表明,在HepG2细胞组,6-香豆素和HA-C脂质体组的荧光摄取量并未存在明显差异。在A549细胞组,HA-C脂质体的荧光摄取量明显高于6-香豆素。该种现象提示,HA脂质体在HA受体高表达的A549细胞组的细胞摄取明显大于在HA受体低表达的HepG2细胞,初步证明HA脂质体的细胞靶向性。结果见图5~6。
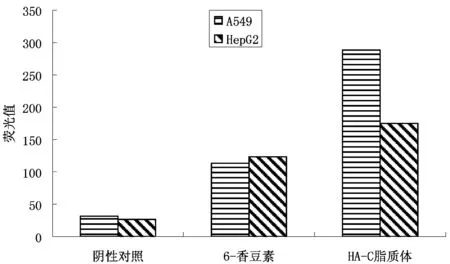
图5 细胞摄取荧光值图
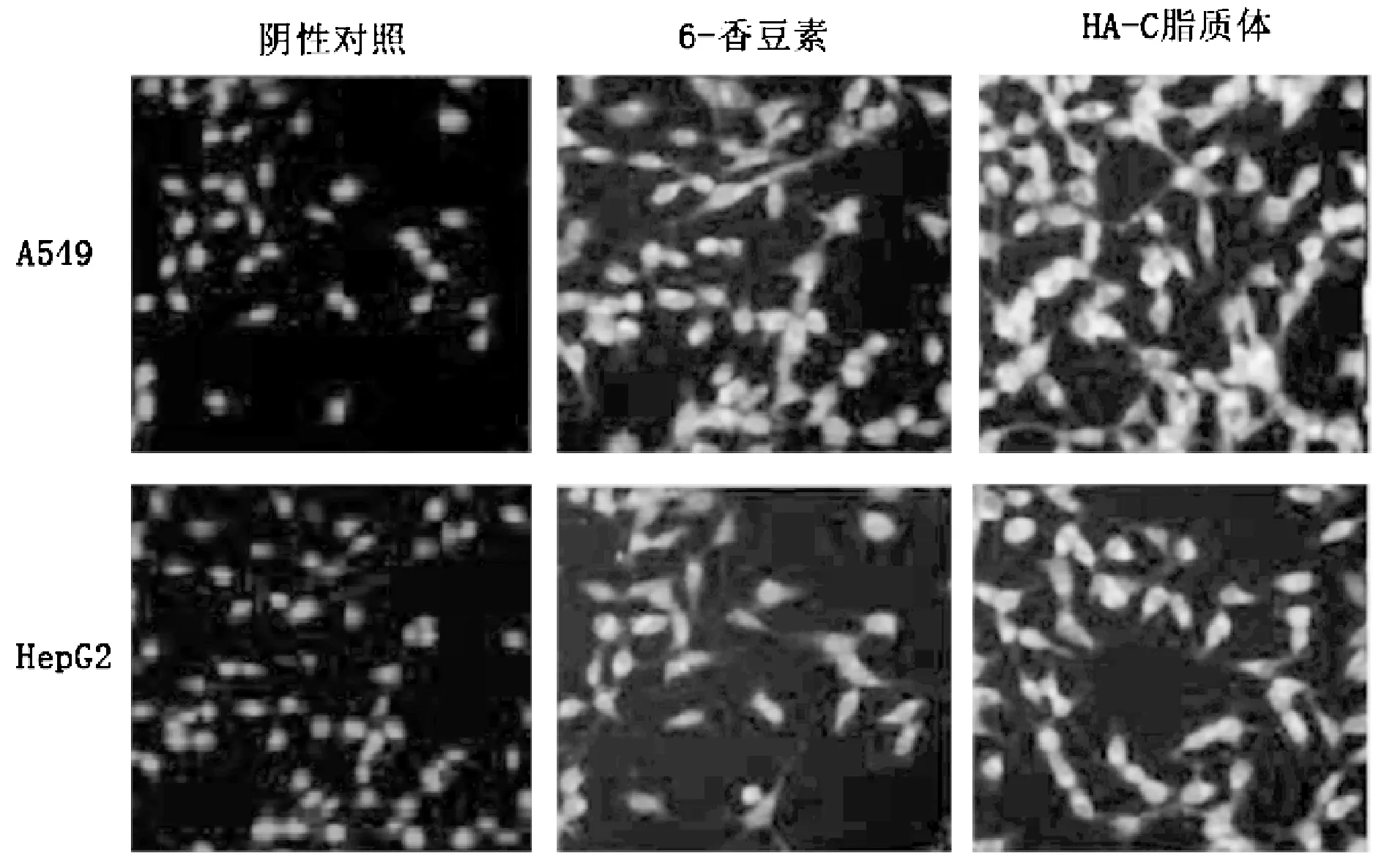
图6 细胞摄取图
3 讨论
本文以HA为主动靶向配体,脂质体为药物载体,构建了HA-CA脂质体,用以改善CA自身理化性质的局限,从而达到增强CA抑制肿瘤作用的目的。MTT实验结果显示,与游离CA相比,将CA包载至脂质体后的CA脂质体可增强其对A549细胞和HepG2的细胞毒性。另外,HA-CA脂质体对高表达HA受体的A549的细胞毒性显著大于CA脂质体,而对于低表达HA受体的HepG2细胞而言,HA-CA脂质体与CA脂质体的细胞毒性作用相当,说明HA-CA脂质体由于HA主动靶向配体的加入,使其能主动靶向至HA受体高表达细胞,增强药物对细胞的毒性作用。细胞摄取实验同样证明,HA-CA能够增强HA受体高表达细胞A549的细胞摄取率,从而提高药效。关于HA-CA脂质体的主动靶向通路以及其体内抑制肿瘤能力等还有待进一步研究。
