天然牛磺酸对人肝星状细胞增殖与凋亡的影响
2018-07-12黄宇黄凤柳邓鑫郭群陈绮华周蒙
黄宇,黄凤柳,邓鑫,郭群,陈绮华,周蒙
(1.广西中医药大学,广西 南宁 530001;2.广西中医药大学附属瑞康医院,广西 南宁 530011)
肝星状细胞(Hepatic Stellate Cell, HSC)已被证实是肝纤维化发生、发展的至要环节,在多种慢性肝病(如肝硬化、肝癌等)的病理进程中扮演重要作用,以其靶向抗肝纤维化的有关研究已成为当前炙热的探讨领域。天然牛磺酸(Natural Taurine, NTau)是从天然的新鲜海鲜产品中提炼萃取的牛磺酸,β-氨基乙磺酸(人体的一种条件必需氨基酸)为其有效的药理化学成分,具有多样生理化学活性,可抑制大鼠HSC增殖、促进其凋亡,具有一定的抑制大鼠肝纤维化作用[1-2]。但其对人HSC是否也有类似作用,目前并未见相关报道。本实验通过将NTau含药血清干预体外培养的人HSC-LX2细胞孵育,以期探讨不同浓度NTau含药血清对人HSC-LX2细胞的作用及其具体作用机制。
1 材料及方法
1.1 材料
人肝星状细胞系HSC-LX2(上海盖宁生物科技有限公司);Tunel检测阳性对照制备试剂盒(南京凯基生物科技有限公司);四季清胎牛血清(浙江天杭生物科技股份有限公司);DMEM/HIGH高糖培养基(HyClone)等购自南宁市慧研实验器材经营部;天然牛磺酸(NTau,上海国药控股股份有限公司);噻唑蓝(MTT,Amresco);PBS缓冲液(北京索莱宝生物科技有限公司);胰蛋白酶-EDTA消化液(0.25%,北京索莱宝生物科技有限公司)。
1.2 方法
1.2.1细胞培养
HSC-LX2细胞在37 ℃、5%CO2外周环境及饱和湿度等适宜条件下,用含有胎牛血清(10%)、青霉素(100 U/mL)、链霉素(100 μg/mL)、谷氨酰胺(4 mmol/mL)的培养液(RPMI 1640)常规培养,取处于对数生长期的细胞进行后续实验。
1.2.2分组及给药
将HSC-LX2细胞连续培养至70%融合状态,加入胰酶(0.25%)消化,以1∶3的比例传代培养。将处于对数生长期的HSC-LX2细胞以一定密度(5×105/mL)于24孔板中接种。此时细胞将分为4个实验组:空白对照组加等量含胎牛血清(10%)的培养液(RPMI 1640); NTau低、中、高剂量组加等量含胎牛血清(10%)和相应NTau(3.0、6.0、9.0 μg/mL)的培养液(RPMI 1640),共培养1天。
1.2.3MTT法检测 HSC-LX2细胞的增殖抑制率
根据所描绘的生长曲线选取处于对数生长期的HSC-LX2细胞,消化、分离,以一定密度(5×105/mL)于24孔板中接种,每孔100 μL。待培养至细胞贴壁生长后再丢弃原培养液,按“1.2.2”项下的方法分组、给药,继续培养1天,每孔加入MTT 20 μL,培养4 h后在酶标仪一定波长处(490 nm)测定各孔的光密度值(optical density,OD),前后共重复测定3次,然后取各组的平均值,计算出各组细胞的增殖抑制率。
抑制率%(IR)=[(1-药物组OD值)/对照组OD值]×100%
1.2.4TUNEL法检测 HSC-LX2细胞凋亡
遵照上述的方法继续培养HSC-LX2细胞2天至细胞完全贴壁生长后,加入含各剂量NTau的DMEM培养液2 mL(药物终剂量分别为3.0、6.0、9.0 μg/ml),同样的方法加入工作液培养2天后,用多聚甲醛(4%)固定细胞,严格依照TUNEL凋亡试剂盒的具体要求操作,于荧光显微镜下观察、拍照,计算出各组凋亡阳性的细胞数及其凋亡细胞率,红色为已凋亡细胞之细胞核,蓝色则为尚未凋亡细胞之细胞核,然后计算出各组细胞的凋亡率。
凋亡率(%)=(凋亡细胞数目/总细胞数目)×100%
1.2.5流式细胞术检测 HSC-LX2细胞凋亡
遵照上述的方法培养HSC-LX2细胞2天至细胞完全贴壁生长后,将上清液丢弃,收集剩下的细胞;加入事先已预冷的PBS液(3 mL 4℃)清洗细胞;加入事先已预冷的75%乙醇(-20℃)冰浸留夜;用PBS洗2次后加入2 μL RNase A (1 mg/mL),37 ℃温水淋浴40 min后再加入100 μL碘化丙啶液(100 μg/mL)暗光染色0.5 h(室温下,浓度同RNase A液)。用流式细胞仪分析系统(Epics XL)以104个细胞的速率检测每份样本细胞(以50~60个细胞/sec的检测速率,并以氩离子激光器光所激发出来的488 nm和633 nm波长的长波通滤片阻断)。系统自动计算并分析出各组周期细胞所占据的相应百分比及其细胞凋亡情况。
1.3 统计学处理
2 结果
2.1 HSC-LX2细胞增殖情况比较
结果表明,NTau可抑制HSC-LX2的细胞增殖,且其细胞增殖抑制率随NTau剂量的增加而相应升高(P<0.05)。结果见表1。
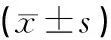
表1 HSC-LX2细胞增殖情况比较
注:与空白对照组比较,1)P<0.05;与低剂量NTau组比较,2)P<0.05;与中剂量NTau组比较,3)P<0.05;与高剂量NTau组比较,4)P<0.05
2.2 HSC-LX2细胞凋亡和细胞周期分布情况比较
结果见表2,NTau可促进HSC-LX2的细胞调亡,且其细胞凋亡率随NTau剂量的增加而相应升高(P<0.05);且处于G0/G1期的细胞百分比明显增高,而处于S期、G2/M期的细胞百分比则明显降低。
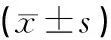
表2 HSC-LX2细胞凋亡率和细胞周期分布情况比较
注:与空白对照组比较,1)P<0.05;与低剂量NTau组比较,2)P<0.05;与中剂量NTau组比较,3)P<0.05;与高剂量NTau组比较,4)P<0.05
3 讨论
肝纤维化系各种慢性肝病的病理性基础,HSC则是肝脏中主要产生胶原的细胞,其激活可促进肝纤维化的进展;如果能够抑制HSC的活化与增殖,在理论上则可减少甚至逆转肝纤维化的发生和发展[3]。因此,有关抑制HSC的增殖或诱导活化后HSC凋亡的研究正日益炙热起来。牛磺酸具有多样性生物学功能,既是人体内的一种重要的营养物质,也是中药牛黄中的主要有效药理成分。研究表明,牛磺酸具有减轻肝脏损伤、调节机体免疫机能、改善氧化应激状态、降低促炎细胞因子等多种生物学效应[4-5]。课题组前期研究发现,NTau可通过下调一些相关细胞因子/趋化因子,并减少内质网应激反应等来显著减轻肝纤维化的进展程度[6-7]。导师所在课题组亦研究发现,NTau抑制肝纤维化的作用要胜过人工合成的牛磺酸,且谷胱甘肽途径、神经鞘脂途径和硫胺代谢途径等在调节牛磺酸干预HSC的过程中起着至关重要的作用[8-9]。
HSC活化的其中一个显著特征就是旺盛的细胞增殖与复制,是导致肝纤维化发生、发展的最直接原因。无疑就是HSC活化及增殖后自身数量的增加加上细胞积聚引起的ECM合成和沉积量的增加。通过采用TUNEL法联合流式细胞术检测各实验组细胞的细胞凋亡率和细胞周期分布情况后发现,各剂量NTau含药血清作用HSC-LX2细胞2天后,处于G0/G1期细胞的百分比均明显增高,而处于S期、G2/M期细胞总数的百分比则明显降低,本研究或可表明含NTau药物血清之所以能抑制HSC的增殖很可能是通过成功阻滞HSC的调控点从G1期朝S期过渡,进而间接抑制DNA的合成及复制,从而最终干预HSC细胞周期,使其不能正常运转。细胞凋亡系机体为了维持自身内环境状态的稳定,由基因整体调控的细胞自主、有序而死亡的主动选择过程,期间涉及许多有关基因的激活、上调以及调控等作用。通过人为诱导活化的HSC凋亡,设法避免或减少HSC的聚积,阻滞ECM的大量合成、沉积,可有望实现抗肝纤维化的目标。本实验通过采用TUNEL法联合流式细胞术检测发现,各剂量NTau组HSC-LX2细胞的晚期凋亡率均明显高于空白对照组(P<0.05);而高剂量NTau组HSC-LX2细胞的晚期凋亡率更是明显高于低、中剂量NTau组(P<0.05)。综上结果表明,不同剂量NTau均可抑制HSC-LX2细胞的增殖、促进HSC-LX2细胞的凋亡,可整体干预肝纤维化的进程,并与其剂量成正相关性。
