紫癜性肾炎肾小球血管病变病理分级的初步探讨
2018-07-09祝旭飞官涛刘军辉侯世会胡成芳李艺唐璐瑶张均黄云剑
祝旭飞,官涛,刘军辉,侯世会,胡成芳,李艺,唐璐瑶,张均,黄云剑
过敏性紫癜(Henoch-Schönlein purpura,HSP)是一种常见的系统性血管炎,通常表现为紫癜性皮疹、腹部症状、关节病或肾脏受累[1-4]。紫癜性肾炎(Henoch-Schönlein purpura nephritis,HSPN)是HSP最严重的并发症,有5%~15%的HSPN儿童最终进展为慢性肾功能衰竭(chronic renal failure,CRF)[5-6],在成人中这一比例约为30%[7]。HSPN的基本病变是全身弥漫性坏死性小血管炎[2]。HSPN目前的临床研究及临床证据主要集中在儿童,成人HSPN尚缺乏严格的循证证据,更缺乏具有代表性的中国人群资料。我国的HSPN治疗方案也与2012年KDIGO指南存在差异。因此,完善我国HSPN病理资料和分级标准对提高我国HSPN诊治水平有重要意义。
肾血管损伤是肾脏疾病发生发展的重要原因之一,目前几种重要的肾脏疾病已经引入肾血管病变损伤分级,如狼疮性肾炎、IgA肾病,这些分级对改善相关疾病的病理认识和预后判断帮助很大。然而目前HSPN仍然沿用1974年国际儿童肾病研究会(ISKDC)的病理分级标准,尽管2000年中华医学会儿科学分会肾脏学组在此基础上对其稍作修改,即在Ⅲ级中除新月体病变外,加入肾小球节段性病变(硬化、粘连、血栓、坏死等),但以上方法均不能全面反映HSPN的肾小球血管损伤程度,因为血管病变是HSPN发生和进展的重要原因,完善HSPN病理分级已经迫在眉睫。本研究调查了140例HSPN患者的肾小球血管病变百分比评分(glomerular vascular lesion percentage score,GVLPS),分析其与ISKDC评分、炎性细胞浸润水平、24h尿蛋白定量、肾小球滤过率估算值(eGFR)、尿红细胞数和血清白蛋白(ALB)的关系,初步了解HSPN血管病变GVLPS评分系统的有效性,以期为今后的大样本研究提供数据支持。
1 资料与方法
1.1 研究对象 收集陆军军医大学附属新桥医院2012年1月-2015年8月确诊的140例HSPN患者的肾活检标本和临床资料进行回顾性分析。入选标准:①明显的皮肤紫癜;②尿液分析异常;③肾活检结果与HSPN病理特征一致;④病程少于1年;⑤未服用抗高血压、激素等药物。排除IgA肾病、血小板减少性紫癜和系统性红斑狼疮等系统性疾病。本研究经陆军军医大学伦理委员会批准,肾活检均在获得患者知情同意后进行。患者的基本资料、临床症状、实验室数据和病理学特征均摘自病历。
1.2 肾脏组织病理学检查 将肾活检标本分别按照各标准方法制成组织切片并予特殊染色,进行光学显微镜检查(观察肾小球并计数)、免疫荧光检查(免疫荧光强度分为0-3级:0=阴性,1=轻度,2=中度,3=重度)及透射电子显微镜检查。取20例形态学正常的人肾肿瘤切除标本(获取的组织部位未受肿瘤影响)作为对照组。
1.3 GVLPS的定义 所有标本由2名有经验的病理医师独立检查。每张切片至少检查10个肾小球,评估每个肾小球的血管病变情况。本研究参照Sato等[8]对肾小球损伤的积分标准和Wu等[9]对狼疮性肾炎血管病变的描述等并加以修改,提出了GVLPS标准。GVLPS定义为:具有血管内皮细胞增殖、血管玻璃样变、血管纤维素样坏死、内皮下嗜复红物沉积、细胞新月体、纤维新月体、节段性硬化或球硬化症的肾小球数/全部被观察的肾小球数×100%。GVLPS分级(histopathological grade,HG):GVLPS<25%为HG1,25%≤GVLPS<50%为HG2,50%≤GVLPS<75%为HG3,GVLPS≥75%为HG4。对于1个肾小球有多种病变病理类型的,只计为1个病变肾小球,不重复计算。此外分别统计每张切片中各病理类型的肾小球占全部肾小球的百分比,但不计入GVLPS评分。
1.4 ISKDC分类 根据ISKDC分类标准,将所有肾脏病理结果分为6类(Ⅰ-Ⅵ型)。Ⅰ型:微小肾小球异常;Ⅱ型:无新月体的肾小球系膜增生;Ⅲ型:局灶性节段性(Ⅲa)或弥漫性(Ⅲb)肾小球系膜增殖,新月体数<50%;Ⅳ:肾小球系膜增殖,新月体数50%~75%;Ⅴ型:肾小球系膜增殖,新月体数≥75%;Ⅵ型:膜增生性病变。
1.5 免疫组化检测CD20和CD68的表达 免疫组化染色按照试剂盒说明书进行操作,二抗由北京中杉金桥生物技术有限公司提供,阴性对照以PBS代替一抗。在光学显微镜下观察并拍照,每张切片随机选取10个高倍镜视野(×400),采用Image-Pro Plus 6.0彩色图像分析处理系统检测CD20、CD68在肾小球的表达(不包括肾小球囊壁),在每个肾小球中计数CD20和CD68阳性细胞数,取平均值反映样本指标的表达水平。
1.6 统计学处理 采用SPSS 21.0软件进行统计分析。计量资料以±s或中位数(范围)表示,多组正态分布资料比较采用单因素方差分析,进一步两两比较采用LSD-t检验,非正态分布资料组间比较采用秩和检验;计数资料以构成比或率表示,多个样本间比较采用χ2检验,等级资料组间比较采用秩和检验;相关性分析采用Pearson或Spearman检验。P<0.05为差异有统计学意义。
2 结 果
2.1 病例临床特点 收集的140例HSPN患者无选择性偏倚。根据GVLPS评分,140例HSPN患者中包含HG1 37例(26.4%),HG2 46例(32.9%),HG3 40例(28.6%),HG4 17例(12.1%)。加上对照组,所有160例患者中位年龄29.59(9~68)岁,其中男82例,女78例。HG各组间性别、年龄差异无统计学意义(P>0.05),但HG各组年龄明显小于对照组(P<0.05)。自对照组至HG1、HG2、HG3、HG4组,血清肌酐、血尿素氮、24h尿蛋白、尿红细胞水平均随HG积分增加逐渐升高,而eGFR、ALB随HG积分增加逐渐降低。各组间尿酸、胆固醇、甘油三酯和病程差异均无统计学意义(表1)。
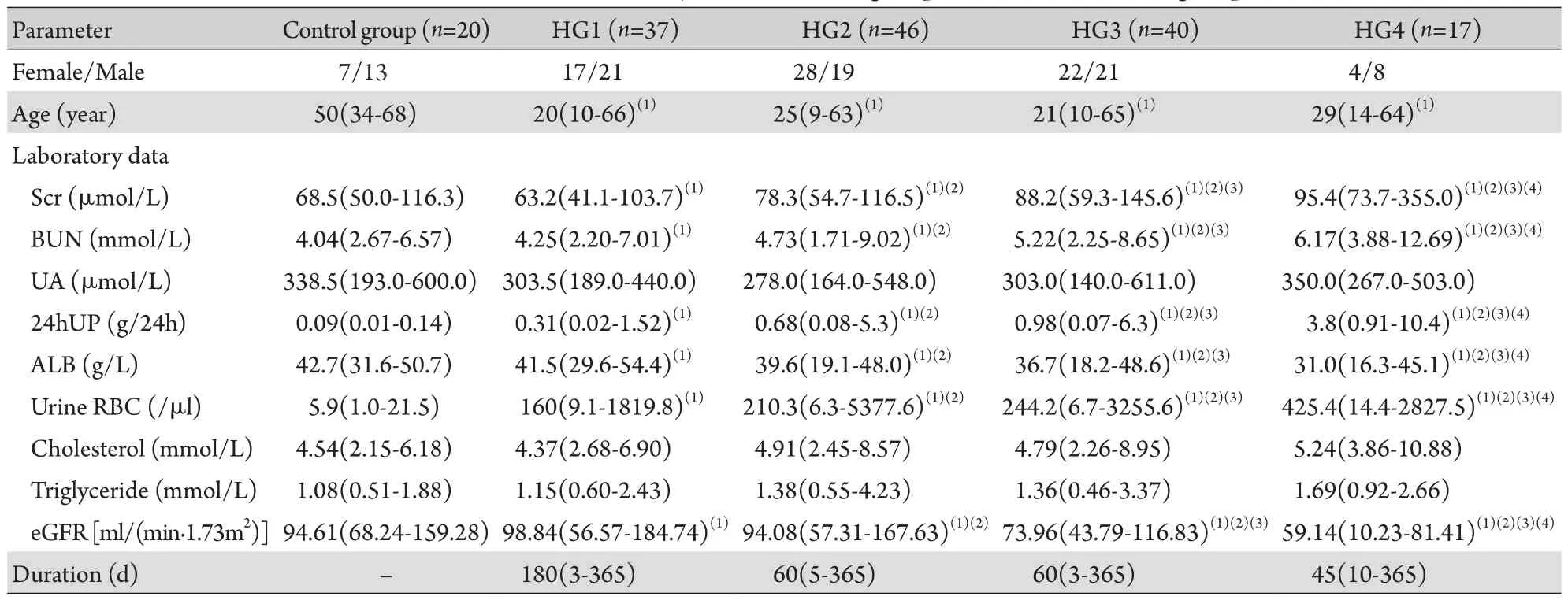
表1 HSPN组与正常对照组的临床和实验室数据Tab.1 Clinical and laboratory data of HSPN group and normal control group
2.2 肾组织学特征 活检标本肾小球数为26(11~43)个。图1显示了HSPN光镜和电镜下的典型病变,其中光镜下可见IgA系膜沉积(图1A)、IgM系膜沉积(图1B)、内皮细胞增生(图1E)、纤维素坏死(图1F)、玻璃样变(图1G)、内皮下嗜复红物沉积(图1H)、细胞新月体(图1I)、纤维新月体(图1J)、节段性硬化(图1K)、球硬化(图1L)等改变,电镜下可见高致密的电子致密物沉积于肾小球系膜区(图1C)和毛细血管壁(图1D)。
2.3 ISKDC分级与GVLPS的关系 根据ISKDC分级标准对肾标本进行分类,结果为43例(30.7%)Ⅰ型,50例(35.7%)Ⅱ型,14例(10%)Ⅲa型,17例(12.1%)Ⅲb型,13例(9.3%)Ⅳ型和3例(2.1%)Ⅴ型,没有标本被列入Ⅵ型。相关分析显示,ISKDC分级与GVLPS呈正相关(r=0.74,P<0.01),且服从线性趋势(χ2=8.233,P<0.01,表2)。但GVLPS能更好地反映血管病变,如列入ISKDC分级Ⅰ-Ⅱ级的患者,若其内皮细胞增生的肾小球数占肾小球总数的50%以上,按GVLPS评分系统就需将其归入HG3,甚至HG4,其疾病预警作用较ISKDC分级明显增强。而处于ISKDC较高级别的大多数患者(Ⅲ、Ⅳ、Ⅴ级),其在GVLPS中也处于较高级别中(HG3、HG4),甚至会因患者血管病变种类增加而进一步提高HG级别。
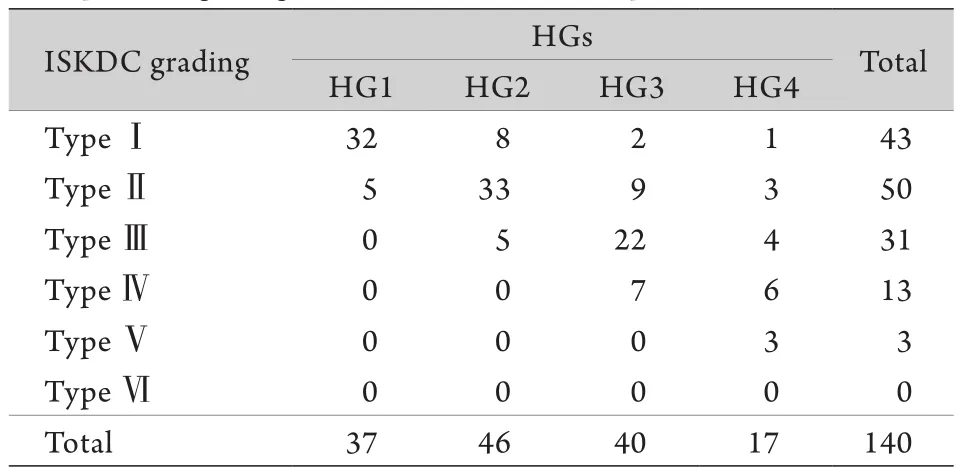
表2 HSPN患者ISKDC分类与组织病理学分级(HG)之间的关系Tab.2 The relationship between ISKDC classification and histopathological grades (HGs) in HSPN patients
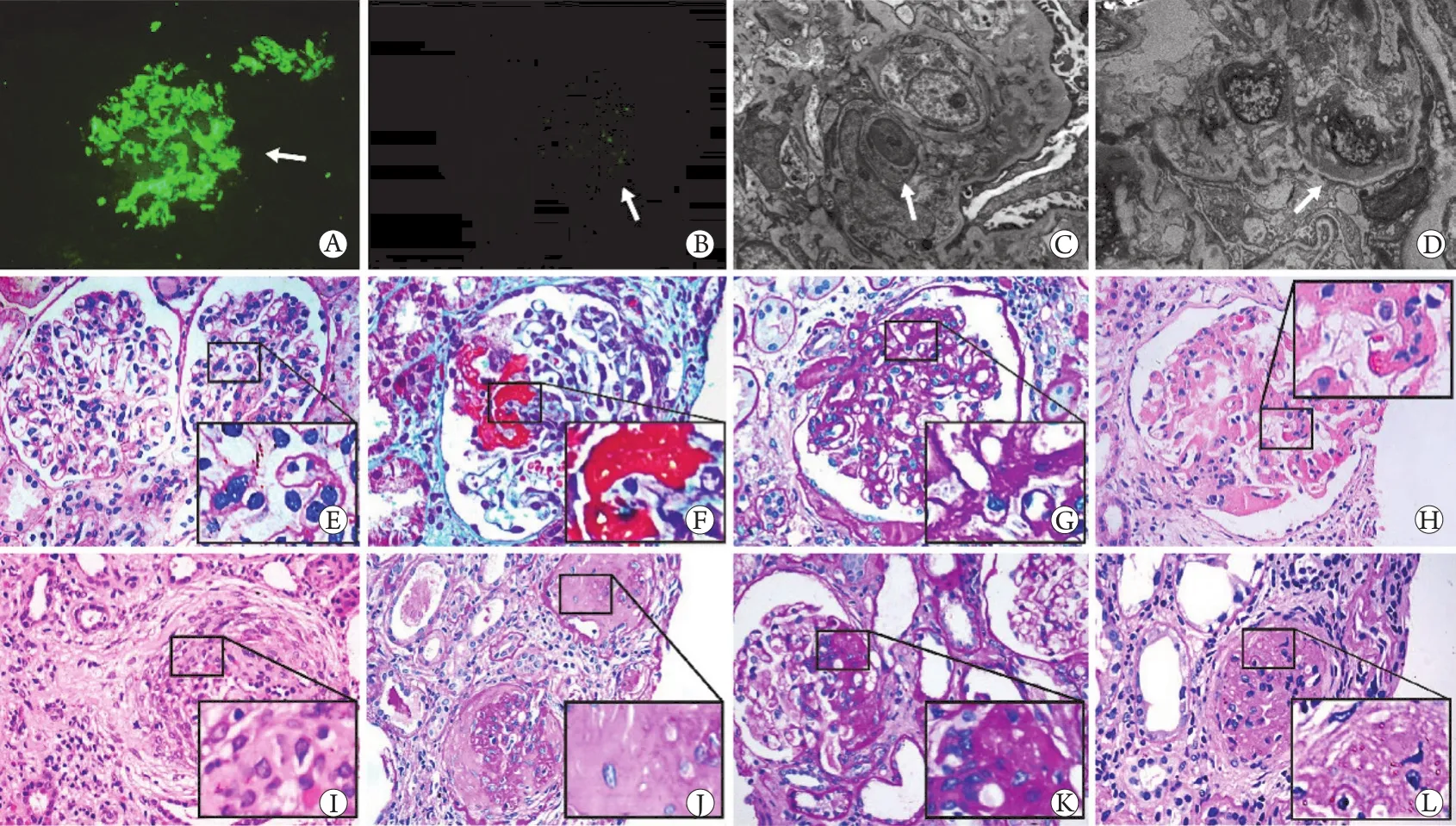
图1 HSPN患者的肾小球组织病理学检查结果Fig.1 Glomerular histopathological findings in HSPN patients
2.4 HG各组病理检查结果比较 各种类型的血管病变从HG1组到HG4组均存在逐渐增多的趋势(表3)。早期血管病变主要是血管内皮细胞增生,随着GVLPS积分增加,从HG2开始逐渐出现透明样变性、纤维素坏死、内皮下嗜复红物沉积、细胞新月体、纤维新月体、节段性硬化和球硬化等病变,由于本研究选择的患者病史均在1年以内,所以透明样变性和球硬化等慢性改变在肾小球占比并不高。另外,免疫荧光结果显示肾小球系膜和毛细血管壁中均有不同程度的免疫球蛋白IgA、IgG、IgM和补体C3沉积,但HG各组均没有发现C4和C1q沉积。HG3和HG4组中IgA的含量明显高于HG1和HG2,IgG和IgM沉积在HG4组中表现最明显(表3)。

表3 各HG组病理检查结果比较Tab.3 Comparison of pathological findings among HG groups
2.5 CD20和CD68的定位和表达 为了量化肾小球中的炎性细胞浸润程度,我们采用免疫组化检测了各肾小球内CD20阳性(CD20+)和CD68阳性(CD68+)细胞的数量,结果发现,对照组少有CD20+和CD68+细胞在肾小球、肾小管及肾间质表达,而在HG组中,CD20+和CD68+细胞主要分散在肾小球系膜区和毛细管腔中,且肾小球CD20+和CD68+细胞数量与对照组相比明显增加。其中,CD20+细胞染色水平从HG1到HG3逐渐增加,但与HG3相比,HG4的CD20+细胞染色水平明显降低(Z=53.181,P<0.01,图2A、C)。与CD20+细胞相似,CD68+细胞染色水平从HG1到HG3逐渐升高,但从HG3到HG4其表达明显下降(Z=64.866,P<0.01,图2B、D)。
2.6 蛋白尿、eGFR、尿红细胞、ALB与GVLPS的相关性 为了研究GVLP与HSPN临床各参数的关系,分析了不同HG组的24h尿蛋白、eGFR、尿红细胞、ALB与GVLPS的相关性,结果发现,GVLPS分级与24h尿蛋白量呈正相关(r=0.6431,P<0.05),HG4组尿蛋白量最高(图3A、E);GVLP与尿红细胞呈负相关(r=–0.5041,P<0.05),HG4组的eGFR水平明显低于HG1和HG2组(图3B、F);GVLP与尿红细胞呈正相关(r=0.3042,P<0.05),HG3、HG4组尿RBC数明显高于HG1组(图3C、G);GVLP和ALB呈负相关(r=–0.3502,P<0.05),HG4组的ALB水平明显低于HG1和HG2组(图3D、H)。

图2 肾小球CD20+和CD68+免疫组化检测Fig.2 Immunohistochemical assays for CD20+ and CD68+ in glomerulus
3 讨 论

图3 GVLP与蛋白尿、eGFR、尿红细胞、ALB的相关性Fig.3 Correlation between GVLP and 24 hour urinary protein quantity, eGFR, urine RBC and serum ALB
肾血管病变对HSPN的发病机制和疾病进展至关重要,因此对HSPN血管病变进行精确分级对该病的治疗方案选择和预后判断会有很大帮助。目前,依据ISKDC分类标准已将HSPN组织病理改变分为6类(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ⅵ型),但该标准仅考虑了肾小球系膜增生、新月体及膜增生性病变的程度[10],而其他重要病变指标如肾血管损害轻重、炎性细胞浸润程度等尚未进一步明确[11],因此对预测HSPN临床预后的作用有限[10,12-13]。进一步完善ISKDC分类,如引入血管内皮细胞损害、炎性细胞浸润程度等重要分级参数,可能会有助于提升其病理分级准确性及临床预后判断能力。
本研究通过分析HSPN肾血管病变的组织病理学特征,新引入了GVLPS分级评分系统,即按出现内皮细胞增殖、血管玻璃样变、血管纤维素样坏死、内皮下嗜复红物沉积、细胞新月体、纤维新月体、节段性硬化或球性硬化的肾小球数量占全部被观察肾小球数百分比,将HSPN血管损伤分为4个等级:GVLPS<25%为HG1,25%≤GVLPS<50%为HG2,50%≤GVLPS<75%为HG3,GVLPS≥75%为HG4。统计分析GVLPS分级与临床参数的关系,发现从对照组至HG1、HG2、HG3、HG4组,患者的血清肌酐、血尿素氮、24h尿蛋白、尿红细胞量均逐渐升高,而eGFR、ALB逐渐降低,表明GVLPS分级可以较准确地反映HSPN的疾病严重程度。随后将GVLPS分级(HG1-HG4)与ISKDC分级进行对比研究,发现ISKDC分级与GVLPS分级呈正相关,但GVLPS分级能更好地反映血管病变,如列入Ⅰ-Ⅱ级(ISKDC分级)的患者,若其内皮细胞增生的肾小球数占肾小球总数的50%以上,按GVLPS评分系统需将其归入HG3甚至HG4,其疾病预警作用较ISKDC分级显著加强。而处于ISKDC较高级别的大多数患者(Ⅲ、Ⅳ、Ⅴ型),其在GVLPS评分中也处于较高级别(HG3、HG4),甚至会因患者血管病变种类增加而进一步提高HG等级。以上分析结果表明,依据肾小球血管病变占比积分对患者进行临床评估,而非单纯按ISKDC所定义的新月体数量多少,可在一定程度上避免医生忽视掉严重的内皮细胞增生等所谓的“轻度”病变而延误治疗。例如,本研究中处于HG4组的患者有17例,而其中归于ISKDC分级Ⅴ型的仅有3例,说明ISKDC分级不能准确反映血管病变程度,其评估临床预后的作用有限。
本研究还通过统计肾小球血管病变的各病理类型占总肾小球数的百分比,进一步分析了不同疾病阶段肾小球血管病变的病理特点,发现患者GVLPS积分越高,即病变肾小球数量越多,出现硬化、坏死等严重病理类型的肾小球数也越多,提示肾小球血管病变类型占比的多少可在一定程度反映GVLPS评分的高低,该结果对于评估疾病进展和预后具有积极意义。例如,血管内皮细胞增生是HSPN各阶段最主要的血管病变病理类型,在HG4所占比重最大。随着HG级别的提高(HG1→HG4),病变肾小球数增多,逐渐出现了玻璃样变性、纤维素坏死、节段性硬化和肾小球硬化等病变类型。由于HSPN白细胞破碎性血管炎是由免疫复合物沉积诱导的[14],因此,本研究进一步分析了免疫荧光结果与GVLPS分级的相关性,发现HG3和HG4组肾小球系膜和毛细血管壁中IgA的沉积明显高于HG1和HG2组,IgG和IgM沉积在HG4组表现也最为明显。这些结果与先前提出的HSPN病理预后结论基本一致[15-17],进一步提示GVLPS分级可以在更加早期的阶段发现HSPN肾小球血管病变,预警可能的危害。最近,Koskela等[18]建立了SQC(a modified semiquantitative classification)系统评估HSPN的预后,入组53例患者,随访7.3年,该评分系统首次加入肾小球血管病变,如新月体(细胞和纤维)、局灶和球性硬化和含纤维素血栓,还增加了肾小管和间质病变,按0-3分进行积分,该方案虽对疾病的预后推断有较大帮助,但由于不能提供有力的血管损伤数据,故仍然缺少对血管病变的系统评估。当然,与他们比较,随访观察是本研究的不足,应该增加后期随访数据和结局事件,以进一步评价GVLPS评分的有效性。
许多先前的研究及临床活检病理结果表明,各种类型的肾小球疾病常伴有不同程度的炎性细胞浸润,如T淋巴细胞、B淋巴细胞和单核细胞等,其浸润程度与多种肾小球疾病的病变严重程度及临床表现密切相关[19-21]。但HSPN中炎性细胞浸润与肾小球病变的相关性目前尚未见报道。本研究分析了肾小球白细胞(CD20阳性)数和单核细胞(CD68阳性)数与GVLPS分级的关系。CD20是表达于各个阶段的B淋巴细胞膜上的跨膜蛋白,可介导体液免疫,因此可通过检测CD20的含量以估测B淋巴细胞在肾小球中的浸润程度。CD68是一种表达于巨噬细胞膜表面的特异性抗体,既往已有多个研究显示了巨噬细胞致肾脏损害的证据[22-23]。本研究观察了所有标本中CD20+和CD68+细胞的免疫组织化学染色,发现随着HG1至HG3的血管损伤进展,以及GVLPS积分的增加,两种炎性细胞数量逐渐增多,组间差异显著,但HG4的浸润细胞数较HG3减少,推测可能是处于HG4级别的肾小球局灶硬化或球性硬化数量增多,导致炎性细胞浸润减少,尽管该期存在较多的新月体,但炎性细胞仅浸润在新月体局部,而在其他硬化区域的浸润程度明显下降,进而使炎性细胞的总体统计量减少。归纳上述病理改变,我们认为,处于轻、中度GVLPS级别的病变肾小球与炎性细胞浸润程度的相关性较好,高GVLPS级别中,肾小球硬化指数较高,此种相关性减弱。
已有多个研究提示蛋白尿、eGFR、尿红细胞和ALB含量与HSPN病情严重程度及预后密切相关[24-26]。Halling等[27]认为eGFR降低见于大量蛋白尿患者,eGFR与肾小球系膜增生和蛋白尿呈负相关,遗憾的是该研究并未探讨血管损伤与上述指标的关联性。本研究分析了GVLP与蛋白尿、eGFR、尿红细胞、ALB之间的相关性,发现GVLPS与24h尿蛋白、尿红细胞呈正相关,而与eGFR、ALB呈负相关。由此看来,GVLPS分级与以上临床指标显著相关,当GVLPS积分增加时,临床指标的异常可能也会加重,及早采用保护血管损伤的治疗措施可能会显著改善HSPN的预后。
总之,与ISKDC分级相比,GVLPS系统评分能较准确地反映HPSN肾小球血管的损伤程度,及早预警肾小球病变。GVLPS评分结合ISKDC分级可能会进一步加强HSPN的病理诊断及预后判断。由于本研究仅为单中心、小样本观察,我们建议对该分级系统的效能予以更大样本和多中心观察验证。
[1] Kawasaki Y, Ono A, Ohara S, et al. Henoch-Schonlein purpura nephritis in childhood: pathogenesis, prognostic factors and treatment[J]. Fukushima J Med Sci, 2013, 59(1): 15-26.
[2] Bogdanovic R. Henoch-Schonlein purpura nephritis in children:risk factors, prevention and treatment[J]. Acta Paediatr, 2009,98(12): 1882-1889.
[3] Xu HM, Fan H. Present status and prospect of diagnosis and treatment in thrombotic thrombocytopemic purpura[J]. Chin J Pract Intern Med, 2017, 37(2): 99-103. [徐焕铭, 樊华. 血栓性血小板减少性紫癜诊治现状及展望[J]. 中国实用内科杂志,2017, 37(2): 99-103.]
[4] Wakaki H, Ishikura K, Hataya H, et al. Henoch-Schönlein purpura nephritis with nephrotic state in children: predictors of poor outcomes[J]. Pediatr Nephrol, 2011, 26(6): 921-925.
[5] Chen LL, Le JY, Zhong PJ, et al. Mycophenolate mofetil combined with corticosteroids versus cyclophosphamide combined with corticosteroids in the treatment of rapidly progressive glomerulonephritis[J]. Chin J Pract Intern Med,2016, 36(6): 465-468. [陈亮亮, 乐璟云, 钟佩君, 等. 霉酚酸酯联合糖皮质激素与环磷酰胺联合糖皮质激素治疗急进性肾炎疗效对比分析[J]. 中国实用内科杂志, 2016, 36(6): 465-468.]
[6] Schärer K, Krmar R, Querfeld U, et al. Clinical outcome of Schönlein-Henoch purpura nephritis in children[J]. Pediatr Nephrol, 1999, 13(9): 816-823.
[7] Lu S, Liu D, Xiao J, et al. Comparison between adults and children with Henoch-Schonlein purpura nephritis[J]. Pediatr Nephrol, 2015, 30(5): 791-796.
[8] Sato R, Joh K, Komatsuda A, et al. Validation of the Japanese histologic classification 2013 of immunoglobulin A nephropathy for prediction of long-term prognosis in a Japanese single-center cohort[J]. Clin Exp Nephrol, 2015, 19(3): 411-418.
[9] Wu L H, Yu F, Tan Y, et al. Inclusion of renal vascular lesions in the 2003 ISN/RPS system for classifying lupus nephritis improves renal outcome predictions[J]. Kidney Int, 2013, 83(4):715-723.
[10] Davin J C. Henoch-Schonlein purpura nephritis:pathophysiology, treatment, and future strategy[J]. Clin J Am Soc Nephrol, 2011, 6(3): 679-689.
[11] Davin J, Coppo R. Henoch-Schönlein purpura nephritis in children[J]. Nat Rev Nephrol, 2014, 10(10): 563-573.
[12] Soylemezoglu O, Ozkaya O, Ozen S, et al. Henoch-Schonlein
nephritis: a nationwide study[J]. Nephron Clin Pract, 2009,112(3): c199-c204.
[13] Ronkainen J, Ala-Houhala M, Huttunen NP, et al. Outcome of Henoch-Schoenlein nephritis with nephrotic-range proteinuria[J]. Clin Nephrol, 2003, 60(2): 80-84.
[14] Davin JC, Ten BI, Weening JJ. What is the difference between IgA nephropathy and Henoch-Schonlein purpura nephritis?[J].Kidney Int, 2001, 59(3): 823-834.
[15] Mao S, Xuan X, Sha Y, et al. Clinico-pathological association of Henoch-Schoenlein purpura nephritis and IgA nephropathy in children[J]. Int J Clin Exp Pathol, 2015, 8(3): 2334-2342.
[16] Huang YJ, Yang XQ, Zhai WS, et al. Clinicopathological features and prognosis of membranoproliferative-like Henoch-Schonlein purpura nephritis in children[J]. World J Pediatr, 2015, 11(4):338-345.
[17] Nasri H. Oxford classification of IgA nephropathy is applicable to predict long-term outcomes of Henoch-Schonlein purpura nephritis[J]. Iran J Allergy Asthma Immunol, 2014, 13(6): 456-458.
[18] Koskela M, Ylinen E, Ukonmaanaho E, et al. The ISKDC classification and a new semiquantitative classification for predicting outcomes of Henoch-Schönlein purpura nephritis[J].Pediatr Nephrol, 2017, 32(7): 1201-1209.
[19] Segerer S, Schlondorff D. B cells and tertiary lymphoid organs in renal inflammation[J]. Kidney Int, 2008, 73(5): 533-537.
[20] Shen Y, Sun CY, Wu FX, et al. Association of intrarenal B-cell infiltrates with clinical outcome in lupus nephritis: a study of 192 cases[J]. Clin Dev Immunol, 2012, 2012: 967584.
[21] Steinmetz OM, Velden J, Kneissler U, et al. Analysis and classification of B-cell infiltrates in lupus and ANCA-associated nephritis[J]. Kidney Int, 2008, 74(4): 448-457.
[22] Silva GE, Costa RS, Ravinal RC, et al. Renal macrophage infiltration is associated with a poor outcome in IgA nephropathy[J]. Clinics (Sao Paulo), 2012, 67(7): 697-703.
[23] Wang J, Li Y, Chen Y, et al. Urinary macrophage migration inhibitory factor as a noninvasive biomarker in pediatric Henoch-Schonlein purpura nephritis[J]. J Clin Rheumatol,2017, 23(5): 258-261.
[24] Liu DY, Wen YB, Li H, et al. Clinical analysis of proteinuria and glomerular lesions in Henoch-Schonlein purpura nephritis of adults[J]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao, 2005, 27(2):237-240. [刘冬妍, 文煜冰, 李航, 等. 蛋白尿在成人紫癜性肾炎中的临床意义[J]. 中国医学科学院学报, 2005(02): 237-240.]
[25] Ye Q, Shang SQ, Liu AM, et al. 24h urinary protein levels and urine protein/creatinine ratios could probably forecast the pathological classification of HSPN[J]. PLoS One, 2015, 10(5):e127767.
[26] Coppo R, Andrulli S, Amore A, et al. Predictors of outcome in Henoch-Schonlein nephritis in children and adults[J]. Am J Kidney Dis, 2006, 47(6): 993-1003.
[27] Halling SF, Soderberg MP, Berg UB. Henoch Schonlein nephritis: clinical findings related to renal function and morphology[J]. Pediatr Nephrol, 2005, 20(1): 46-51.
