重组大肠杆菌E.coliBL21/pET28a(+)-mle产苹果酸乳酸酶发酵条件的优化
2018-07-09胡兰兰田亚楠陈福生张秀艳
胡兰兰,田亚楠,陈福生,张秀艳*
(华中农业大学 食品科技学院,湖北 武汉 430070)
果酒中适量的酸能平衡酒的苦涩味,使酒感醇厚爽口;过高则会造成酒味酸涩、酒体粗糙、出现酒色失光、浑浊等现象[1-2],而一些发酵果酒的原料多具有较高的酸度[3]。降低果酒的酸度是目前果酒酿造中研究的重点。目前国内外对果汁及果酒进行降酸方法有物理降酸法[4-5]、化学降酸法[6-7]、生物降酸法。生物降酸法主要包括主要包括二氧化碳浸渍发酵、苹果酸-酒精发酵(malo-alcohol fermentation,MAF)[8]和苹果酸-乳酸发酵(malolactic fermentation,MLF)[9-13],苹果酸-乳酸发酵是葡萄酒生物降酸的主要方法。
苹果酸-乳酸发酵(简称苹乳发酵)是在乳酸菌的作用下将果酒中酸涩的L-苹果酸脱羧基转化成柔和的L-乳酸,并产生CO2[14],从而达到降低果酒酸度的目的。苹乳发酵不仅可以降低生果酒的酸涩味与粗糙感,使之变得圆润、柔和,同时也可以提高果酒的品质和微生物稳定性[15-18],果酒一般都需要进行苹乳发酵。苹果酸乳酸酶(malolactic enzyme,MLE)简称苹乳酶,是催化苹乳发酵的关键酶。苹乳酶的酶活力决定着苹乳发酵过程是否能正常进行。然而,由于果酒的低pH值,高含量SO2,高酒精度等因素而造成乳酸菌生长缓慢,苹乳酶产量少、酶活力低,从而导致苹乳发酵迟缓,产生不良代谢产物的前提物质,如生物胺、氨基甲酸乙酯等,同时也易造成果酒的腐败,甚至引发生物危害[19]。
针对上述问题,国内外学者开展了一系列的研究,如向发酵液中加入苹乳酶[20],向发酵液中加入直投式发酵剂、通过细胞融合或利用基因工程等手段构建降酸酵母[21],但果酒中苹果酸的转化率都不高。这可能是因为苹乳酶不能很好地适应果酒的环境而失活,因为苹乳酶最适反应pH值为5.8~6.0[22],而果酒环境的pH值一般为3.5~3.8[23]。
因此本研究对前期构建的分泌表达苹乳酶的重组大肠杆菌E.coliBL21/pET28a(+)-mle的发酵条件(诱导剂浓度、培养基初始pH值、诱导温度、诱导时间)进行优化,确定最优培养条件,为后续苹乳酶的酶学性质研究和酶学性质改造奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
重组大肠杆菌:含pET28a(+)-mle重组质粒的E.coli BL21(DE3):由本实验室构建。
1.1.2 试剂
异丙基β-D-硫代半乳糖苷(isopropyl-β-D-thiogaLactoside,IPTG)(纯度99%),烟酰胺腺嘌呤二核苷酸(nicoti namide adenine dinucleotide,NAD+):美国Sigma公司;卡那霉素(100 mg/mL):北京索莱宝科技有限公司;L-乳酸检测试剂盒:法国Biosentec公司。
1.1.3 培养基
LB培养基:蛋白胨10 g,酵母膏5 g,氯化钠10 g,调节pH至7.0左右,加无菌水定容至1 L,121℃灭菌20 min。
5×M9盐溶液:用去离子水溶解混合盐(Na2HPO·47H2O 64 g,K2HPO415 g,NaCl 2.5 g,NH4Cl 5.0 g)后定容至1 L。
M9培养基:1 mol/L的硫酸镁0.1mL,1 mol/L的氯化钙2 mL,5×M9盐溶液200 mL,分别于121 ℃灭菌20 min,20%的葡萄糖溶液20 mL(115℃灭菌30 min),然后将4种溶液在无菌条件下混合,用无菌水定容至1 L。
发酵培养基:在M9培养基中加入1%的L-苹果酸。
1.2 仪器与设备
SW-CJ-IF超净工作台:苏中净化设备有限公司;BL-2200H型电子天平:北京赛多利斯仪器系统有限公司;GI80TR型高压蒸汽灭菌锅:美国致微仪器有限公司;pHS-3C型数字酸度计:上海日岛科技有限公司;SZ-93自动双重纯水蒸馏器:上海亚荣生化仪器厂;UV741型可见紫外分光光度计:惠普上海分析仪器有限公司;TS-211C大容量全温恒温摇床:上海晶坛仪器制造有限公司。
1.3 实验方法
1.3.1 分泌表达苹乳酶的大肠杆菌的诱导表达
菌种活化:用接种环挑取单克隆含pET28a(+)-mle的E.coliBL21的重组菌接种到10 mL的LB培养基中,37℃、200 r/min过夜振荡培养,活化菌株。
诱导表达:将活化的种子液以1%的接种量接入装液量为40 mL/250 mL的发酵培养基中,于37℃、200 r/min振荡培养,当菌体生长密度达到0.8左右(OD600nm)时,添加IPTG进行诱导表达。
1.3.2 发酵液中乳酸含量的分析
乳酸菌以果酒中的L-苹果酸为底物,在苹乳酶的催化下转化成L-乳酸和CO2,苹乳酶表达量越高,则L-乳酸的产量越高。因此通过检测发酵液中L-乳酸的产量的高低,从而间接分析苹乳酶表达量的高低。
L-乳酸试剂盒检测原理:
L-乳酸(盐)+NAD+—L-LDH→丙酮酸盐+NADH+H+
丙酮酸盐+L-谷氨酸盐-GPT→L-丙氨酸+2-酮戊二酸
NADH的量和L-乳酸的量呈正比关系。
在含1%L-苹果酸的M(9pH 6.0)培养基中,诱导表达苹乳酶,发酵液经5 000 r/min离心5 min。在1 mL上清液中加入终浓度为1 mmol/L的NAD+,0.5 mmol/L的Mn2+,37 ℃反应1 h,取100 μL的反应液体,用L-乳酸检测试剂盒检测其L-乳酸含量。具体参见LABARRE C等[24]的方法。
1.3.3 单因素试验
采用单因素轮换法,在诱导表达条件(同1.3.1)的基础上,分别考察IPTG浓度(0.2mmol/L、0.4mmol/L、0.6mmol/L、0.8 mmol/L和1 mmol/L)、培养基初始pH值(5.0、5.3、5.6、5.8、6.0、6.5、7.0)、诱导温度(25℃、28℃、31℃、34℃、37℃、40℃)和诱导时间(0、2 h、4 h、6 h、8 h、10 h、12 h、14 h)对重组大肠杆菌分泌苹乳酸酶的影响,以未诱导的含pET28a(+)-mle的E.coliBL21发酵液为空白对照。
1.3.4 正交试验设计
在单因素试验结果的基础上,以L-乳酸含量(Y)为评价指标,选取诱导时间(A)、诱导温度(B)、初始pH值(C)和IPTG浓度(D)4个因素进行L9(34)正交试验设计,正交试验因素水平见表1。

表1 发酵条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for fermentation conditions optimization
1.3.5 数据分析
所得全部的试验数据结果均采用SAS软件(SAS Institute,2000)的ANOVA进行统计分析,采用Microsoft Excel 2010软件作图。
2 结果与分析
2.1 单因素试验结果
2.1.1 IPTG浓度对分泌表达苹乳酶的影响
考察了IPTG浓度对重组大肠杆菌分泌表达苹乳酸的影响,结果如图1所示。由图1可知,随着IPTG浓度在0~0.6 mmol/L范围内增加,L-乳酸产量逐渐增大,即苹乳酶的表达量逐渐增加;当IPTG的浓度为0.6 mmol/L时,发酵上清液中L-乳酸产量最大;继续增加IPTG浓度,L-乳酸的产量开始下降,可能是因为高浓度的IPTG对大肠杆菌细胞具有毒性,抑制了细胞的生长。因此,最适的IPTG浓度为0.6 mmol/L。

图1 IPTG浓度对重组大肠杆菌产L-乳酸的影响Fig.1 Effect of IPTG concentration on L-lactic acid production by recombinantE.coli
2.1.2 培养基初始pH值对分泌表达苹乳酶的影响
考察培养基初始pH值对重组菌分泌表达苹乳酶的影响,结果如图2所示。由图2可知,初始pH值在5.0~7.0范围内,随着初始pH值增加,L-乳酸的产量呈现先增加后减少的趋势。当初始pH值为5.0~6.0时,L-乳酸的产量随初始pH值增加而增加;当初始pH值达到6.0时,L-乳酸的产量最大;当初始pH值>6.0时,L-乳酸的产量随初始pH值增加而减少,可能是培养基初始pH值过低或过高都不利于重组大肠杆菌产生苹乳酶。因此,最适的培养基初始pH为6.0。
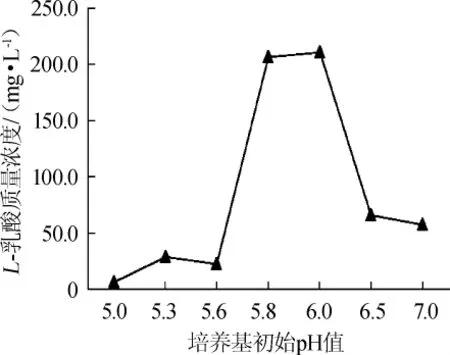
图2 培养基初始pH值对重组大肠杆菌产L-乳酸的影响Fig.2 Effect of initial pH of medium on L-lactic acid production by recombinantE.coli
2.1.3 诱导时间对分泌表达苹乳酸酶的影响
考察诱导时间对重组菌分泌表达苹乳酸酶的影响,结果如图3所示。由图3可知,当诱导时间在0~4 h时,L-乳酸的产量随诱导时间延长逐渐增加;当诱导时间为4 h时,发酵上清液中L-乳酸的产量达到最大;当诱导时间>4h后,L-乳酸的产量反而降低。可能是因为诱导时间4 h后,菌体生物量达到最大,菌体生长进入稳定期,随诱导时间的增加,菌体生长缓慢,则苹乳酶的产量逐渐降低,L-乳酸产量减少;还有可能是IPTG虽然可以直接进入菌体内部发挥诱导作用,并稳定诱导目的蛋白,但其不能被菌体所利用,长时间存在菌体内,对大肠杆菌有毒害作用,从而导致随诱导时间延长,L-乳酸的生成量降低的现象。因此,最适的诱导时间为4 h。

图3 诱导时间对重组大肠杆菌产L-乳酸的影响Fig.3 Effect of IPTG inducing time on L-lactic acid production by recombinantE.coli
2.1.4 诱导温度对分泌表达苹乳酸酶的影响
考察诱导温度对重组大肠杆菌产苹乳酸酶的影响,结果如图4所示。由图4可知,当诱导温度在25~28℃范围内,L-乳酸的产量随诱导温度的增加呈上升趋势;当诱导温度为28℃时,发酵L-乳酸的产量达到最高;而当诱导温度高于28℃之后,L-乳酸的产量则不断减少。分析原因可能是因为在诱导表达的过程中,大肠杆菌生长过速会加重细菌合成系统的负担,导致包涵体的形成,从而降低目的酶的产量,即L-乳酸量降低;而在低温条件下,可减少菌体内一些不必要的代谢反应,可使多肽链有充裕的时间和空间进行正确折叠,成为有活性的蛋白,同时较低温度时,大肠杆菌生长代谢缓慢,比较不容易形成包涵体[25]。因此,最适的诱导温度为28℃。

图4 诱导温度对重组菌大肠杆菌产L-乳酸的影响Fig.4 Effect of inducing temperature on L-lactic acid production by recombinantE.coli
2.2 正交试验结果
在单因素试验的基础上,采用正交试验对诱导时间(A)、诱导温度(B)、初始pH值(C)和IPTG浓度(D)4个因素各设3个水平进行分析,以L-乳酸含量为评价指标,正交试验结果与分析见表2。

表2 发酵条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for fermentation conditions optimization
由表2可知,对重组菌产L-乳酸能力的影响顺序由小到大排序为B(诱导温度)>C(培养基pH)>A(诱导时间)>D(IPTG浓度)。由表可以得出理论最佳组合是A1B2C2D2,即IPTG为0.6 mmol/L,培养基初始pH为5.9,28℃诱导3 h。在此优化条件下,L-乳酸的生成量为2.37 g/L。
3 结论
本研究通过单因素和正交试验优化重组大肠杆菌分泌表达苹乳酶发酵条件,最优发酵条件为IPTG浓度为0.6mmol/L、培养基初始pH值为5.9、诱导温度28℃、诱导时间3 h,在最优条件下,L-乳酸产量达到2.37 g/L,较优化前产量提高9.48倍。
[1]康孟利,凌建刚,林旭东.果酒降酸方法的应用研究进展[J].现代农业科技,2008(24):25-26.
[2]董 华.乳酸菌的苹果酸-乳酸酶基因的克隆和在大肠杆菌中的表达[D].济南:山东轻工业学院,2006.
[3]刘建华,郭意如.影响发酵型果酒质量的因素及解决方法[J].酿酒,2007,34(2):74-75.
[4]文连奎,赵 薇,张 微,等.果酒降酸技术研究进展[J].食品科学,2010,31(11):325-328.
[5]孙慧烨.不同方法降解苹果酒中有机酸的比较和优化[D].杨凌:西北农林科技大学,2015.
[6]赵 燕,任美燕,李 帅.猕猴桃果酒降酸研究[J].粮食科技与经济,2012,37(1):55-57.
[7]VERAE,RUALES J,DORNIERM,et al.Comparison of different methods for deacidification of clarified passion fruit juice[J].J Food Eng,2003,59(4):361-367.
[8]王雪松,隋洪涛,隋韶奕.CO2浸渍法加工软枣猕猴桃酒的研究[J].食品工业科技,2009(4):233-236.
[9]BRAVO-FERRADA B M,HOLLMANN A,DELFEDERICO L,et al.Patagonian red wines:selection ofLactobacillus plantarum,isolates as potential starter cultures for malolactic fermentation[J].World J Microbiol Biot,2013,29(9):1537-1549.
[10]车长远,董 雪,张沁芳,等.3种酒类酒球菌发酵性能研究及其对樱桃酒品质的影响[J].食品与发酵工业,2017,43(7):157-162.
[11]LERM E,ENGELBRECHT L,TOIT M D.Selection and characterisationofOenococcusoeniandLactobacillusplantarumSouthAfrican wine isolates for use as malolactic fermentation starter cultures[J].South Afr J Enol Viticult,2011,32(2):280-295.
[12]LI N,DUAN J,GAO D,et al.Mutation and selection ofOenococcus oenifor controlling wine malolactic fermentation[J].Eur Food Res Technol,2015,240(1):93-100.
[13]RODRÍGUEZNOGALES J M,VILACRESPO J,FERNÁNDEZFERNÁ NDEZ E.Immobilization ofOenococcus oeniin lentikatsRto develop malolactic fermentation in wines[J].Biotechnol Progr,2013,29(1):60-65.
[14]张 浩,莫海珍,李 华.酒精、SO2和pH值对酒类酒球菌生长特性影响[J].中国酿造,2006,25(5):38-40.
[15]BAFFI M A,MARTIN N,TOBAL T M,et al.Purification and characterization of an ethanol-tolerant β-glucosidase fromSporidiobolus pararoseusand its potential for hydrolysis of wine aroma precursors[J].Appl Biochem Biotech,2013,171(7):1681-1691.
[16]BARTOWSKY E J,BORNEMAN A R.Genomic variations ofOenococcus oenistrains and the potential to impact on malolactic fermentation and aroma compounds in wine[J].Appl Biochem Biotech,2011,92(3):441-447.
[17]KNOLL C,FRITSCH S,SCHNELL S,et al.Influence of pH and ethanol on malolactic fermentation and volatile aroma compound composition in white wines[J].LWT-Food Sci Technol,2011,44(10):2077-2086.
[18]彭传涛,贾春雨,文 彦,等.苹果酸-乳酸发酵对干红葡萄酒感官质量的影响[J].中国食品学报,2014,14(2):261-268.
[19]BAUER R,DICKS L M T.Control of malolactic fermentation in wine[J].South Afr J Enol Viticult,2017,25(2):74-88.
[20]LIU Y L,LI H.Integrated expression of theOenococcus oeni mleA gene inSaccharomyces cerevisiae[J].Agr Sci China,2009,8(7):821-827.
[21]李 华,游 玲,刘晓晴,等.酿酒酵母与酒类酒球菌融合子特性及分子生物学研究[J].西北农林科技大学学报,2006,34(6):133-136.
[22]BATTERMANN G,RADLER F.A comparative study of malolactic enzyme and malic enzyme of different lactic acid bacteria[J].Canad J Microbiol,1991,37(3):211-217.
[23]PAZHANI S,PANNEERSELVAM S,MURUGADOSS N.Fermentation of fruit wine and its quality analysis:A review[J].Aust J Sci Technol,2018,1(2):85-97.
[24]LABARRE C,DIVIÈS C,GUZZO J.Genetic organization of themlelocus and identification of amleR-Like gene fromLeuconostoc oenos[J].Appl Environ Microbiol,1996,62(12):4493-4498.
[25]NILSSON H O,ALELJUNG P,NILSSON I,et al.Immunomagnetic bead enrichment and PCR for detection ofHelicobacter pyloriin human stools[J].J Microbiol Meth,1996,27(1):73-79.
