鱼腐乳前发酵过程中蛋白质的降解及工艺的优化
2018-07-09沈会玲周常义苏国成
沈会玲,曾 磊,江 锋,周常义,苏国成*
(1.集美大学 食品与生物工程学院,福建 厦门 361021;2.厦门中集信检测技术有限公司,福建 厦门 361021)
近几年来随着渔业的发展,鱼糜制品的产量也逐年提升,深受消费者的青睐,具有广阔的市场前景。发酵鱼糜制品主要是指在鱼糜中加入微生物,经发酵作用使鱼糜的蛋白质、脂肪或碳水化合物发生不同变化,形成其特有的风味与口感的食品。
随着对发酵鱼糜制品的深入研究,学者们不断探索利用不同菌种与发酵方式提高发酵鱼糜的质量[1-2]。KASANKALA L等[3]研究了豆豉发酵剂对发酵鱼酱的营养价值的影响,发现经过豆豉发酵剂发酵的鱼糜营养成分及活性物质都显著提高。赵培城等[4]采用绍兴腐乳毛霉对低值海产鱼糜固态发酵,制成与豆腐乳形态相似、口感细腻的鱼糜腐乳;王乃富等[5]用红曲霉对鳙鱼肉糜进行发酵,经过发酵鱼糜的色泽和营养价值都得到改善,同时增强了鱼糜的生物活性;周绪霞等[6]在用真菌发酵前先对鱼糜进行蒸汽加热20 min,形成凝胶后进行固态发酵。
本研究利用总状毛霉和红曲霉F1对鱼豆腐进行发酵研制鱼腐乳,采用响应面法优化鱼腐乳前期发酵工艺,并对发酵过程中鱼腐乳的蛋白质降解、质构和色泽的变化进行分析,旨在为开发鱼腐乳产品提供理论基础和科学依据。
1 材料与方法
1.1 材料与试剂
FA级鱼糜:福建晋江闽南水产开发有限公司;总状毛霉(Mucor racemosus):百惠生物科技有限公司。
磷酸二氢钠、磷酸氢二钠、福林试剂、盐酸、三氯乙酸、碳酸钠(均为分析纯):国药集团;酪蛋白标准品(纯度99.8%)、L-酪氨酸标准品(纯度99%);食盐、淀粉、均为市售食品级。
1.2 仪器与设备
MiniP-4电泳仪:北京凯元信瑞仪器有限公司;3-30 K冷冻离心机:德国SIGMA公司;FD-1-50真空冷冻干燥器:北京博医康仪器公司;UV-2000紫外分光光度计:上海尤尼柯仪器有限公司;HH-4数显恒温水浴锅:北京国华科技集团有限公司。
1.3 实验方法
1.3.1 鱼腐乳白坯的制作
冷冻鱼糜在4℃冰箱解冻后,将水分调整为80%,空擂5 min,加入鱼浆质量3%的NaCl后再盐擂10 min,加入10%玉米淀粉,继续擂溃10 min,将擂溃好的样品装入方形钢圈,两端密封,采用二段式加热的方式对鱼糜进行加热,低温加热成型(45℃、1 h),高温加热(95℃、20 min)。然后用冰水迅速冷却,放入冰箱平衡24 h备用。
1.3.2 鱼腐乳发酵工艺
参照马立安等[7]制作腐乳毛坯的方法,将制备好的鱼豆腐均匀的摆放在经紫外消毒后的塑料盒内,中间留有空隙,将配制好的5×107个/mL毛霉菌菌悬液以5.3%的接种量均匀的喷洒在鱼豆腐的表面,置于27℃恒温培养箱内培养,每隔1 d取样备用。
1.3.3 蛋白酶的提取及活性测定
将取出的样品置于-70℃条件下预冻12 h,真空冷冻干燥处理后粉碎机粉碎,过60目筛,置于干燥器中储存,备用。称取1 g样品于离心管中,加入10 mL磷酸盐缓冲液,混匀,40℃水浴超声提取1 h,再经冷冻离心机8 000 r/min离心10 min,取上清液进行分析检测。蛋白酶活力的测定方法参照国标GB/T 23527—2009《蛋白酶制剂》[8]。蛋白酶活力定义是指在一定的温度或pH条件下,1g样品每分钟催化水解酪蛋白所产生的酪氨酸的微克数为一个酶活力单位(U/g)。
1.3.4 鱼腐乳发酵过程中氨基酸态氮含量的测定
参照GB/T 5009.235—2016[9《]食品中氨基酸态氮的测定》中的方法进行测定。
1.3.5 鱼豆腐前发酵过程中蛋白质降解的分析
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfatepolyacrylamidegelelectrophoresis,SDS-PAGE)分析前发酵过程中质构变化的研究,配制10%的分离胶,5%的浓缩胶,将样品最终蛋白质量浓度调节为2 mg/mL,上样量为10 μL,R250考马斯亮蓝染色12 h,脱色4 h。
1.3.6 鱼腐乳前发酵工艺优化单因素试验及响应面试验
(1)单因素试验
将浓度为5×107个/mL菌悬液以5%的接种量喷洒于鱼豆腐表面,置于27℃培养箱,发酵时间分别为48 h、72 h、96 h、120 h、144 h,将浓度为5×107个/mL菌悬液以5%的接种量喷洒于鱼豆腐表面,分别置于23℃、25℃、27℃、29℃、31℃,将浓度为5×107个/mL菌悬液分别以3%、4%、5%、6%、7%的接种量喷洒于鱼豆腐表面,置于27℃培养箱,培养96 h。按1.3.2工艺流程制作鱼腐乳毛坯,分别考察发酵时间、发酵温度、菌悬液接种量对鱼腐乳前期发酵蛋白酶活的影响。
(2)响应面试验
对发酵前期条件进行优化,以发酵时间(A)、发酵温度(B)、霉菌菌悬液的接种量(C)为试验因素,蛋白酶活力(Y)为评价指标进行响应面试验,因素与水平如表1所示。

表1 发酵条件优化响应面试验因素与水平Table 1 Factors and levels of response surface methododogy for fermentation conditions optimization
2 结果与分析
2.1 鱼腐乳前发酵过程中氨基酸态氮含量的变化
氨基酸态氮可以快速检测食品中蛋白质的水解程度[10],主要包括氨基酸、水溶性蛋白以及多肽类物质,对产品的风味有一定的影响。从图1可以看出,在前期发酵过程中,氨基酸态氮的含量呈明显升高的趋势,在鱼豆腐白坯中,氨基酸态氮含量较低,含量仅为0.01%,而在前期发酵至第4天时,氨基酸态氮含量上升至0.23%,说明在前期发酵的过程中蛋白质发生降解,毛霉在生长代谢的过程中产生了大量的蛋白酶,而且有研究发现,毛霉分泌的蛋白酶大多数为酸性蛋白酶[11],对于酸性物质的测定中发现,前期发酵过程中酸度逐渐升高,有利于蛋白酶活性的提升,蛋白酶会作用于大分子蛋白,蛋白质被逐渐降解为小分子肽和氨基酸。
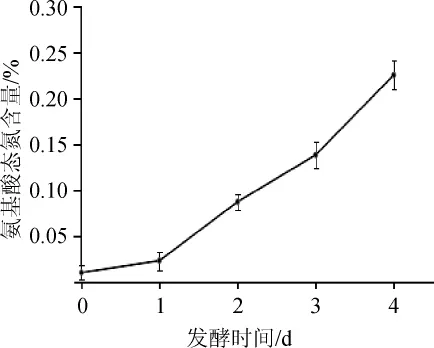
图1 鱼腐乳前发酵过程中氨基酸态氮含量的变化Fig.1 Changes of amino acid nitrogen content of fish sufu during pre-fermentation
2.2 鱼豆腐发酵过程中蛋白质降解的电泳分析
鱼腐乳前期发酵过程中SDS-PAGE电泳图结果见图2。由图2可知,在鱼糜和鱼腐乳白坯中可以清楚的看到很多大分子蛋白的条带,而在发酵至第48小时,肌球蛋白重链(myosin heavy chain,MHC)和肌动蛋白(actin)等大分子条带明显减弱,30~40 kDa的条带有加深,说明部分大分子蛋白降解为小分子,发酵至96 h,大分子条带基本看不到。随着发酵时间的延长,高分子蛋白片段(high molecular weight protein fractions,HMWF)逐渐减弱,而最下层的小分子条带逐渐加深,说明发酵的过程中,大部分蛋白质被降解为小分子肽,主要是因为在发酵过程中蛋白质会被蛋白酶迅速水解。GIRI A等[12]在发酵鱼酱的研究中也发现类似这一现象。IRIANTO H E等[1,13]的研究也表明鱼肉或鱼糜在发酵过程中经多种酶(内源蛋白酶、外源性微生物蛋白酶)对鱼肉蛋白的作用,使其分解为小分子的肽或是氨基酸。经过发酵,蛋白质被分解为氨基酸和多肽,更有利于人体的消化吸收[14]。
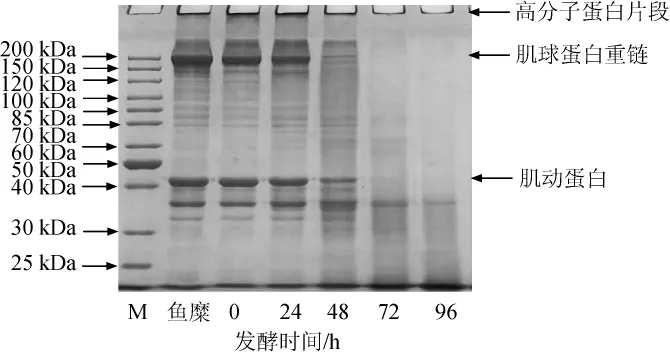
图2 不同前发酵时间鱼腐乳的SDS-PAGE图Fig.2 SDS-PAGE of fish sufu with different pre-fermentation time
2.3 鱼腐乳前发酵过程中单因素试验结果与分析
2.3.1 发酵时间对蛋白酶活力的影响
毛霉在生长过程中会释放一些以蛋白酶为主的酶系[15],对腐乳风味的形成有重要的作用。由图3可知,前发酵时间处于60~96 h阶段,鱼腐乳蛋白酶活力逐渐增加,发酵至96 h时,蛋白酶活力达到最大值,之后蛋白酶活力逐渐降低,随着发酵时间的延长,毛霉的菌丝体逐渐老化,影响了蛋白酶的分泌。因此前期的发酵时间应控制在96 h为宜。

图3 发酵时间对蛋白酶活力的影响Fig.3 Effect of fermentation time on protease activity
2.3.2 发酵温度对蛋白酶活力的影响
由图4可知,前期发酵温度23~27℃时,蛋白酶活力逐渐增大,在这个温度范围,随着温度的升高,促进了毛霉的生长代谢和蛋白酶的产生,当培养温度升至27℃时,蛋白酶活力达到最大值;温度继续升高,蛋白酶活力开始呈下降趋势,可能是因为温度过高,一方面影响了毛霉的生长代谢,另一方面加剧了菌丝体的老化。因此鱼豆腐前期发酵的温度控制在27℃为宜。
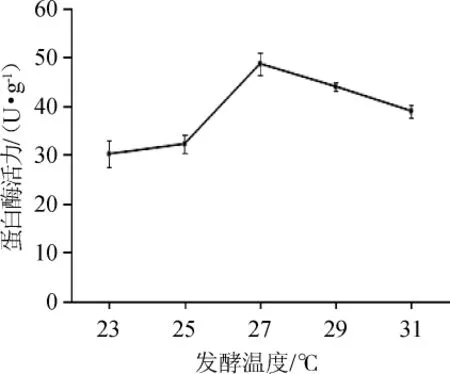
图4 发酵温度对蛋白酶活力的影响Fig.4 Effect of fermentation temperature on protease activity
2.3.3 菌悬液接种量对蛋白酶活力的影响
由图5可知,当菌悬液的接种量<5%的时候,鱼腐乳毛坯的蛋白酶活力随着菌悬液接种量的增大而增大,当接种量达到5%时,蛋白酶活力达到最大值。菌悬液接种量继续增大蛋白酶活力开始降低,随后保持不变,可能是因为菌悬液接种量增大带来孢子量增加的同时,在代谢过程中会消耗大量的营养物质,而且会破坏毛霉的生长环境,造成菌丝体的老化,从而导致蛋白酶的活力逐渐降低。因此毛霉菌悬液的接种量应控制在5%左右为宜。

图5 接种量对蛋白酶活力的影响Fig.5 Effect of inoculum on protease activity
2.4 鱼腐乳前期发酵工艺优化响应面试验结果与分析
2.4.1 鱼腐乳前期发酵工艺优化响应面试验结果与分析
采用响应面试验,以蛋白酶活力(R1)为响应值,以发酵时间(A)、发酵温度(B)、菌悬液接种量(C)进行前发酵优化,响应面试验设计结果见表2,方差分析见表3。
由表3可知,模型极显著(P<0.0001),因变量与自变量之间的线性关系显著(R2=0.993 8),模型调整的复相关系数为(R2Adj=0.985 8),说明该模型能解释98.58%的响应值变化,拟合程度极好,失拟项不显著(P>0.05),对模型是有利的,无失拟因素存在。变异系数(coefficient of variation,CV)表示实验的精确程度,本实验的CV=2.71%,在接受范围内。表明相应曲面的拟合程度好,能够精确的预测实际情况。
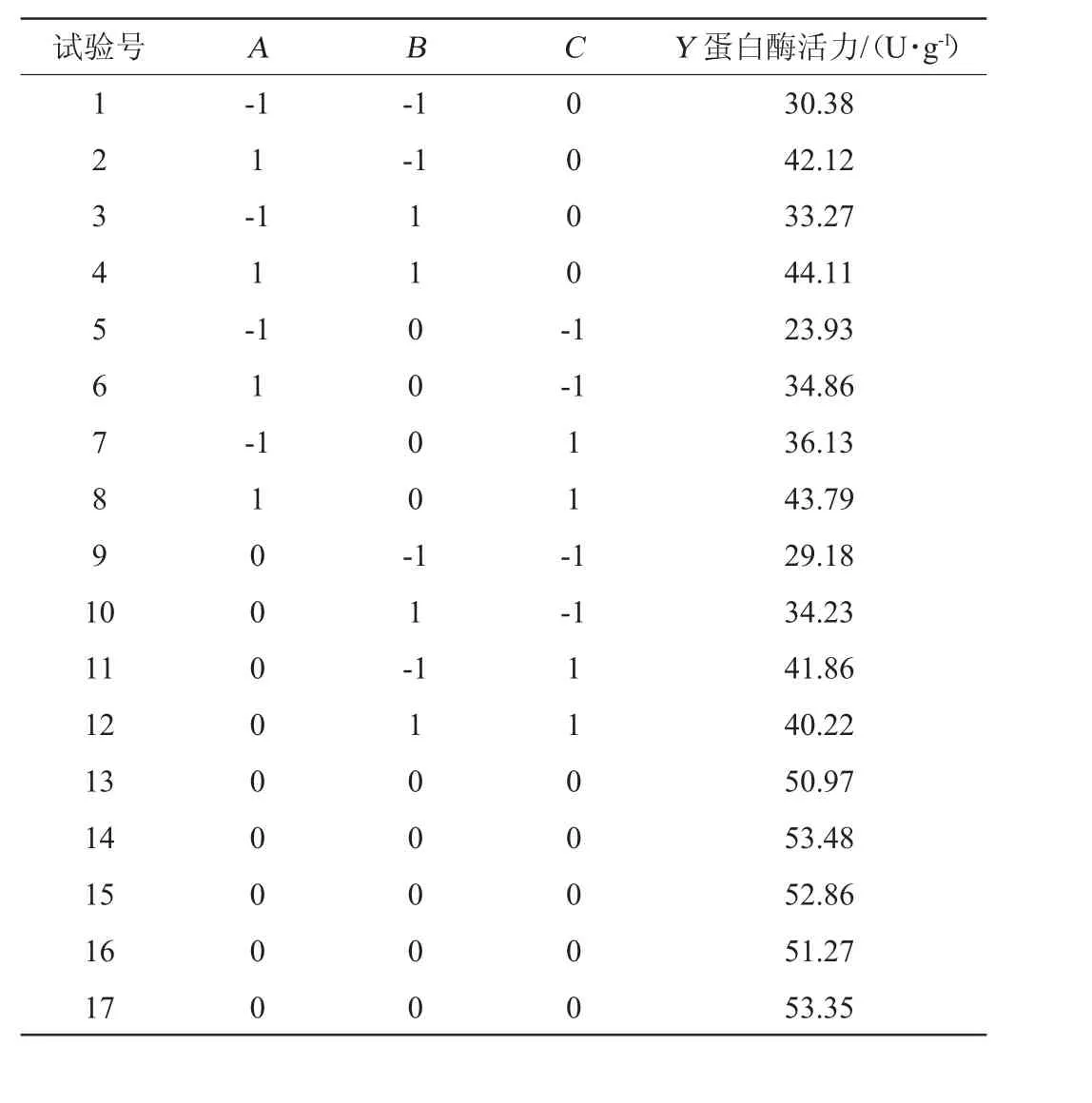
表2 发酵条件优化响应面试验设计与结果Table 2 Design and results of response surface methododogy for fermentation conditions optimization
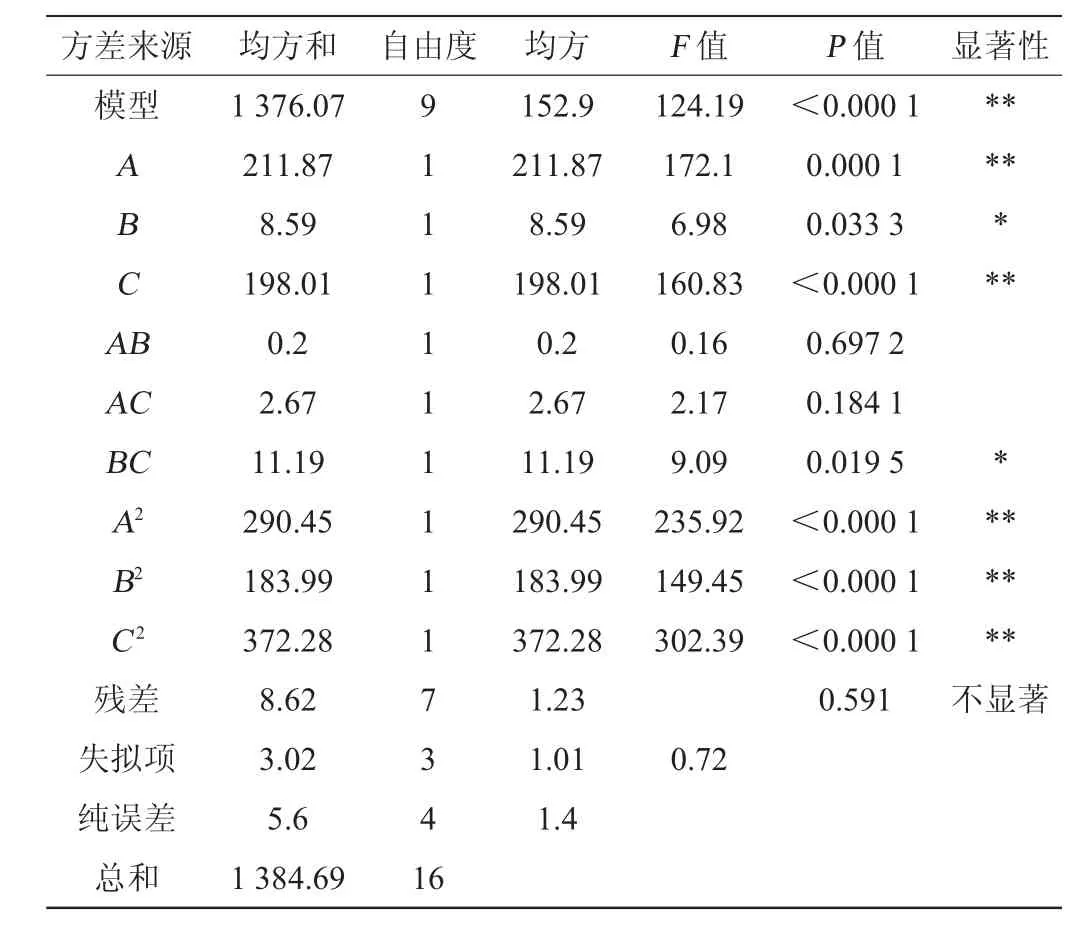
表3 回归模型方差分析Table 3 Variance analysis of regression model
以发酵时间(A)、发酵温度(B)、菌悬液接种量(C)为自变量,蛋白酶活力(Y)为因变量,建立回归模型。前发酵工艺优化回归方程为:

2.4.2 响应面法优化发酵条件曲面图结果分析
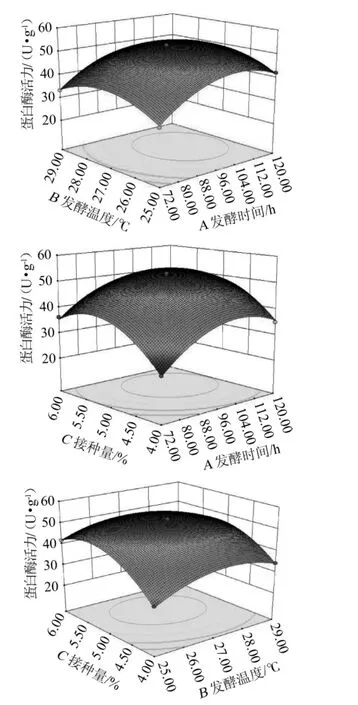
图6 发酵温度、发酵时间及接种量对鱼腐乳前发酵蛋白酶活力影响的响应面与等高线Fig.6 Response surface plots and contour line of effects of interaction between fermentation temperature,time and inoculum on the activity protease of pre-fermentation of fish sufu
由图6A可以看出,当菌悬液接种量在5%时,发酵温度与发酵时间对鱼豆腐前期发酵的蛋白酶活力产生交互影响,当发酵时间较短时,蛋白酶活力较低,随着发酵时间的延长,蛋白酶活力逐渐升高,当发酵温度继续升高时,蛋白酶活力较高,两者的交互作用并不显著(P=0.6972>0.05)。
由图6B可以看出,当发酵温度为27℃,当菌悬液接种量偏高时,随着发酵时间的延长,蛋白酶活性逐渐升高,并达到最大值。当发酵时间继续增大时,随着菌悬液接种量增大,蛋白酶活力逐渐升高。两者的交互作用不显著(P=0.184 1>0.05)。
由图6C可以看出,蛋白酶活力随着发酵温度的升高,先升高,随后又逐渐降低,随着菌悬液接种量增大,蛋白酶活力逐渐升高,并达到最大值,两者之间的交互作用显著(P=0.019 5<0.05)。
响应面方法的图形是响应值Y与对应的因素A、B、C构成的一个三维空间在二维平面上的等高图,每一个响应面图对其中2个因素进行分析,另外一个因素固定在零水平,从图中可以直观的反映出各因素对响应值的影响,结合上述各项参数、三维响应曲面图和等高图,运用Design Expert 8.0分析计算找出鱼豆腐前期发酵条件的最佳点。根据蛋白酶活力回归方程,最佳点的值分别为发酵时间103.12 h,发酵温度27.09℃,菌悬液接种量5.25%,理论蛋白酶活力为53.79 U/g。根据实际生产需要,将发酵条件取值为发酵时间103 h,发酵温度27℃,菌悬液接种量5.3%,经验证试验,该优化工艺条件下蛋白酶活力为51.48 U/g。
3 结论
本研究采用总状毛霉,对鱼腐乳进行前期发酵,发酵至第4天,氨基酸态氮含量升高至0.23%,大部分大分子蛋白降解为小分子。以蛋白酶活力为指标,通过单因素和响应面试验优化发酵鱼腐乳的前发酵条件,得到鱼腐乳的前发酵最佳条件为发酵时间103 h,发酵温度27℃,毛霉菌悬液接种量5.3%,此时的蛋白酶活力为51.48 U/g。形成的酶系为后期发酵的一系列生化反应奠定了良好的基础,有利于提高鱼腐乳的品质,丰富鱼腐乳的风味。
[1]IRIANTO H E.Enzymes in fermented fish[J].Adv Food Nutr Res,2017,80(10):199-216.
[2]NAKANO M,SAGANE Y,KOIZUMI R,et al.Chemical properties and colors of fermenting materials in salmon fish sauce production[J].Data Brief,2017,16(2):483-488.
[3]KASANKALA L.豆豉发酵剂对发酵鱼酱的浸出成分、营养价值和生物活性化合物的影响的研究[D].无锡:江南大学,2012.
[4]赵培城,韩 晓,丁玉庭,等.鱼糜固态发酵工艺与其生化指标动态变化的研究[J].浙江工业大学学报,2013,41(2):165-170.
[5]王乃富,李春阳,阎 征,等.红曲霉发酵对鳙鱼肉糜品质和生物活性影响研究[J].广西农学报,2010,25(2):54-57.
[6]周绪霞,徐潇颖,韩 晓,等.真菌固态发酵鱼糜过程中蛋白酶活及生化指标的动态变化[J].中国食品学报,2014,14(2):277-282.
[7]马立安,张雪山.红曲酱腐乳的特点及制作工艺[J].中国酿造,2000,19(4):35-36.
[8]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 23527—2009蛋白酶制剂[S].北京:中国标准出版社,2009.
[9]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T5009.235—2016氨基酸态氮[S].北京:中国标准出版社,2016.
[10]ROSERIO L,SANTOS C,SOL M,et al.Proteolysis in Painho de Portalegre dry fermented sausage in relation to ripening time and salt content[J].Meat Sci,2008,79(4):784-794.
[11]黄达明,吴其飞,陆建明,等.固态发酵技术及其设备的研究进展[J].食品与发酵工业,2003,29(6):87-91.
[12]GIRI A,NASU M,OHSHIMA T.Biocative properies of Japanese fermented fish paste,fish miso,using koji inoculated withAspergillus oryzae[J].Int J Nutr Food Sci,2012,1(1):13-22.
[13]ZHOU X X,ZHAO D D,LIU J H,et al.Physical,chemical and microbiological characteristics of fermented surimi withActinomucor elegans[J].Food Sci Technol,2014,59(1):335-341.
[14]蔡曼儿,孙 翰,薄 芯.中国传统发酵大豆制品的营养[J].中国酿造,2010,29(2):11-16.
[15]吴拥军,龙 菊,程昌泽,等.腐乳发酵过程中酶活力和化学组分变化研究[J].食品科学,2009,30(3):249-252.
