黑曲霉C2J6脂肪酶的保存稳定性研究
2018-07-09苏雪林董佩娜万银松
苏雪林,董佩娜,万银松,刘 娅*
(石河子大学 食品学院,新疆 石河子 832000)
脂肪酶具有多项催化反应(如催化水解、醇解、酯交换、酯合成等)能力[1],是重要的工业酶制剂品种之一,在食品、化工、医药、环保等领域应用广泛。然而酶在生产、储存、运输、应用等过程中极易受温度、pH值、脂肪酶浓度、底物浓度、酶的激活剂和抑制剂等多种因素的影响[2-3],导致酶的稳定性差、易失活,限制了其有效应用。因此,研究和改善稳定脂肪酶的方法具有重要理论意义和实践价值。
目前,提高酶类保存稳定性的方法主要包括三种,第一,酶的固定化[4-5]:将游离酶限定在一定空间内或附着在某些固态物质上。此法有效、便捷,且具有易于实现底物和产物的分离、提高酶的使用效率和降低生产成本的优点。第二,添加稳定剂[6-9]:通过向酶液中添加底物、底物类似物、防腐剂、盐类、糖类、多元醇类等化学物质改善酶存在的环境。第三,蛋白质工程技术[10-11],利用分子手段和DNA重组技术定向改造酶的某些性质,例如敲除不利于酶分子稳定性的基因、添加有利的基团等。此外,定向筛选、改变酶的保存温度及利用化学修饰等方法也能有效增强酶的稳定性[12-14]。
鉴于添加稳定剂的方法具有简单、方便、成本低、易于操作,且酶活稳定效果好的特点,本实验探讨了室温下黑曲霉(Aspergillusniger)C2J6脂肪酶在不同稳定剂作用下的保存稳定性,以期为其长期储存奠定基础。
1 材料与方法
1.1 材料与试剂
黑曲霉(Aspergillus niger)C2J6:本实验室自主分离、保藏的菌种。
马铃薯葡萄糖琼脂培养基(potatodextroseagar,PDA):马铃薯葡萄糖水26 g/L,琼脂20 g/L;
液体种子培养基:KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,蛋白胨5 g/L,葡萄糖10 g/L;
发酵培养基:NH4Cl 15 g/L,KH2PO40.5 g/L,K2HPO41.0 g/L,MgSO4·7H2O 0.3 g/L,CaCl20.1 g/L,KCl 0.5 g/L,橄榄油20 mL/L。
棕榈酸对硝基苯酯:美国Sigma公司;聚乙二醇(polyethyleneglycol,PEG)2000:天津永晟精细化工有限公司;橄榄油:上海嘉里食品工业有限公司;蛋白胨、马铃薯葡萄糖水:青岛海博生物技术有限公司;甘氨酸、柠檬酸、醋酸钠、乙二胺四乙酸二钠(均为分析纯):天津市致远化学试剂有限公司;乙腈、果糖、蔗糖、葡萄糖、丙三醇、硫酸镁、氯化钙、氯化铵、三羟甲基氨基甲烷(Tris)等(均为分析纯):北京市奥博星生物技术有限责任公司。
1.2 仪器与设备
LDZX-30KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;SW-CJ-2D双人单面洁净工作台:苏州苏洁净化设备有限公司;HH-42恒温水浴锅:常州国华电器有限公司;PHS-3C酸度计:上海仪电科学仪器股份有限公司;MJX-150智能霉菌培养箱、THZ-98恒温振荡培养箱:上海百典仪器有限公司;EON多功能酶标仪:美国BIOTEK仪器有限公司。
1.3 方法
1.3.1 黑曲霉C2J6脂肪酶的制备
黑曲霉C2J6经液体种子培养22 h后,接种于发酵培养基中,28℃条件下150 r/min摇床培养72 h,发酵液过滤后即得脂肪酶粗酶液。
1.3.2 脂肪酶活力测定
将样品管中各加入200 μL棕榈酸对硝基苯酯反应底物,40℃水浴预热5 min,然后在样品管中加入脂肪酶液50 μL,对照管中加入灭活的酶液50 μL,立即混匀计时,在水浴中准确反应5 min后,加入10 μL乙二胺四乙酸二钠溶液并放入冰水中10min终止反应,用酶标仪测定波长405nm处的吸光度值[16-17]。以未经处理的脂肪酶初始活力为100%,计算相对酶活。
1.3.3 单一稳定剂对脂肪酶保存稳定性的影响
(1)稳定剂种类的影响
将0.2 mol/L醋酸钠、3 mol/L丙三醇、4 mol/L氯化钠、4 mol/L氯化铵、4%果糖、4%蔗糖、4%葡萄糖、0.2 mol/L硫酸镁、0.2 mol/L聚乙二醇等稳定剂分别添加到酶液中[18-21],充分混匀后室温放置48 h,测定相对酶活。
(2)稳定剂添加量的影响
将不同添加量的丙三醇、聚乙二醇、氯化钠、氯化铵、硫酸镁、果糖、蔗糖、葡萄糖分别添加到酶液中,充分混合后室温放置48 h,测定相对酶活。
1.3.4 复合稳定剂对脂肪酶保存稳定性的影响
以单因素试验为基础,选取单一稳定剂中3个保存效果较好的稳定剂进行复配,优化各稳定剂添加量。本试验以丙三醇添加量(A)、硫酸镁添加量(B)、果糖添加量(C)为主要评价因素,相对酶活(Y)为响应值,设计3因素3水平的Box-Behnken响应面试验,因素与水平见表1。
2 结果与分析
2.1 稳定剂种类对脂肪酶稳定性的影响
向脂肪酶中添加各种单一稳定剂,考察稳定剂对脂肪酶稳定性的影响,结果如图1所示。由图1可知,稳定剂中丙三醇的效果最好,相对酶活高达63%以上,醋酸钠的效果最差,相对酶活仅为22%左右。氯化钠、硫酸镁等其他稳定剂均能在一定程度上保留脂肪酶活性。多元醇类稳定剂属于羟基化合物,其羟基可以和酶的酰胺基反应,有研究表明酰胺键的形成能增强酶分子稳定性,从而提高酶活力[22]。此外醇类稳定剂中的丙三醇能增大酶液黏度,增加分子表面水化层,减少肽链间的碰撞,抑制酶分子间聚集,从而保护酶分子二级结构、维持酶分子天然构象,提高酶稳定性[23]。糖类的羟基也可与酶液相互作用,使酶与水之间溶剂化,二者间形成的氢键能改变酶分子折叠的驱动力,降低酶分子自由能,使酶分子稳定性增强[24]。盐类稳定剂中金属离子能结合酶的带电基团,减少氧气等其他物质和酶分子的结合,从而增加其稳定性[25-26]。

图1 稳定剂种类对脂肪酶稳定性的影响Fig.1 Effect of stabilizer type on lipase stability
2.2 稳定剂添加量对脂肪酶稳定性的影响
从醇类、糖类、盐类中挑选效果相对较好的稳定剂,以不同浓度醇类和盐类1~5 mol/L(硫酸镁0.1~0.5 mol/L),糖类1%~5%,添加到脂肪酶中,结果见图2。
由图2A可知,随着醇类添加量的逐渐升高,聚乙二醇对脂肪酶活力的影响不大,相对酶活仅维持在60%左右,而在4mol/L丙三醇作用下,相对酶活最高能达到63%左右。可见丙三醇的效果要略优于聚乙二醇。由图2B可知,相同浓度下,硫酸镁能较好的维持脂肪酶的活力,且在较低浓度下就能达到比较好的保存效果,0.2 mol/L硫酸镁能使酶的相对活力达到60%以上。氯化钠和氯化铵在低浓度时对酶的保存效果不佳,在浓度达到4 mol/L时的效果也没有硫酸镁好。由图2C可知,随着糖类稳定剂添加量的不断增大,脂肪酶的相对酶活逐渐增大至55%以上,其中在4%果糖作用下,能达到60%以上。但糖类浓度达到5%时,相对酶活则迅速减小。实验中发现,三种糖类稳定剂对脂肪酶保存稳定性均呈现先增大后减小的趋势,其原因可能是低浓度的糖更容易与水分子相互作用,稳定酶分子结构,而高浓度的糖会使酶液渗透压增大,改变酶分子构象从而导致酶活降低。结果表明,4%的果糖作为稳定剂能使脂肪酶的保存稳定性更好。
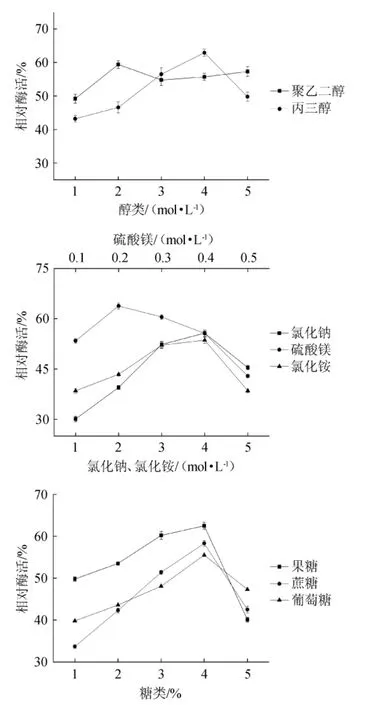
图2 醇类(A)、盐类(B)、糖类(C)添加量对脂肪酶稳定性的影响Fig.2 Effect of alcohol(A),salts(B)and sugar(C)addition on lipase stability
2.3 响应面试验结果及方差分析
根据脂肪酶相对酶活的变化,采用Box-Behnken设计响应面试验,结果如表2和表3所示。对试验数据进行回归拟合,以丙三醇添加量(A)、硫酸镁添加量(B)、果糖添加量(C)为自变量,以脂肪酶相对酶活(Y)为因变量,得到回归方程:

由表3可知,在方差分析中,决定系数R2=0.982 6,表明了丙三醇添加量、硫酸镁添加量、果糖添加量这三个因素与脂肪酶酶活的关系可以较好的用回归方程进行拟合。校正系数R2Adj=0.960 3,表明响应值96%的变化可以用该模型解释。模型项P<0.000 1,差异极显著;失拟项P>0.05,差异不显著,一次项、二次项的差异都极显著,说明非实验因素对结果影响不大,该模型可以用于优化稳定剂保存脂肪酶的条件研究。
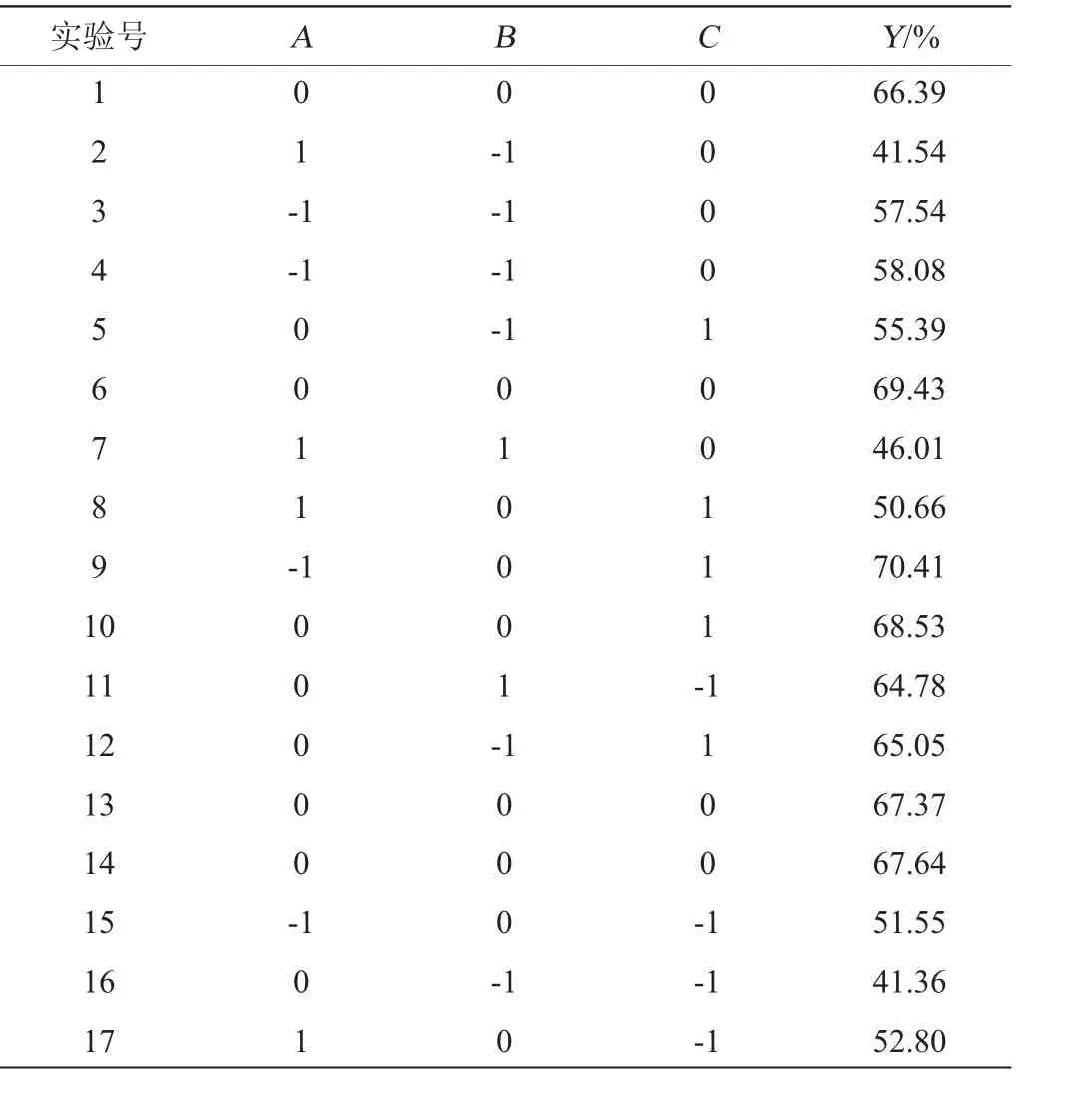
表2 脂肪酶稳定剂配方优化响应面试验设计与结果Table 2 Design and results of Box-Behnken experiments for lipase stabilizer formula optimization

表3 响应面试验结果方差分析Table 3 Variance analysis of response surface methodology results
2.4 响应面分析及优化
为了更直观的探讨各稳定剂对黑曲霉C2J6脂肪酶保存稳定性的影响且找到最优组合,选择方差分析显著的因素绘制响应面图,结果见图3。

图3 各因素交互作用对脂肪酶稳定性影响的响应面和等高线Fig.3 Response surface plots and contour line of effects of interactions between each factors on lipase stability
由图3可知,硫酸镁添加量与丙三醇添加量、果糖添加量与丙三醇添加量、果糖添加量与硫酸镁添加量这3组交互作用项的曲面图均为陡峭的凸面,说明这3组稳定剂的交互作用都显著。由图3a可知,与丙三醇添加量方向上的响应曲面相比,硫酸镁的曲面比较陡,这说明硫酸镁比丙三醇添加量对酶活的影响大。由图3b可知,与丙三醇添加量方向上的响应曲面相比,果糖的曲面比较陡,这说明果糖比丙三醇添加量对酶活的影响大。由图3c可知,与硫酸镁添加量方向上的响应曲面相比,果糖的曲面比较陡,这说明果糖比硫酸镁添加量对酶活的影响大。通过响应面软件对模型进行预测分析,得到脂肪酶稳定剂的最佳保存条件为3.54 mol/L丙三醇,0.14 mol/L硫酸镁,果糖4.96%,在此条件下保存48 h,相对酶活预测值为72.92%。
2.5 验证试验
根据模型预测得到的最优条件,并根据实际条件进行优化,在丙三醇3.54 mol/L,硫酸镁0.14 mol/L,果糖5%的条件下进行验证试验,得到在此条件下保存48 h后的相对酶活为72.90%,与预测值72.92%接近,说明该模型能较好的预测复合稳定剂维持脂肪酶保存稳定性的情况。对于单一稳定剂而言,其保护能力有限,而复合稳定剂因协同作用能从多方面发挥保护作用,从而起到较好的效果。
3 结论
由于脂肪酶的稳定性较差,不利于其有效、广泛的使用,因此,研究脂肪酶的保存稳定性,寻找最佳的保存方法尤为重要。本实验主要针对室温条件下黑曲霉C2J6脂肪酶的稳定性进行研究,其在复合稳定剂中的稳定性优于单一稳定剂。酶液中添加复合稳定剂的最佳组合:丙三醇3.54 mol/L,硫酸镁0.14 mol/L,果糖5%,此条件下保存48 h后,脂肪酶的相对酶活达72.90%。此法可以为黑曲霉C2J6脂肪酶在低温及室温下的长期保存提供参考,有利于后期脂肪酶的研究及应用。
[1]杨 媛,张 剑.微生物脂肪酶的性质及应用研究[J].中国洗涤用品工业,2017,1(4):47-54.
[2]冯旭东,吕 波,李 春.酶分子稳定性改造研究进展[J].化工学报,2016,67(1):277-284.
[3]王趁趁,丁 超,唐 蕾,等.芥蓝叶片过氧化物酶稳定性的研究[J].食品工业科技,2012,33(3):70-71,312.
[4]DU L W,HUANG M Y,FENG J X.Immobilization of α-amylase on eggshell membrane and Agnanoparticle-decorated eggshell membrane for the biotransformation of starch[J].Starch-Starke,2017,69(1):9-10.
[5]NEELESH S,ARVIND M K.Cicer α-galactosidase immobilization onto chitosan and Amberlite MB-150:optimization,characterization,and its applications[J].Carbohyd Res,2012,35(8):61-66.
[6]ZHI L,JIANG Y,WANG Y,et al.Effects of additive on the thermostability of chlorperoxidase[J].Biotechnol Progr,2007,23(3):729-733.
[7]PATRICIO R,SANTAGAPITA M,FLORENCIA M,et al.Polyethylene glycol-based low gene-ration dendrimers functionalized with β-cyclodextrin as cryo and dehydro-protectant of catalase formulations[J].Biotechnol Progr,2013,29(3):786-795.
[8]CAVELLO I A,CAVALITTO S F,HOURS R A.Biodegradation of a keratin waste and the concomitant production of detergent stable serine proteases fromPaecilomyces lilacinus[J].Appl Biochem Biotechnol,2012,167(5):945-958.
[9]吴少辉,罗廷顺,张成桂,等.pH、无机盐和有机溶剂对美洲大蠊醇提取物中蛋白质稳定性的影响[J].中国实验方剂学杂志,2012,18(21):74-77.
[10]赵黎明.蛋白质工程在提高蛋白质稳定性中的应用[J].中国食品学报,2011,11(2):158-162.
[11]GROMIHA M M,ANOOSHA P,HUANG L T.Applications of protein thermodynamic database for understanding protein mutant stability and designing stable mutants[J].Meth Mol Biol,2016,14(15):71-89.
[12]王卫国,林 强,张仟伟.葡萄皮花色苷的生理活性及稳定性研究进展[J].中国酿造,2016,35(9):5-10.
[13]HASSANI L.Chemical modification of horseradish peroxidase with carboxylic anhydrides:Effect of negative charge and hydrophilicity of the modifiers on thermal stability[J].J Mol Catal B:Enzym,2012,80(1):15-19.
[14]FORDEA J,TULLYA E,VAKUROVB A,et al.Chemical modification and immobilisation of laccase from trametes hirsute and fromMyceliophthora thermophila[J].Enzyme Microb Technol,2010,46(1):430-437.
[15]赵伟超,聂 尧,穆晓清,等.采用复合保护剂提高重组普鲁兰酶稳定性[J].食品与发酵工业,2015,41(5):48-53.
[16]BAHARUM S N,SALLEH A B,BAZAK C N A,et al.Organic solvent tolerant lipase byPseudomonassp.strain S5:stability of enzyme in organic solvent and physical factors affecting its production[J].Ann Microbiol,2003,53(1):75-83.
[17]LIU G,HU S,LI L,et al.Purification and characterization of a lipase with high thermostability and polar organic solvent-tolerance fromAspergillus nigerAN0512[J].Lipids,2015,50(11):1155-1163.
[18]黎志德,曾练强,蚁细苗,等.右旋糖酐酶的保存稳定性研究[J].广西蔗糖,2013,1(4):31-34,18.
[19]张秀艳,何国庆.微生物产β-葡聚糖酶的储存稳定性研究[J].食品科技,2007,1(9):19-22.
[20]SPICKERMANN D,KARA S,BARACKOV I,et al.Alcohol dehydrogenase stabilization by additives under industrially relevant reaction conditions[J].J Mol Catal B:Enzym,2014,103(1):24-28.
[21]SHUKLA A D,SCHNEIDER C P,TROUT B L.Molecular level insight into intra-solvent interaction effects on protein stability and aggregation[J].Adv Drug Deliver Rev,2011,63(13):1074-1085.
[22]段琳琳,李红梅.保护剂对重组大肠杆菌NMN转移酶稳定性的影响[J].工业微生物,2016,46(5):55-60.
[23]ANDREJ M,RASTISLAV V,JONATHAN P,et al.Delipidation of cytochrome c oxidase fromRhodobacter sphaeroidesdestabilizes its quaternary structure[J].Biochimie,2016,125(1):23-31.
[24]MEHDI I,SERVEH S.Recombinant production ofAspergillus flavus uricase and investigation of its thermal stability in the presence of raffinose and lactose[J].3 Biotech,2017,7(3):1-9.
[25]陈 亦,辛 瑜,杨海麟,等.保护剂对胆固醇氧化酶稳定性机理的研究[J].食品与生物技术学报,2013,32(6):661-666.
[26]MUELLER M,NIDETZKY B.Orthophosphate binding at the dimer interface ofCorynebacterium callunaestarch phosphorylase:mutational analysis of its role for activity and stability of the enzyme[J].BMC Biochem,2010,29(11):1-8.
