头孢噻肟不同给药时机治疗妊娠晚期孕妇B族溶血性链球菌感染的临床研究
2018-07-06安莉莉尹保民
刘 昱,安莉莉,尹保民
0 引言
B组溶血性链球菌(Group Bstreptococcus,GBS)是下消化道和泌尿生殖道常见的一种条件性致病菌,属于β型(完全溶血)链球菌中的一种[1],在特殊人群,如孕妇、新生儿、糖尿病患者中的发病率较高,尤其是对于妊娠晚期女性,由于免疫力降低,体内激素水平发生重大变化,GBS的带菌率可高达40%~50%[2],严重影响母婴结局,因此,GBS感染在产科医学中占有不可忽视的地位。国外研究显示,GBS感染是引起围生儿间接致死或致残的最主要的原因之一[3]。在大多数发展中国家,已经将GBS感染作为妊娠期常规筛查项目,建议孕妇在妊娠晚期进行宫颈、直肠分泌物GBS带菌情况检测,并对GBS阳性的孕妇进行合理干预,以尽量降低胎膜早破、母婴感染的风险[4]。但是,在我国,由于早期对女性妊娠期GBS感染的重视度不够,尚缺乏统一的治疗标准[5]。为保证孕妇安全用药,主要采取B类抗生素治疗,包括青霉素类、头孢菌素类、万古霉素类等,尤其是目前临床上未见对头孢噻肟、头孢曲松和利奈唑胺的耐药株[6],因此,建议可采取头孢噻肟进行抗GBS感染治疗。但是其给药时间一直是产科学领域争议的重点,若治疗力度过大,虽然可以降低GBS的阳性率,但也加速了GBS或其他耐药菌株的产生,因此,选择合理的治疗时机和治疗方案对于改善GBS感染孕妇的母婴结局十分重要。本研究通过对2017年1-12月在我院确诊并接受治疗的87例孕妇的临床资料和母婴结局进行分析,为临床合理用药提供理论性指导。
1 资料与方法
1.1 临床资料 选择2017年1-12月在我院产科确诊并接受治疗的95例GBS感染孕妇的临床资料,年龄18~42岁,平均年龄(31.05±4.17)岁。采集阴道和直肠分泌物,经病原学检查确诊为GBS感染。按照随机数字表法,将患者分为对照组(26例)和研究组,其中34例孕妇在临产或胎膜早破时给予头孢噻肟治疗(研究组1),35例孕妇在发现GBS阳性时即采用头孢噻肟治疗3 d,临产或胎膜早破时再次给予头孢噻肟(研究组2)。本项研究已获得本地伦理委员会批准。三组孕妇的年龄、孕次、孕周等一般临床资料比较差异无统计学意义(P>0.05)。见表1。
1.2 入选标准 ①单胎宫内妊娠,经B超证实胎儿存活;②妊娠30~35周行GBS培养显示阳性;③受试前1个月未使用过抗生素;④临床资料完整;⑤孕妇签署知情同意书。
1.3 排除标准 ①不符合上述纳入标准的孕妇;②合并妊娠高血压、糖尿病及其他妊娠合并症者;③合并心、肝、肾功能严重损伤者;④孕期有其他病毒或细菌感染史者;⑤抗生素过敏者;⑥依从性差者等。
1.4 检查方法 2002年美国疾控中心颁布的B族溶血性链球菌取材方法[7],三组孕妇于妊娠30~35周时经阴道采集分泌物进行GBS培养。
1.4.1 样本采集 孕妇呈仰卧位,叉开双腿,充分暴露阴道。采用女性拭子自阴道下1/3处旋转1周,采集分泌物后置于无菌试管中,送检。
1.4.2 细菌培养 将样本接种至COBA平板上,置于5%CO2、37 ℃细菌培养箱中培养18~24 h,观察COBA平板上是否出现粉红色或白灰色GBS菌落;若未见典型菌落,可行肉汤增菌培养。将样本加入至TOD肉汤(TOD肉汤+多黏菌素10 μg/ml+萘啶酸15 μg/ml)中,培养过夜后,再将样本接种至COBA平板培养。发现疑似菌落后,根据菌落形态、溶血特征、生化反应确定是否为GBS感染,再结合族和型特异性血清进行免疫学检测,根据检测结果确定GBS阳性或阴性。
1.5 治疗方案
1.5.1 对照组 该组患者给予常规治疗和干预,包括助产、引产等。
1.5.2 研究组1 在临产或胎膜破裂时静脉注射头孢噻肟(注射用头孢噻肟钠,H20043022石药集团,) 3 g,随后每6 h 1次,2 g/次直至分娩。
1.5.3 研究组2 在确诊GBS阳性时,即静脉注射头孢噻肟2 g,3次/d,持续治疗3 d。临产或胎膜破裂时,继续给予相同注射剂量的头孢噻肟。
1.6 评定标准
1.6.1 产褥期感染 ①急性盆腔炎:患者出现高热、下腹疼痛,血常规检查示血象升高;②子宫感染:患者出现高热、子宫按压痛,阴道分泌物有异味,血常规检查示血象升高;③会阴伤口感染:会阴处疼痛、局部水肿或充血,细菌培养呈阳性。

表1 患者的一般临床资料分析(例,%)
1.6.2 新生儿感染 新生儿体温升高≥37.5 ℃,呕吐、精神差、嗜睡等。
1.6.3 新生儿病理性黄疸 经皮肤测量胆红素≥12.9 mg/dl;排除生理性黄疸。
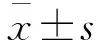
2 结果
2.1 三组孕妇妊娠结局比较 与对照组比较,研究组孕妇胎膜早破、产褥感染、羊水污染、剖宫产、产钳助产及产后出血的发生率均有下降趋势,但是研究组1孕妇与对照组孕妇比较,差异无统计学意义(P>0.05);而研究组2孕妇胎膜早破、产褥感染和羊水污染的发生率明显低于对照组(P<0.05)。见表2。
2.2 三组孕妇新生儿结局比较 研究组孕妇胎儿窒息、新生儿病理性黄疸、胎儿窘迫、新生儿肺炎的发生率均低于对照组(P<0.05)。见表3。
2.3 三组孕妇不良母婴结局比较 研究组1和研究组2不良母婴结局的发生率均低于对照组(P<0.05);但是研究组1和研究组2孕妇不良母婴结局的发生率比较差异无统计学意义(P>0.05)。见表4。
3 讨论
GBS感染是造成围生儿致死和致残的主要原因之一,由于女性妊娠期间免疫功能降低,较正常人群更易感染GBS;且GBS在孕产妇生殖道内定植几率较低,易逆行感染子宫,造成胎儿窘迫甚至死亡[8]。近年来,随着我国产科临床对GBS感染的重视程度加深,加大了对妊娠期女性GBS筛查的力度,越来越多的感染者被确诊并接受相应的干预措施,从而大大降低了GBS感染对母婴结局造成的不良影响[9]。但是由于部分患者未定时行产前检查,造成GBS感染漏诊;或者对GBS感染认识度不够,认为抗生素的使用可影响胎儿发育,而拒绝接受抗生素治疗[10]。本研究中,接受抗生素治疗的研究组1和研究组2孕妇不良妊娠结局和不良新生儿结局发生率均低于未接受抗生素治疗的对照组孕妇,因此,建议临床加大对GBS感染不良影响的宣传力度,让孕产妇充分认识到GBS感染对妊娠和新生儿造成的严重不良结局,并且加强对GBS的筛查力度,提高检出率,早诊断、合理干预对于降低宫内感染率、产褥期感染率或新生儿不良结局至关重要。
目前,临床对GBS感染的治疗主要采用B类敏感性抗生素治疗,建议选择青霉素类、头孢菌素类、万古霉素类抗生素治疗。正确合理地使用抗生素是保护孕产妇、胎儿或新生儿,减少病原菌损害的关键[10]。近年来关于GBS耐药性分布规律的研究显示,GBS对青霉素类药物、头孢吡肟和万古霉素耐药率较低,未见对头孢噻肟、头孢曲松和利奈唑胺耐药菌株。头孢噻肟属于第3代头孢菌素,主要用于革兰阳性菌、革兰阴性菌和厌氧菌感染的治疗,在FDA抗生素分类中属于B级抗生素,可通过胎盘屏障,抑制宫内感染[10-12]。目前,尚没有足够证据证实头孢噻肟有致畸影响,但是也不排除其可能对胎儿或围生儿造成不良影响[13]。建议GBS感染孕妇可采用头孢噻肟治疗,以改善不良母婴结局。但是目前国内外产科临床对于GBS感染缺乏标准的治疗方案。目前,临床对于抗生素的治疗方案一直存有争议,Anderson等[14]在2008年一项关于GBS感染的调查性研究中发现,孕期使用抗生素可能会增加早产的风险。另外,杨恒[15]研究显示,在检出GBS感染时即给予抗感染治疗,在临产或胎膜破裂时再次给予抗生素预防,可明显降低妊娠不良结局的发生率。基于笔者多年的治疗经验和前期调研,认为在临产或胎膜早破时给予抗生素治疗即可以明显改善母婴结局。本研究主要探讨采用头孢噻肟不同给药时间对GBS感染孕妇母婴结局的影响。结果显示,两组孕妇胎膜早破、产褥感染、羊水污染、剖宫产、产钳助产以及产后出血的发生率均低于对照组,且不良妊娠结局(胎膜早破、产褥感染和羊水污染)、不良新生儿结局(胎儿窘迫、胎儿窒息和病理性黄疸)发生率差异无统计学意义。

表2 三组孕妇妊娠结局比较(例,%)
注:*与对照组比较,P<0.05

表3 三组孕妇新生儿结局比较(例,%)
注:*与对照组比较,P<0.05
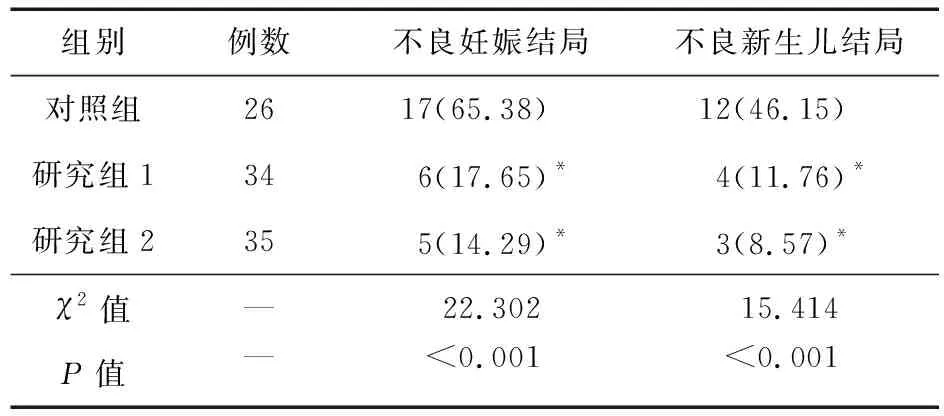
表4 三组孕妇不良母婴结局比较(例,%)
注:*与对照组比较,P<0.05
综上所述,对于妊娠晚期GBS感染的孕妇可选择在产时给予敏感抗生素治疗,对于不良母婴结局的改善作用与确诊时即给予抗生素治疗作用基本一致,但是抗生素使用量较小,避免了抗生素过度使用对胎儿或围生儿造成的不良影响。
参考文献:
[1] Yang Y,Liu Y,Ding Y,et al.Molecular characterization of Streptococcus agalactiae isolated from bovine mastitis in Eastern China[J].PLoS One,2013,8(7):e67755.
[2] Yook JH,Kim MY,Kim EJ,et al.Risk factors associated with group B streptococcus resistant to clindamycin and erythromycin in pregnant Korean women[J].Infect Chemother,2013,45(3):299-307.
[3] Elikwu CJ,Oduyebo O,Ogunsola FT,et al.High group B streptococcus carriage rates in pregnant women in a tertiary institution in Nigeria[J].Pan Afr Med J,2016,25:249.
[4] Verhoeven PO,Noyel P,Bonneau J,et al.Evaluation of the new brilliance GBS chromogenic medium for screening of Streptococcus agalactiae vaginal colonization in pregnant women [J].J Clin Microbiol,2014,52(3):991-993.
[5] 吴卫卫.B族溶血性链球菌感染对孕妇分娩方式及母婴安全性的影响[J].中国妇幼保健,2017,32(7):1444-1446.
[6] 顾晓明.B族溶血性链球菌感染的孕妇经产时抗生素预防治疗后临床效果观察[J].中国现代药物应用,2015,9(6):163-164.
[7] El-Kersh TA,Al-Nuaim LA,Kharfy TA,et al.Detection of genital colonization of group B streptococci during late pregnancy[J].Saudi Med J,2002,23(1):56-61.
[8] Wang P,Tong JJ,Ma XH,et al.Serotypes,antibiotic susceptibilities,and multi-locus sequence type profiles of Streptococcus agalactiae isolates circulating in Beijing,China[J].PLoS One,2015,10(3):e0120035.
[9] 王心,尚丽新.围生期B族链球菌感染诊治及预防新进展[J].医学综述,2016,22(3):530-533.
[10]张淑珍,金卓杏,陈晓方,等.晚期妊娠孕妇B族链球菌感染状况及妊娠结局分析[J].中华医院感染学杂志,2017,27(12):2801-2804.
[11]Nasri K,Chehrei A,Manavi MS.Evaluation of vaginal group B streptococcal culture results after digital vaginal examination and its pattern of antibiotic resistance in pregnant women[J].Iran J Reprod Med,2013,11(12):999-1004.
[12]袁华,封宇飞.头孢噻肟174例不良反应中文文献综述[J].药物流行病学杂志,2014,23(9):573-576.
[13]张娇珍,王小敏,李丽娟.围产期孕妇B族链球菌感染情况和药敏性试验及其与不良妊娠结局的关系[J].中国现代医学杂志,2016,26(6):50-53.
[14]Anderson BL,Simhan HN,Simons K,et al.Additional antibiotic use and preterm birth among bacteriuric and nonbacteriuric pregnant women[J].Int J Gynaecol Obstet,2008,102(2):141-145.
[15]杨恒.克林霉素预防性治疗对妊娠期B组溶血性链球菌感染患者的疗效分析[J].抗感染药学,2016,13(3):583-585.
