外周血单核细胞亚型改变在脑出血进展的临床意义研究
2018-07-06陈欣欣滕伟禹
田 力,陈欣欣,孙 淼,滕伟禹*
0 引言
脑出血(Intracerebral hemorrhage,ICH)是指非外伤性的脑实质内出血,发病率为 3%~14%,急性期致死率高达40%,致残率70%以上,多数幸存者遗留较为严重的神经功能缺损[1-2]。系统性炎症反应是ICH后脑损伤的重要因素,炎性细胞活化、黏附、聚集于血管内皮,释放大量炎性细胞因子及黏附分子,加重了ICH后损伤[3]。研究表明,ICH后患者体内单核细胞处于活化状态,具有较强的促进炎性细胞因子分泌的功能,并通过影响适应性免疫应答参与机体的炎症反应[4]。单核细胞分为3个亚群:经典型(CD14highCD16-)、中间型(CD14highCD16+)和非经典型(CD14lowCD16++),不同亚群在表型、功能及炎症活化潜能方面存在明显差异[5]。中间型单核细胞活化后能产生大量促炎细胞因子,抗原提呈能力增强,促进T细胞活化、增殖,并表达促血管生成的相关因子。因此,中间型单核细胞亚群具有较高的活化炎症反应潜能[6]。本研究拟在外周血水平检测患者单核细胞亚型比例的变化及其在ICH后炎性损伤过程中的作用,探讨外周血单核细胞亚型改变在脑出血进展中的临床意义。
1 材料与方法
1.1 研究对象 选择2015年3月至2017年12月中国医科大学第一附属医院神经内科、中国医科大学附属盛京医院老年病科的ICH患者(ICH组),以及中国医科大学附属盛京医院体检中心进行健康检查的同年龄健康老年人(对照组),年龄均≥60岁。ICH组39例,男20例,女19例,年龄59~85岁,平均(64.75±14.76)岁。对照组男12例,女14例,年龄62~85岁,平均(66.23±12.79)岁,排除既往心脑血管等方面疾病。两组在年龄、性别构成等方面差异无统计学意义(P>0.05),具有可比性。
外周血标本采集及单核细胞分选纳入标准:①符合第4届全国脑血管病学术会议修订的脑出血诊断标准,并经颅脑CT扫描证实;②起病后24 h内入院。排除标准:①非血管性脑卒中、脑动脉瘤或血管畸形破裂、脑肿瘤、创伤或血管夹层造成的脑血管破裂出血、炎症、自身免疫性疾病以及出血或凝血机制异常导致的脑出血;②患有其他脑血管病及神经变性疾病;③合并严重心、肺、肝脏疾病、痛风、感染性疾病或恶性肿瘤。本研究经医院伦理委员会批准,征得参加者知情同意。
1.2 研究方法 分别于ICH后1、3、7 d清晨空腹抽取外周静脉血3 ml,肝素钠抗凝,24 h内完成流式细胞技术检测。
1.3 主要试剂 异硫氰酸荧光素鼠抗人-CD14、叶绿素蛋白偶联物(PerCP-cy5.5)鼠抗人-CD16单克隆抗体及同型对照、莫能霉素、红细胞裂解液、破膜/固定剂、缓冲液等试剂(BD);佛波酯和离子霉素(Sigma);TNF-α、IL-6抗体(Bio-Rad);常规试剂均购自沈阳化学试剂采购供应站。
1.4 流式细胞技术检测外周血中间型单核细胞亚群 按照说明书方法采用每100 μl外周血加入10 μl异硫氰酸荧光素鼠抗人-CD14+、10 μl叶绿素蛋白偶联物鼠抗人-CD16+单克隆抗体,室温避光孵育30 min,红细胞裂解液破坏红细胞后,磷酸盐缓冲液洗涤,500×g离心6 min,弃上清,400 μl磷酸盐缓冲液重悬细胞。用FACS Canto流式细胞仪检测,采用前向散射光和侧向散射光区别单核细胞,以单核细胞设门,读取单核细胞分型比例。
1.5 流式细胞技术检测外周血单核细胞亚群细胞因子平均荧光强度 按照说明书方法,每100 μl外周血加入50 ng/ml佛波酯、1 μg/ml离子霉素和2.0 μmol/L莫能霉素,刺激培养4 h,经红细胞裂解液破坏红细胞后,磷酸盐缓冲液洗涤,500×g离心6 min,弃上清,100 μl磷酸盐缓冲液重悬细胞。加入10 μl异硫氰酸荧光素鼠抗人-CD14+、10 μl叶绿素蛋白偶联物鼠抗人-CD16+,室温避光孵育30 min,磷酸盐缓冲液洗涤,加入500 μl破膜/固定剂,室温避光孵育20 min,缓冲液洗涤并重悬,100 μl细胞悬液中加入10 μl藻红蛋白-鼠抗人TNF-α或 IL-6抗体,室温避光孵育30 min。磷酸盐缓冲液洗涤,400 μl磷酸盐缓冲液重悬细胞。以中间型单核细胞设门,读取TNF-α和IL-6的平均荧光强度。
1.6 ELISA方法检测血清细胞因子浓度 取外周血2 ml,500×g离心5 min,收集血清,-80 ℃冰箱冻存。按试剂说明书方法检测TNF-α、IL-6浓度。
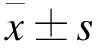
2 结果
2.1 ICH后患者外周血单核细胞向中间型极化 与对照组比较,ICH后1、3、7 d中间型及非经典型单核细胞亚群比例均明显增加(P<0.01),3 d时增加更显著;而经典型单核细胞亚群比例在ICH后1、3、7 d显著下降(P<0.01)。见表1。
2.2 ICH后患者外周血中间型单核细胞内炎性因子含量比较 与对照组比较,ICH后3、7 d外周血中间型及非经典型单核细胞胞内TNF-α和IL-6 平均荧光强度升高,差异均有统计学意义(P<0.05)。见表2。
2.3 ICH后患者血清细胞炎性因子浓度比较及其与中间型单核细胞比例的相关性 ICH后3、7 d患者血清浓度高于对照组,差异均有统计学意义(P<0.05)。见表2。ICH后3、7 d患者中间型单核细胞亚群比例与血清 IL-6、TNF-α 呈正相关(r3d=0.397、0.325,r7d=0.308、0.362,P<0.05)。
3 讨论
考虑到全血更能代表机体内自然状况,本研究采用全血细胞直接检测,也避免了先分离单个核细胞过程中可能会导致细胞异常活化所产生的影响。研究结果显示,与同年龄健康对照者相比,ICH组患者ICH后1、3、7 d中间型及非经典型单核细胞亚群比例均有明显升高,其中ICH后3 d时升高更显著;同时经典型单核细胞亚群比例在ICH后各时间点均有下降,这一结果符合目前关于系统免疫反应参与了脑卒中后损伤的观点[7-9]。但中间型单核细胞在ICH后的活化情况及其与疾病进展的关系尚未见文献报道。
外周血中间型单核细胞比例增加可能是自身免疫性和感染性疾病的普遍现象[10-12],单核细胞在类风湿性关节炎、1型糖尿病、动脉粥样硬化、阿尔茨海默病、帕金森病、多发性硬化及脑炎等多种自身免疫性疾病、神经变性疾病及中枢神经系统感染性疾病的病理过程中发挥重要作用,其中单核细胞活化分型后异常分泌致炎因子是重要环节[13]。在中枢系统疾病中,单核细胞及淋巴细胞活化后更易于穿越血脑屏障进入脑实质,从而更多地参与疾病进展,为疾病的治疗提供了靶点,因此,探讨ICH后炎性损伤机制,从而寻找能有效降低炎症反应、减轻脑组织损伤的治疗措施是本研究的目的。
本研究还显示,与健康对照者相比,患者ICH后3、7 d外周血中间型及非经典型单核细胞胞内TNF-α、IL-6 平均荧光强度升高,表明单核细胞活性明显增加分泌高浓度的促炎细胞因子[14]。同时患者ICH后3、7 d血清TNF-α、IL-6浓度高于对照组。TNF-α和IL-6均属于致炎细胞因子,主要作用是通过参与机体炎症的发生发展过程,启动炎症反应通路。病理情况下血清TNF-α、IL-6水平与心肌功能损害程度具有一定的相关性[15-16];脑血管病患者急性期血清TNF-α、IL-6水平均明显增高。TNF-α主要产生于中枢神经系统内的神经细胞、血管内皮细胞、小胶质细胞等,可将中性粒细胞、神经细胞等有效激活,诱导IL-6、一氧化氮(NO)产生,导致人体血管内皮细胞破坏、通透性增加,引发微循环障碍。进一步的研究显示,患者ICH后3、7 d中间型单核细胞亚群比例与血清 IL-6、TNF-α 呈正相关,与目前研究结果基本一致[17]。

表1 两组患者外周血单核细胞亚型变化[M(P25~P75),%]
注:与对照组比较,*P<0.01

表2 两组患者外周血中间型单核细胞内IL-6、TNF-α平均荧光强度及血清浓度比较
注:与对照组比较,*P<0.01
综上所述,本研究表明,ICH后急性期外周血中间型单核细胞比例升高,并分泌较多的促炎细胞因子(IL-6、TNF-α),参与ICH后的炎性损伤过程。据此可以得出以下结论,调控ICH患者急性期单核细胞向中间型极化,或阻断中间型单核细胞分泌致炎因子,可能成为抑制ICH后炎性损伤的新途经,但患者ICH后中间型单核细胞活化的确切机制尚需进一步研究。本研究结果提示,外周血生物标本比较容易采集,根据患者外周血单核细胞亚型比例与炎性因子相关性变化可能作为疾病预后的评估指标之一,具有潜在的临床意义。
参考文献:
[1] Wang J.Preclinical and clinical research on inflammation after intracerebral hemorrhage[J].Progress Neurobiol,2010,92 (4):463-477.
[2] Boehme AK,Hays AN,Kicielinski KP,et al.Systemic inflammatory response syndrome and outcomes in intracerebral hemorrhage[J].Neurocritical Care,2016,25(1):133-140.
[3] Laranjeira P,Gomes J,Pedreiro S,et al.Human bone marrow-derived mesenchymal stromal cells differentially inhibit cytokine production by peripheral blood monocytes subpopulations and myeloid dendritic cells[J].Stem Cells Int,2015,(1,article 3):819084.
[4] Zarif JC,Hernandez JR,Verdone,et al.A phased strategy to differentiate human cd14+monocytes into classically and alternatively activated macrophages and dendritic cells[J].Biotechniques,2016,61(1):33-41.
[5] Zungsontiporn N,Tello RR,Zhang G,et al.Non-classical monocytes and monocyte chemoattractant protein-1 (MCP-1) correlate with coronary artery calcium progression in chronically HIV-1 infected adults on stable antiretroviral therapy[J].PLoS One,2016,11(2):e0149143.
[6] Cherry JD,Olschowka JA,O′Banion MK.Neuroinflammation and M2 microglia:the good,the bad,and the inflamed[J].J Neuroinflammation,2014,11(1):98.
[7] Hammond MD,Roslyn A.CCR2+Ly6Chi Inflammatory monocyte recruitment exacerbates acute disability following intracerebral hemorrhage[J].J Neurosci,2014,34(11):3901-3909.
[8] Mracsko E,Veltkamp R.Neuroinflammation after intracerebral hemorrhage[J].Frontiers Cellular Neurosci,2014,8:388.
[9] Li M,Li Z,Ren H.Colony stimulating factor 1 receptor inhibition eliminates microglia and attenuates brain injury after intracerebral hemorrhage[J].J Cereb Blood Flow Metab,2014,37(7):2383-2395.
[10]Boehme AK,Comeau ME,Langefeld CD,et al.Systemic inflammatory response syndrome,infection,and outcome in intracerebral hemorrhage[J].Neurol Neuroimmunol Neuroinflamm,2017,5(2):e428.
[11]Wang Z,Zhou F,Dou Y,et al.Melatonin alleviates intracerebral hemorrhage-induced secondary brain injury in rats via suppressing apoptosis,inflammation,oxidative stress,DNA damage,and mitochondria injury[J].Translational Stroke Res,2017,9(1):1-18.
[12]Wyss-Coray T.Ageing,neurodegeneration and brain rejuvenation[J].Nature,2016,539 (7628):180-186.
[13]Ding R,Lin C,Wei S.Therapeutic benefits of mesenchymal stromal cells in a rat model of hemoglobin-induced hypertensive intracerebral hemorrhage[J].Mol Cells,2017,40(2):133-142.
[14]Liu W,Yuan J,Zhu H.Curcumin reduces brain-infiltrating T lymphocytes after intracerebral hemorrhage in mice[J].Neurosci Letters,2016,620:74-82.
[15]Liew HK,Cheng HY,Huang LC,et al.Acute alcohol intoxication aggravates brain injury caused by intracerebral hemorrhage in rats[J].J Stroke Cerebrovasc Dis,2016,25(1):15-25.
[16]Zheng H,Chen C,Zhang J. Mechanism and therapy of brain edema after intracerebral hemorrhage[J].Cerebrovasc Dis,2016,42(3-4):155-169.
[17]Savarraj JP,Parsha K,Hergenroeder GW.Systematic model of peripheral inflammation after subarachnoid hemorrhage[J].Neurology,2017,88(16):1535-1545.
